基于蛋白氧化行为的肉及肉制品品质提升及劣变机制研究进展
2020-11-27刘昊天殷小钰汪海棠孔保华
刘昊天,殷小钰,汪海棠,孔保华,陈 倩
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
肉及肉制品在生产加工、运输及贮藏过程中极易受到温度、光照及氧气等促氧化条件的影响而发生蛋白质氧化进而导致产品品质的下降[1]。长期以来,脂质氧化一直被认为是影响肉及肉制品品质特性的主要原因,然而关于蛋白质氧化对肉及肉制品的影响在近年来也逐渐受到关注[2-3]。肌原纤维蛋白(myofibrillar protein,MP)作为肌肉蛋白主要组成部分,对肉制品的质构特性、风味特性以及加工特性起着决定性的作用[1-4]。MP氧化诱导造成的构象变化会影响其功能性质,进而对肉制品品质造成一定的影响[5-6]。
在过去的几年中,许多研究都是围绕蛋白质氧化所引发的肉制品品质劣变而展开的。活性氧(reactive oxygen species,ROS)自由基引发的蛋白质氧化所形成的羰基衍生物与肉制品品质劣变密切相关[6];Bertram等[7]指出,MP氧化所诱导的蛋白质交联会导致肌肉组织的保水性下降;此外,有报道称蛋白质氧化会降低蛋白质对酶的敏感性,从而影响肌肉的嫩度及质构特性[8]。目前,已有研究者对蛋白质氧化所导致的肌肉品质特性劣变进行了综述,例如陈洪生等[9]对氧化引起的肌肉蛋白功能性质变化及其控制技术进行了综述;袁凯等[10]对肉及肉制品中蛋白质氧化所导致的劣变机制进行了综述,并对近年来此方向的研究进行了归纳总结。
然而,近年来有研究指出,蛋白质的氧化对肉及肉制品的品质特性并非完全有弊无利,在适度氧化的条件下,其对肉制品的加工特性及品质特性具有一定的改善作用。Liu Gang等[11]研究表明,在适当的氧化条件下,蛋白质氧化可以提高蛋白质对酶的敏感性,从而促进其在人体内的消化吸收;Zhou Feibai等[12]利用羟自由基氧化体系对MP进行了氧化修饰,结果表明在特定氧化剂浓度下,氧化修饰可以改善MP对特定风味物质的结合能力,这有助于肉制品在加工过程中风味的保持。因此,本文对蛋白质氧化及其对肉及肉制品品质的改善及劣变诱导机制进行了详细阐述,并对现有的国内外研究进行了归纳总结,以期对以蛋白质氧化作为新型加工手段在肉及肉制品中的应用提供理论参考。
1 肉及肉制品中蛋白质氧化及其发生机制
动物体经屠宰后,肌肉组织的结构和新陈代谢会遭到破坏,进而打乱机体内原有的氧化-还原平衡,使氧化作用处于主导地位[1]。早期研究通常认为肉及肉制品品质的劣变与脂质氧化以及微生物作用有直接关系。而如今的研究证实,蛋白质同样可受到ROS自由基基团的攻击而造成氧化损伤,进而对肉及肉制品的品质造成一定的影响。过去对蛋白质氧化的研究主要集中在医学领域,如蛋白质氧化所引发的肌肉萎缩、阿尔茨海默症等[13]。Xiong Youling L.等[14]在1993年研究了火鸡肉中MP氧化对鸡肉品质特性的影响,首次将蛋白质氧化引入肉品体系中。与油脂氧化类似,蛋白质氧化同样是通过自由基所引发的一种链式反应,但相对于油脂氧化,蛋白质氧化的诱导因素更为复杂,并且所形成的氧化产物种类较多[9]。与植物蛋白不同的是,肌肉组织中包含更多的促氧化因子,如脂类、亚铁血红素以及过渡态金属离子等,这些物质可作为产生ROS自由基或非自由基的前体物质以及催化剂来诱导氧化反应的发生[15-17]。因此,在肉体系中蛋白质会不可避免地受到ROS自由基的攻击而造成一定程度的氧化损伤[18]。
一般而言,蛋白质氧化往往会通过自由基和非自由基物质引发。其中,自由基物质包括羟自由基(·O H)、超氧化物自由基(O2·)、羧自由基(RS·)以及脂自由基(ROO·)等;而非自由基物质包括过氧化氢(H2O2)、单线态氧(1O2)以及一些活性醛基和酮基[15]。这些活性物质通常由外部因子的作用而产生,如辐射、紫外线、金属离子等。在肌肉组织中,这些活性物质通常会与一些内源性因子相互作用来促进氧化反应的发生,如氧化酶、氧化脂质、还原糖以及包含亚铁血红素的促氧化血红素蛋白[8]。在这些促氧化因子的作用下,ROS自由基会夺取蛋白质(PH)中的氢原子并产生以C—为中心的蛋白质自由基来引发自由基介导的蛋白质氧化途径(反应1);在随后的反应中,蛋白质自由基在氧气存在的条件下会转化为烷过氧自由基(POO·)(反应2);烷过氧自由基再夺取另一个蛋白质中的氢原子并与还原状态下的Fe2+或质子化形式的超氧自由基进行反应生成烷基过氧化物(POOH)(反应3);之后POOH会与ROS自由基(如HO2·)或还原态过渡金属(Mn+)进一步反应生成烷氧自由基(PO·)(反应4、5)以及羟基衍生物(POH)(反应6、7)[19]。此外,烷基过氧化物和烷氧自由基均可通过α-酰胺化或二酰胺途径造成肽链的断裂,并产生胺类物质和羰基衍生物或二酰胺衍生物和异氰酸酯衍生物[20]。

2 蛋白质氧化所导致的化学变化及其对蛋白质功能性质的影响
2.1 蛋白质氧化所导致的化学变化
蛋白质受自由基攻击后会造成肽链骨架结构的改变以及氨基酸侧链的氧化修饰等,进而对蛋白质的结构以及功能性质造成一定的影响。蛋白质氧化所导致的化学变化大致可分为以下5 种:1)蛋白质自由基的形成;2)疏水相互作用导致的蛋白质交联;3)敏感氨基酸基团氧化所导致的氨基酸侧链基团的修饰;4)蛋白质自由基与特定氨基酸位点反应导致的肽链断裂;5)分子间相互作用诱导的蛋白质构象的改变[15,21](图1)。
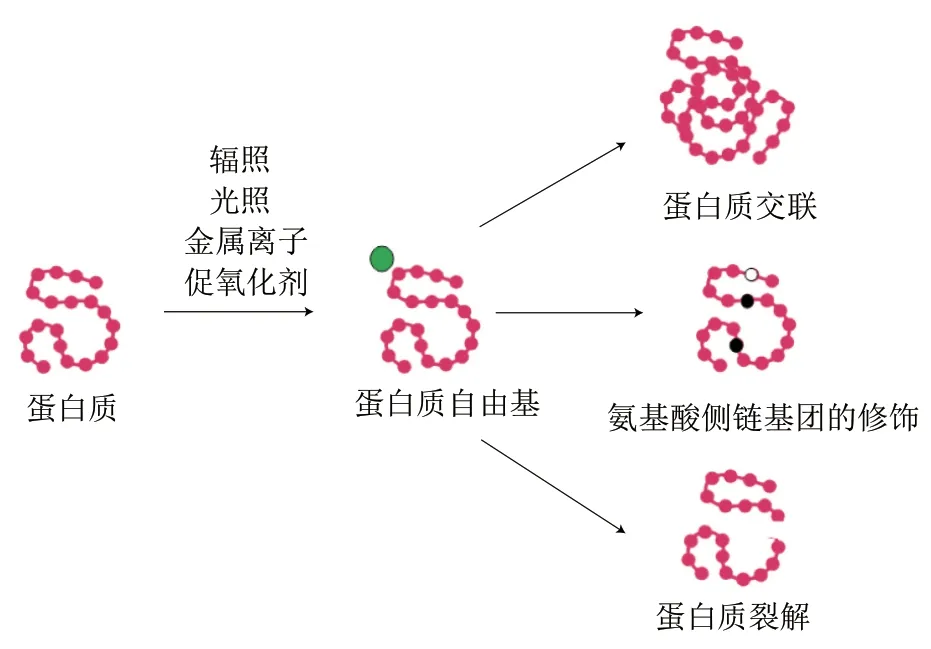
图1 蛋白质氧化所导致的化学变化Fig. 1 Chemical changes caused by protein oxidation
2.1.1 氨基酸侧链基团的修饰
氨基酸侧链基团的氧化修饰是蛋白质氧化的主要反应结果,通常由敏感性氨基酸与自由基或者促氧化因子间的相互作用引发[22]。一些含硫的氨基酸如甲硫氨酸和半胱氨酸对ROS自由基以及氧化脂质较为敏感;色氨酸残基在金属离子的存在下可以迅速发生氧化;而一些氨基酸残基如酪氨酸、苯丙氨酸、脯氨酸、组氨酸、精氨酸、亮氨酸以及缬氨酸等需在特定的位点处与促氧因子结合才能发生氧化[23]。氨基酸侧链基团氧化的实质是通过羰基化、脂肪族氨基酸的羟基化、蛋氨酸残基磺化、巯基的亚硝化或羟基化以及芳香族氨基酸的硝化来对必需氨基酸进行氧化修饰[22]。由于过程复杂,所涉及的途径较多,因此,蛋白质氧化所产生的氧化产物较脂质氧化产物更为繁多。表1列举出了一些敏感氨基酸氧化产物,在一些研究中常利用这些物质作为生物标记物来对蛋白质的氧化程度进行评价[24]。
蛋白质的羰基化反应是蛋白质氧化中一种较为重要的化学修饰结果,它是一种不可逆的非酶促反应。羰基化合物的形成是金属离子催化而导致蛋白质氧化的典型特征[15]。在肉体系中,羰基化合物通常由脯氨酸、赖氨酸和苏氨酸残基通过金属离子催化氧化而形成[22]。如图2所示,在Fe3+存在时,会引发中间自由基分子的氧化脱氨作用,在此作用下赖氨酸会转化为α-氨基己二酸(α-amino adipic,AAS);精氨酸和脯氨酸则转化为γ-谷氨酸半醛(γ-glutamic semialdehydes,GGS);苏氨酸转化为α-氨基-3-酮丁酸。与此同时,反应形成的Fe2+在H2O2的存在下可继续与其他氨基酸进行反应生成羟自由基[20]。另外,一些金属离子以及亚铁血红素也可以与H2O2反应来促进AAS和GGS的形成。所得羰基化合物还可进一步地进行氧化降解(如AAS降解生成α-氨基己二酸半醛)或与一些羟基类物质形成羟醛缩合产物(Schiff碱或Strecker醛)[37]。除了氨基酸侧链的直接氧化,少量的蛋白质羰基化合物还可通过其他途径生成,如肽链骨架结构的裂解、还原糖存在下的非酶促糖基化反应以及脂质氧化反应所产生的脂质羰基物质与蛋白质间的共价结合[5]。因此,在食品体系中,蛋白质的氧化与其他一些生化反应(如美拉德反应以及脂质氧化反应等)有密切的联系。

表1 敏感氨基酸的常见氧化产物Table 1 Oxidation products of the most susceptible amino acid residues
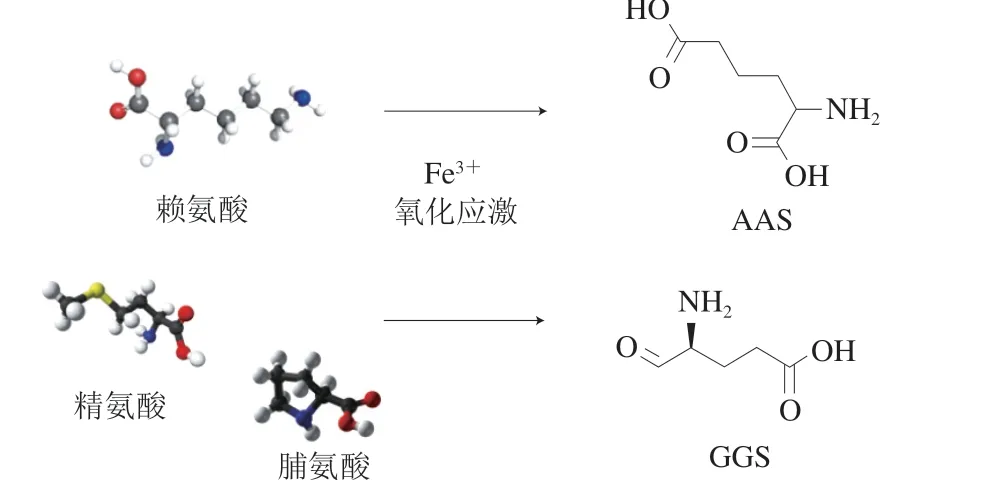
图2 羰基化合物形成途径Fig. 2 Formation pathway of carbonyl compounds
2.1.2 蛋白质交联和裂解
分子间或分子内的交联是蛋白质氧化反应的另一种表现。蛋白质交联往往伴随着大分子物质的聚集并可产生多种氧化产物[38]。在肌肉组织中,过渡态金属离子和亚铁血红素是导致蛋白质交联的主要因素[11]。此外,两个以C—为中心的蛋白质自由基同样可以在无氧的条件下发生交联[22]。这一反应的主要驱动力是共价作用,例如在H2O2的存在下,含有半胱氨酸的蛋白质或肽在经过一系列复杂的氧化反应后,其所含的反应性巯基中的氢原子易被自由基以及其他一些活性基团取代,在此条件下,半胱氨酸中的巯基所含的硫原子在接下来的反应中会与其他蛋白质分子中的硫原子形成共价单键,进而形成二硫键诱导的蛋白质交联[15]。此外,蛋白质中的酪氨酸经自由基催化反应后可转变为酪氨酰苯氧自由基,相邻酪氨酰基的聚合可形成二聚酪氨酸,同样可以导致蛋白质交联[18]。
蛋白质氧化反应还可导致蛋白质骨架结构的裂解,这一反应主要由自由基氧化剂引发。蛋白质经自由基攻击后,自由基可与多肽链上的一些特异性位点结合而导致肽链的断裂,进而影响蛋白质的二级和三级结构[22]。此外,部分结合位点在结合的同时还会释放一些氧化产物,例如脯氨酸、天冬氨酸和谷氨酰胺的残基,它们与自由基结合后不仅会造成肽链的断裂,还会有小部分羰基化衍生物形成[23]。
2.2 蛋白质氧化对其功能性质的影响
蛋白质氧化所导致的氨基酸侧链基团的修饰往往会导致蛋白质三维立体构象的改变[15]。而蛋白质的功能性质在很大程度上依赖于其分子结构。因此,肌肉蛋白的氧化通常会伴随着其功能性质的变化,例如凝胶性、乳化性、溶解性等,进而对肉及肉制品的品质特性造成一定的影响。
MP的热凝胶性和乳化性质决定了肉制品的质构特性及最终的感官特性[1]。以往的研究中指出,蛋白质氧化所导致的羰基化反应会改变MP的电荷性质,进而降低蛋白质-蛋白质分子和蛋白质-水分子间的静电作用力,最终导致溶解性的降低[15,39]。Xia Xiufang等[40]对循环冷冻解冻处理后的MP的凝胶性和乳化性进行了测定,结果表明,MP在解冻过程中导致的蛋白质氧化会使蛋白质表面疏水性升高、变性焓值下降。此外,蛋白质氧化诱导的蛋白质聚集会使其乳化稳定性在5 次冷冻-解冻循环后下降43%,并且还伴随着黏弹性凝胶网络结构强度的降低。Bertram等[7]指出,MP的氧化会导致其凝胶强度的降低,其根本原因是蛋白质溶解性的降低。此外,蛋白质通过其双亲性及表面活性作用于脂滴表面而与其他脂滴产生相互作用力,在相邻脂滴间相互作用力的驱动下,达到一种互不相溶且分布均匀的分散状态,最终实现乳化作用。其中,静电相互作用是较为主要的一种作用力,其大小主要取决于蛋白质所带电荷的性质。因此,蛋白质的氧化也会对其乳化性质造成一定的影响[41]。
最新报道表明,适度氧化条件对蛋白质溶解性、凝胶性等功能性质有一定的改善作用[42-43]。Chen Xing等[44]的研究指出,在羟自由基存在的条件下,适量的H2O2会增大鸡胸肉MP的溶解度并增强其热稳定性,具体机制可通过H2O2对巯基的屏蔽效应来解释,在适量H2O2的存在下,会诱导蛋白活性巯基转换成次磺酸和亚磺酸中间体,最终形成稳定的磺酸基团,对活性巯基起到封闭效果进而抑制加热过程中由二硫键介导的蛋白质聚集,增强蛋白质热稳定性。Parkington等[5]发现牛心肌经冷冻贮藏后,其蛋白质的氧化修饰会促进蛋白质-蛋白质分子间的相互作用,提高凝胶强度。Zhang Muhan等[45]在对三文鱼MP进行氧化处理时,同样发现了在适度氧化的条件下可以提高其凝胶强度和质构特性。Xiong Youling L.等[46]对肌球蛋白进行了氧化修饰,发现其在加热过程中尾部之间会形成低聚体,而低聚体还会与肌球蛋白的头部进行相互作用,这有利于凝胶网络的形成。
在以往的研究中,通常认为氧化会降低蛋白质溶解性、热稳定性、凝胶性等功能性质,在加工或研究过程中往往会选择避免或抑制此类现象的发生。而近期研究表明,适当的氧化条件可以改善蛋白质的一些功能性质。因此,可以将蛋白质氧化看作一种新型的蛋白质加工手段,或者在加工过程中加以调控达到提高产品品质的目的。例如对蛋白质进行适当的氧化修饰,能够提高其在低离子强度溶液中的溶解性和热稳定性,从而实现肉蛋白在低盐加工中的充分利用;对于鱼肉蛋白凝胶类制品,在水产养殖生产中考虑氧化环境的影响,或者对蛋白质进行适当处理来提高鱼糜凝胶制品的质量等[43-47]。
3 蛋白质氧化诱导肉及肉制品品质劣变和提升的可能机制
MP的结构以及功能性质决定了肉及肉制品的品质特性,而氧化所导致的MP结构的改变必定会影响肉及肉制品的品质,并且多数报道称肉蛋白的氧化会导致肉及肉制品品质的劣变。然而近年来的研究发现,在特定的氧化条件下,蛋白质氧化对肉及肉制品的品质还具有一定的改善作用。
3.1 蛋白质氧化对肌肉保水性的影响
肌肉的保水性依赖于肌肉组织中蛋白质结合水分子的能力,其关键在于蛋白质表面的水合作用以及肌纤维晶格的毛细管效应[48]。此外,MP和肌浆蛋白中的羰基数量以及肌肉组织中蛋白质的交联对肌肉的保水性同样具有一定的影响[49]。通常来说,肌肉蛋白质是具有双亲性的大分子物质,而蛋白质氧化诱导的蛋白构象变化会使原本位于分子内部的疏水性位点暴露出来,从而提高蛋白质的疏水性,使蛋白质表面水合作用降低,进而导致肌肉保水性的降低[29]。在肌肉组织中,相邻的肌球蛋白、相邻的肌动蛋白以及肌球蛋白与肌动蛋白之间存在一定的表面间距,这部分空间可容纳大约60~90 个水分子。Sun Weizheng等[50]的研究表明,蛋白质氧化所诱导的蛋白质交联会改变肌纤维间的表面间距,从而造成水分子的流失。肌纤维间所产生的毛细管效应同样有助于水分的保持,而蛋白质氧化诱导的肌球蛋白和肌动蛋白的交联或变性会导致肌纤维束间产生收缩力,并且在肌间线蛋白的作用下,将这种收缩力传递至整个肌纤维,进而导致MP的收缩脱水[47]。Li Yanqing等[51]对鲤鱼MP在羟自由基氧化体系中的功能性质的变化进行了探究,结果表明,在不同浓度H2O2条件下,鲤鱼MP凝胶保水性会呈现不同程度的降低。Xiong Youling L.等[46]利用羟自由基氧化体系对牛心肉糜中的MP进行氧化修饰,结果同样表明在高浓度H2O2条件下,蛋白质所形成的聚集体会导致凝胶结构刚性变差,持水性降低。此外,Zhang Wangang等[47]的研究表明,蛋白质氧化还会影响生物膜的渗透性和完整性,导致滴水损失的增加,肌肉保水能力降低。然而,在现有的研究中还鲜有关于蛋白质氧化提升肌肉保水性的报道。
3.2 蛋白质氧化对肌肉嫩度的影响
嫩度是肉及肉制品重要的食用品质之一,肌肉蛋白质的结构状态是影响嫩度的决定性因素[1]。多数研究已经证实肉在宰后成熟过程中的嫩化主要是由于肌纤维通过内源性水解酶(钙蛋白酶、组织蛋白酶、半胱天冬酶)的催化降解所致。其中,钙蛋白酶系统是嫩化作用的主要诱导因素[52]。在肌肉组织中,起到水解作用的钙蛋白酶有两种,即m-钙蛋白酶与μ-钙蛋白酶,虽然两种蛋白酶作用于MP时具有相同的靶向和切割位点,但要使m-钙蛋白酶完全活化所需的钙离子浓度要远远高于宰后机体内的钙离子浓度(最大约210~230 μmol/L),所以需向胴体内引入外源性钙离子才能使其完全发挥活性。因此,在宰后肌肉嫩化中起主要作用的是μ-钙蛋白酶[52]。
过去的研究发现,在肌肉的成熟过程中蛋白质的氧化与肉的嫩度之间具有一定的相关性。Lametsch等[53]利用羟自由基氧化体系对MP进行氧化修饰,并对钙蛋白酶的活性进行测定,结果表明,高浓度H2O2会导致μ-钙蛋白酶失活,这主要是由于钙蛋白酶的活性位点包含组氨酸以及含巯基的胱氨酸残基,而氧化会导致活性位点中巯基转化为二硫键,最终使钙蛋白酶失活。此外,Chen Qianqian等[26]研究发现,ROS自由基诱导的蛋白质构象变化会导致蛋白质间形成共价交联,形成的蛋白质聚集体会掩盖原本位于表面的活性位点,降低蛋白质对钙蛋白酶的敏感性。因此,可以认为在高度氧化的条件下,二硫键的形成是导致肉及肉制品嫩度下降的主要因素。
然而,Xue Mei等[25]的研究表明,在适度氧化的条件下,MP的解构现象会暴露出原本位于内部的酶切活性位点,进而提高肌球蛋白重链和β-肌动蛋白的酶敏感性,促进μ-钙蛋白酶的水解作用,但同时又降低了肌钙蛋白T对μ-钙蛋白酶的敏感性,抑制了其降解。因此,可以认为宰后相同水平的氧化作用对不同蛋白降解的影响效果并不一致。近期研究指出,在羟自由基氧化体系下,H2O2诱导所产生的ROS自由基会通过降低超氧化物歧化酶、过氧化氢酶和谷胱甘肽过氧化物酶的活性来增加脂质过氧化作用进而促进线粒体中的细胞凋亡,最终提高肉的嫩度[54]。此外,Malheiros等[55]利用蛋白质组学的方法对蛋白质氧化损伤与宰后牛肉嫩度之间的关系进行了分析,结果表明酮体经屠宰后产生的ROS自由基一方面会对肌动蛋白、肌球蛋白、肌联蛋白和结蛋白等一些结构蛋白进行氧化修饰;另一方面则会协同钙蛋白酶降解氧化后的结构蛋白进而破坏MP结构,提高肉的嫩度。因此,结合目前的研究结果,可以认为适度的氧化修饰对肉的嫩度具有改善作用。
3.3 蛋白质氧化对风味的影响
通常情况下,脂肪的氧化对肉品风味的形成起主导作用,过去的研究通常认为蛋白质氧化会引发脂肪自由基链式反应而导致肉制品风味的劣变[2-3,23]。然而,最近的研究发现,蛋白质氧化过程中氨基酸侧链修饰所产生的羰基衍生物会参与Strecker降解反应进而生成挥发性风味物质(如3-甲基正丁醇、2-甲基丙酸乙酯、2-甲基丁酸乙酯等),这些物质对肉制品,特别是发酵肉制品中的风味形成有着积极作用[56]。以异亮氨酸为例,在受到ROS自由基攻击的氧化应激条件下,异亮氨酸会生成氨基自由基,之后存在两个途径:一是不成对的电子被金属离子吸收形成氨基离子,最后进行水合反应形成α-二羰基化合物(AAS、GGS),最终参与Strecker降解形成特征性风味化合物;二是氨基自由基继续与其他蛋白质分子进行反应,形成蛋白质自由基,循环自由基链式反应[57](图3)。

图3 蛋白质氧化过程中风味物质的形成途径Fig. 3 Formation pathway of flavor substances derived from protein oxidation
蛋白质除了自身可以形成风味物质的前体物质外,还具有结合/释放特征风味物质的能力,其本质是大分子物质与小分子物质之间的相互作用[58]。蛋白质与风味物质间的相互作用有助于挥发性成分在贮藏和加工过程中的保持。二者之间的结合方式主要分为两种:一种是物理结合,包括范德华力和毛细管效应;另一种是化学结合,包括静电作用、疏水作用、氢键以及共价键的结合。其中,疏水作用力是较为重要的相互作用力[59]。
蛋白质的疏水区域主要包括表面疏水区域以及位于分子内部的疏水空穴,而有研究表明,在适度氧化的条件下,蛋白质的去折叠现象会导致内部疏水位点的暴露,这可以促进风味物质在蛋白质表面的吸附[12]。肉蛋白中的含硫氨基酸(如半胱氨酸和甲硫氨酸)中的巯基在氧化条件下形成二硫键,其可与风味物质发生交联,增加蛋白质与风味物质的结合程度。而氢键的结合主要存在于醇类物质与蛋白质的结合中[60]。除疏水键、二硫键以及氢键等非共价作用力之外,Wang Kun等[61]发现蛋白质氧化产生的羰基类化合物可与蛋白质中的氨基酸残基间形成共价键(—SH和—NH2),继而形成共价结合。共价结合也是一种重要的结合作用力,它是一种不可逆的强相互作用,所形成的共价复合物较为稳定。Wang Kun等[59]还利用规避分子间作用力的方法探究了蛋白质与风味物质间的作用方式,结果表明醛类物质与蛋白质间主要依靠共价相互作用。目前,关于蛋白质氧化对其结合风味物质能力影响的研究多数集中于成分简单的豌豆蛋白、乳清蛋白等。而由于肌肉蛋白结构的复杂性,相关研究较少。Zhou Feibai等[12]利用羟自由基体系对MP进行不同程度的氧化修饰,并观察其对结合风味物质能力的影响,发现适度氧化可以提高蛋白质结合风味物质的能力。因此,可以认为适度的蛋白质氧化对于肉制品中的挥发性成分的保持具有一定的积极作用。在肉制品加工中,可以针对这一特性提高产品的风味。
4 结 语
目前,国内外对于蛋白质氧化在食品体系中诱导机理的研究取得了一定的进展,但在食品体系尤其是肉制品体系中,其作用机制的研究较少。此外,过去的研究往往集中于蛋白质氧化对食品体系的负面影响,例如蛋白质氧化会导致肉及肉制品的保水性、质构特性以及消化率的下降;而其对于肉及肉制品的积极影响则鲜有报道。近年来,有研究指出在适度氧化的条件下可以改善肉及肉制品的品质特性,例如可以提高肌肉蛋白质对内源性水解酶的敏感性,以此改善肉的质构以及消化特性,并且适度氧化对风味的形成也有一定的积极作用。基于此,可以将蛋白质氧化作为一种新型的修饰或加工手段,或者在饲育养殖、生产加工过程中结合环境因素选取适当的抗氧化剂加以调控,进而提高产品品质。但在目前的实际加工过程中,对于蛋白质氧化所造成的影响仍缺乏系统的评价。因此,建立具体加工环境中蛋白质氧化的评价体系对于肉及肉制品的加工具有重要的意义。
