鹰嘴豆肽对免疫低下小鼠免疫功能的影响
2020-11-27李睿珺周雅琳于兰兰陈宇涵许雅君
李睿珺,秦 勇,周雅琳,刘 伟,李 雍,于兰兰,陈宇涵,许雅君,2,*
(1.北京大学公共卫生学院,北京 100191;2.食品安全毒理学研究与评价北京市重点实验室,北京 100191)
鹰嘴豆是南亚、中东、北非等地的一种主要食用豆类,因其耐干旱、耐寒冷及生物固氮等特性,广泛种植于我国北部、西部等干旱及半干旱地区[1-2]。鹰嘴豆含有丰富的营养,是优质的植物蛋白,研究发现,其功效比值、消化吸收及生物利用率远高于大豆等豆类[3],因而享有“豆中之王”的美誉。鹰嘴豆肽是提取自鹰嘴豆的植物多肽,具有溶解性好、稳定性高和易于消化吸收等优点[4]。近年来研究表明,鹰嘴豆肽作为一种重要的生物活性肽,具有调节糖代谢[4]、抗氧化[5-13]、抗肿瘤[6,14-15]、促进脂肪代谢和降低胆固醇[7]、降血压[16]等功能,但是,目前国内外关于鹰嘴豆肽对免疫功能调节作用的研究较少。本实验通过分析鹰嘴豆肽对环磷酰胺致免疫低下小鼠的体质量、免疫脏器指数及形态、骨髓细胞核、细胞因子、白细胞计数、T淋巴细胞亚群等指标的影响,探究其免疫调节作用。以期为开发植物类多肽的保健应用提供新思路,为拓宽地区特色鹰嘴豆的商业用途提供理论依据的同时促进西部农村经济发展。
1 材料与方法
1.1 动物、材料与试剂
健康SPF级雄性ICR小鼠60 只,6~8 周龄,体质量22.0~28.0 g,生产许可证号:SCXK(京)2016-0010,由北京大学医学部实验动物中心提供。动物饲养在屏障环境中,温度控制在(23±2)℃,相对湿度为50%~60%,昼夜照明时间12 h/12 h。实验期间动物自由进食和饮水。
鹰嘴豆肽是以鹰嘴豆为原料,经过蛋白质提取、复合酶解以及多级膜分离提纯等工艺步骤制得的小分子肽类混合物,大部分分子质量小于1 000 Da,主要工艺流程包括调浆乳化、浸提、蛋白酶解、离心分离、灭酶、浓缩、灭菌、喷雾干燥等步骤。依据GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》,用氨基酸自动分析仪测定鹰嘴豆肽的氨基酸组成及含量(表1)。用高效液相色谱对酶解物的相对分子质量分布进行分析,鹰嘴豆肽的相对分子质量分布见图1。

表1 鹰嘴豆肽氨基酸组成及含量Table 1 Amino acid composition of chickpea peptide

图1 鹰嘴豆肽相对分子质量分布Fig. 1 Relative molecular mass distribution of chickpea peptide
免疫球蛋白(immunoglobulin,Ig)M、IgG、干扰素-γ(interferon-γ,IFN-γ)、白介素(interleukin,IL)-2、IL-2、IL-4、IL-5、IL-9和IL-17A试剂盒 南京建成生物工程研究所;酪蛋白、环磷酰胺 美国Sigma公司。
1.2 仪器与设备
SPN3001F电子天平 奥豪斯仪器(上海)有限公司;FLUOstar Omega多功能酶标仪 德国BMG Labtech公司;E400正置荧光显微镜 日本Nikon公司;BFX5-320型低温自动平衡离心机、FACS Calibur流式细胞仪 美国BD公司;MEK-6318K全自动血细胞分析仪 日本光电工业株式会社;HH·S11-1电热恒温水浴锅 上海双旭电子有限公司。
1.3 方法
1.3.1 实验分组及受试样品给予
实验动物适应性喂养3 d后,称量其体质量记为初始体质量,并按体质量随机分为空白组、环磷酰胺模型组及鹰嘴豆肽低、中、高剂量组,每组各12 只。实验前3 d,除空白组外,其余各组每天腹腔注射80 mg/kgmb的环磷酰胺建立免疫低下小鼠模型[17-19],空白组注射等量的生理盐水。第4天起,每天灌胃空白组和环磷酰胺模型组小鼠1.6 g/kgmb酪蛋白,鹰嘴豆肽低、中、高剂量组分别灌胃0.4、0.8、1.6 g/kgmb鹰嘴豆肽溶液,灌胃体积为0.1 mL/(10 gmb),连续灌胃15 d后隔夜禁食,次日晨起检测各项指标。
1.3.2 检测指标
1.3.2.1 体质量和免疫脏器指数测定
适应性喂养3 d后,小鼠称质量记为初始体质量,并根据体质量随机分组,腹腔注射环磷酰胺3 d后称质量记为造模后体质量,灌胃15 d后称质量记为终末体质量。动物处死前再次称质量,供免疫脏器指数计算时使用。各组动物摘眼球取血后断颈处死,用电子天平称量分离的脾脏和胸腺组织,用脏器质量(mg)除以小鼠处死前体质量(g)得到小鼠脾脏指数和胸腺指数[20]。
1.3.2.2 脾脏和胸腺形态学观察
将称质量后的脾脏和胸腺固定于质量分数4%的多聚甲醛溶液中,石蜡包埋、切片、苏木精-伊红(hematoxylin-eosin,HE)染色,显微镜下选取适当倍数,观察脾脏和胸腺组织的形态学改变。
1.3.2.3 外周血白细胞计数
动物摘眼球取血后,取适量全血于乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)抗凝管中,充分混匀,用全自动血细胞分析仪对白细胞进行计数[19]。
1.3.2.4 外周血T淋巴细胞亚群检测
动物摘眼球取血,取适量全血于EDTA抗凝管中,吸取50 μL全血于流式管,加入3 种荧光染料缀合的抗体,吹打混匀。室温下避光孵育30 min,每隔5 min摇晃混匀,然后加入1 mL裂解液,裂解完成后加入1 mL磷酸盐缓冲液,1 500 r/min离心5 min,弃上清液,弹散细胞。加入1 mL磷酸盐缓冲液清洗细胞,350×g离心5 min,弃上清液,加入200 μL的2%多聚甲醛溶液重悬细胞,用流式细胞仪检测CD3+细胞、CD4+细胞及CD8+细胞亚群比例。
1.3.2.5 外周血免疫球蛋白质量浓度测定
动物摘眼球取血,3 000 r/min离心10 min制得血清,取50 μL血清,按照酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒说明书检测血清中IgG和IgM的质量浓度。
1.3.2.6 血清中细胞因子水平测定
另取200 μL血清,按照ELISA试剂盒说明书检测血清中IFN-γ、IL-2、IL-4、IL-5、IL-9和IL-17A的质量浓度[21]。
1.3.2.7 骨髓有核细胞计数和DNA质量浓度
每组随机选择6 只小鼠,取其右腿股骨进行骨髓有核细胞计数:剔除股骨附着的结缔组织和肌肉,用1 mL Hank’s液将骨髓冲至已经加入了EDTA的离心管内。吸取0.38 mL的盐酸溶液(0.1 mol/L)于另一离心管,加入混匀后的骨髓液20 μL,再次混匀,静置2~3 min待红细胞溶解。将20 μL上述溶液注入细胞计数板进行计数。
另取剩余6 只小鼠右腿股骨进行骨髓DNA质量浓度检测:吸取10 mL的CaCl2溶液(5 mmol/L),将骨髓注入离心管中,4 ℃环境下放置30 min,2 500 r/min离心15 min,弃上清液,向沉淀中加入5 mL 0.2 mol/L的HClO4溶液,充分混匀后在90 ℃的水浴锅水浴15 min,冷却至室温,3 500 r/min离心15 min后,将20 μL上清液注入96 孔板,用多功能酶标仪在260 nm波长处测定吸光度A260nm并计算骨髓的DNA质量浓度。
1.4 数据统计分析
实验结果均为连续变量,以平均值±标准差表示。所有数据均用SPSS 20.0软件进行统计分析。采用单因素方差分析比较组间差异,以P<0.05为有统计学差异的判断标准。方差齐时,用SNK法进行两两比较;方差不齐时,用Tamhane’s法进行两两比较。
2 结果与分析
2.1 体质量和免疫脏器指数的变化

表2 鹰嘴豆肽对免疫抑制小鼠体质量和免疫脏器指数的影响Table 2 Effect of chickpea peptide on body mass and immune organ indexes of immunocompromised mice
如表2所示,各组小鼠初始体质量无统计学差异(P>0.05),环磷酰胺造模3 d后,4 个造模组小鼠体质量与空白组相比均极显著降低(P<0.01),但实验15 d后的终末体质量各组间无显著差异(P>0.05)。各组小鼠胸腺指数之间无显著差异(P>0.05);与空白组相比,模型组、鹰嘴豆肽低剂量和高剂量组脾脏指数增大(P<0.01);与模型组相比,鹰嘴豆肽低、中、高剂量组脾脏指数均有降低,但差异无统计学意义(P>0.05)。
2.2 免疫脏器形态学观察结果
镜下脾脏HE染色切片如图2所示,空白组脾脏组织结构清晰完整,脾小结发育良好,红髓、白髓清楚可辨,边缘区界限清晰。模型组红髓与白髓界限模糊,脾小结存在破损现象,脾脏肿大。与模型组相比,鹰嘴豆肽低、中、高剂量组脾小结有所恢复,结构逐渐清晰,中、高剂量组基本恢复到空白组水平。

图2 鹰嘴豆肽对免疫低下小鼠脾脏组织形态学变化的影响(×100)Fig. 2 Effect of chickpea peptide on morphological changes in spleen tissues of immunocompromised mice (× 100)
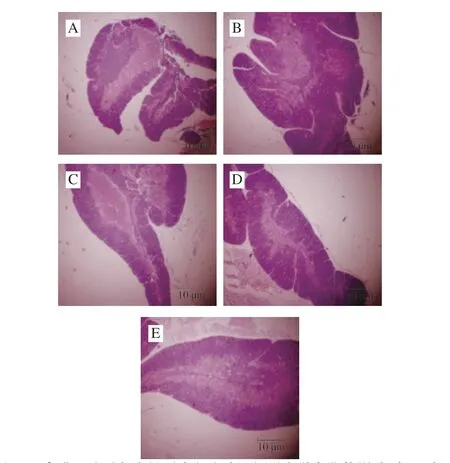
图3 鹰嘴豆肽对免疫低下小鼠胸腺组织形态学变化的影响(×40)Fig. 3 Effect of chickpea peptide on morphological changes in thymus tissue of immunocompromised mice (× 40)
镜下胸腺HE染色切片如图3所示,空白组胸腺皮质和髓质结构清晰,皮质染色较深且面积较大,可观察到排列紧密的淋巴细胞。模型组胸腺皮质和髓质分界不清,可观察到皮质面积减小和髓质面积增加,皮质区淋巴细胞数量减少。与模型组相比,鹰嘴豆肽低、中、高剂量组皮质面积增加,皮、髓交界逐渐清晰,中、高剂量组基本恢复到空白组水平。
2.3 外周血白细胞数的变化

表3 鹰嘴豆肽对免疫低下小鼠外周血白细胞计数的影响Table 3 Effect of chickpea peptide on white blood cell count of immunocompromised mice
如表3所示,与空白组相比,模型组小鼠外周血白细胞计数有所下降(P<0.05);鹰嘴豆肽干预后,各剂量组白细胞计数逐渐恢复,与模型组相比,高剂量组外周血白细胞计数显著增加(P<0.05),且基本恢复到空白组水平。
2.4 外周血T淋巴细胞亚群的变化

表4 鹰嘴豆肽对免疫低下小鼠外周血T淋巴细胞亚群的影响Table 4 Effect of chickpea peptide on T lymphocyte subsets in peripheral blood of immunocompromised mice
如表4所示,各组间CD3+、CD4+、CD8+淋巴细胞比例均无显著差异。与空白组相比,模型组各项指标均有所降低,鹰嘴豆肽干预的中、高剂量组有不同程度的恢复,但差异无统计学意义(P>0.05)。
2.5 外周血免疫球蛋白含量的变化

表5 鹰嘴豆肽对免疫低下小鼠外周血免疫球蛋白IgG、IgM质量浓度的影响Table 5 Effect of chickpea peptide on the contents of immunoglobulin G and immunoglobulin M in peripheral blood of immunocompromised mice
如表5 所示,与空白组相比,模型组和鹰嘴豆肽各干预组外周血I g G 和I g M 质量浓度均有所降低(P<0.05),与模型组相比,鹰嘴豆肽低剂量组的IgG质量浓度和中剂量组的IgM质量浓度有一定程度的恢复,但差异无统计学意义(P>0.05)。
2.6 血清中细胞因子水平的变化
如表6所示,与空白组相比,模型组细胞因子质量浓度均增加,大部分表现出统计学差异(P<0.05)。与模型组相比,鹰嘴豆肽中、高剂量组小鼠血清中IL-17A质量浓度显著降低(P<0.05),且低于空白组水平。与模型组相比,小鼠血清中IL-2质量浓度随鹰嘴豆肽剂量增加而逐渐降低,且在高剂量组中表现出统计学差异(P<0.05),并低于对照组水平。与模型组相比,鹰嘴豆肽低、中、高剂量组小鼠血清中IL-5质量浓度显著降低(P<0.05),且在中、高剂量组低于空白组水平。与模型组相比,鹰嘴豆肽低、中、高剂量组小鼠血清中IL-9质量浓度均有所降低,且在低剂量组中表现出统计学差异(P<0.05)。与模型组相比,鹰嘴豆肽低、中、高剂量组小鼠血清中IL-4质量浓度随鹰嘴豆肽剂量增加而降低,且逐渐恢复至空白组水平,但差异无统计学意义(P>0.05)。与模型组相比,鹰嘴豆肽各干预组小鼠血清中IFN-γ差异无统计学意义(P>0.05)。

表6 鹰嘴豆肽对免疫低下小鼠外周血细胞因子水平的影响Table 6 Effect of chickpea peptide on cytokine levels in peripheral blood of immunocompromised mice
2.7 骨髓有核细胞数和DNA质量浓度的变化

表7 鹰嘴豆肽对免疫低下小鼠骨髓有核细胞数和DNA质量浓度的影响Table 7 Effect of chickpea peptide on the number of nucleated cells and DNA content in bone marrow of immunocompromised mice
如表7所示,与空白组相比,模型组的骨髓有核细胞浓度和DNA质量浓度极显著降低(P<0.01)。与模型组相比,鹰嘴豆肽低、中、高剂量组骨髓有核细胞浓度均有不同程度的升高,在中、高剂量组表现出统计学差异(P<0.05),且基本恢复至空白组水平。与模型组相比,鹰嘴豆肽干预后各组小鼠骨髓DNA质量浓度有不同程度的恢复,但差异无统计学意义(P>0.05)。
3 讨 论
越来越多的研究显示,生物活性肽具有调节机体生命活动和某些特定生理活性的功能,如抗菌、抗肿瘤、抗氧化、降胆固醇、增强免疫、调节血压等[22-24]。研究表明,多种豆类多肽具有增强免疫的作用。大豆肽能增加白细胞数量,提高血清溶血素、IgM和IgG水平,增强巨噬细胞吞噬鸡红细胞、自然杀伤细胞的活性,增加CD8+、CD11b+、CD49b+和CD56+的数量,并上调免疫相关基因的表达[25-30]。豌豆肽对免疫功能具有改善作用[31-32]。绿豆肽具有免疫调节功能,可通过抑制巨噬细胞自噬,改变细胞因子水平而发挥免疫调节活性[33]。
鹰嘴豆是一种脂肪含量较低、蛋白质功效比值较高、消化率较高的植物类食品,鹰嘴豆经蛋白酶解后得到的鹰嘴豆肽仍是一种高蛋白、低脂肪的产品,其多肽含量高,脂肪质量分数低至0.86%,且水分和灰分含量都极低。鹰嘴豆肽必需氨基酸种类齐全且相对分子质量小,易于消化吸收[34]。鹰嘴豆肽作为一种生物活性肽,现已发现有多种生物活性功能,但其调节免疫功能的研究却鲜有报道。实验中所用鹰嘴豆肽富含的氨基酸包括谷氨酸、天冬氨酸、亮氨酸、赖氨酸、苯丙氨酸、缬氨酸、异亮氨酸、精氨酸、甘氨酸、脯氨酸等,其中谷氨酸和天冬氨酸含量最高。已有研究显示具有免疫调节功能的食源性蛋白肽多是包含2~10 个残基和具有一定疏水性的短肽,有谷氨酸、天冬氨酸、精氨酸、色氨酸、酪氨酸和半胱氨酸等疏水性氨基酸的蛋白肽具有较强的免疫调节活性[35-42]。因此,推测鹰嘴豆肽的免疫活性可能与其氨基酸组成有关。
众所周知,环磷酰胺是一种常用的细胞毒性药物,广泛应用于抗肿瘤治疗,可抑制骨髓功能,降低白细胞数量。其细胞毒性作用是化学反应代谢产物的结果,这些代谢产物通过产生交联来烷基化DNA和蛋白质。据报道,环磷酰胺可抑制小鼠免疫器官功能并导致体质量减轻,还能引起外周血中各种血细胞的失衡,最终导致免疫功能的抑制[43]。
本实验通过连续3 d腹腔注射环磷酰胺,建立免疫低下小鼠模型,给予鹰嘴豆肽灌胃干预15 d,评价鹰嘴豆肽对免疫功能的调节作用。实验选用相同饲养条件下的小鼠作为空白组,考虑到鹰嘴豆肽本身作为蛋白质水解的中间产物,也有一定的蛋白功能,故给予空白组和模型组小鼠和高剂量鹰嘴豆肽组相同剂量的酪蛋白以消除可能由于总蛋白摄入差异造成的影响。
本实验结果显示,各组小鼠初始体质量与终末体质量均无显著差异,但造模后小鼠体质量降低,提示环磷酰胺具有明显的毒性,这与以往的研究结果[44]一致。
脾脏和胸腺是机体质量要的免疫器官,胸腺是T细胞分化成熟的场所,脾脏富含B、T淋巴细胞和巨噬细胞,是免疫反应的主要场所,也是动物最大的免疫器官,它们的形态结构和功能状态在一定程度上反映了机体的免疫情况。本次实验中,模型组小鼠的脾脏指数较空白组显著增加,病理检查结果提示存在脾脏充血、水肿和增生肥大;与模型组相比,鹰嘴豆肽低、中、高剂量组脾脏指数降低,提示脾脏充血、水肿和增生肥大有所缓解。在鹰嘴豆肽干预下,脾脏和胸腺的组织形态出现了明显改善。与空白组相比,模型组小鼠的脾脏和胸腺镜下可见结构紊乱,发育较差,而经鹰嘴豆肽干预后,小鼠的脾脏和胸腺组织结构逐渐恢复。提示鹰嘴豆肽对两大免疫器官有一定的保护和修复损伤的作用。
骨髓是造血过程的主要场所,也是机体质量要的免疫组织,经分化可以产生各种血细胞而发挥其生理功能,是人体免疫中不可缺少的部分[44]。白细胞因为具有吞噬功能,在抵御病原体的入侵方面起着关键作用,是机体中重要的免疫细胞。白细胞数量下降会导致免疫应答减弱,增加感染风险[45]。因此,骨髓和白细胞的状况也可以反映机体的免疫情况。本实验观察到环磷酰胺造模后,小鼠外周血白细胞计数、骨髓有核细胞浓度和骨髓DNA质量浓度相比空白组均显著降低,并在鹰嘴豆肽干预后出现不同程度的恢复。提示鹰嘴豆肽可以改善免疫低下小鼠的骨髓抑制状态和免疫功能。
IgG是血清中含量最高的免疫球蛋白,是主动免疫后机体产生的主要抗体,在体液免疫中最为重要,在免疫监视、抗感染、吞噬和溶解靶细胞中发挥重要作用,IgM是血清中分子质量最大的免疫球蛋白,在初次免疫中占有重要地位,在机体防御机制中发挥抗感染作用,其在血清中的含量能体现机体的体液免疫功能。本实验中,模型组小鼠血清IgG和IgM质量浓度有所降低,并在部分鹰嘴豆肽干预组得到恢复。提示鹰嘴豆肽可能通过恢复IgG和IgM质量浓度来增强机体的体液免疫。
T淋巴细胞是介导机体特异性免疫应答的主要效应细胞[46]。根据其表面标志物的不同,可分为CD3+、CD4+、CD8+等细胞亚群,其中CD3+为成熟T细胞表面标志,可代表T细胞的总体水平,CD4+细胞即辅助T细胞,在细胞免疫中起辅助作用,CD8+细胞即细胞毒性T细胞,通过降低淋巴细胞的活性,发挥抑制细胞免疫的作用。适当的CD4+和CD8+淋巴细胞亚群比例和计数是免疫调节的关键。T淋巴细胞亚群的不平衡会导致免疫功能紊乱,导致一系列的免疫病理改变,影响机体的免疫保护机制[47]。在本实验中,与空白组相比,各组小鼠CD3+、CD4+、CD8+细胞亚群比例有所降低,但在鹰嘴豆肽干预的中剂量组有一定程度的恢复。说明鹰嘴豆肽对免疫低下小鼠的细胞免疫有一定的改善作用。
环磷酰胺会导致细胞因子释放,这些因子在宿主对抗感染和炎症的免疫应答中起着重要作用。细胞因子是由免疫细胞和某些非免疫细胞经刺激后合成、分泌的一类具有广泛生物学活性的小分子蛋白质或肽类,通过结合相应受体后调节细胞的生长和分化,从而调控免疫应答[46]。环磷酰胺对细胞因子的影响主要是影响Toll样受体(Toll-like receptor,TLR)2和TLR4信号通路,激活核因子κB,导致下游多种炎症因子(如IL-17A、IL-2、IL-4、IL-5和IFN-γ[48-49])的改变而产生生物学效应。本实验中,相比空白组,多数模型组细胞因子浓度明显升高,经鹰嘴豆肽干预后,IL-17A、IL-2、IL-5和IL-9质量浓度均显著降低并向空白组回归。提示鹰嘴豆肽可能通过影响IL-17A、IL-2、IL-5、IL-9等细胞因子的分泌而影响其介导的免疫反应,改善机体的免疫功能。
本实验初步探究了鹰嘴豆肽对环磷酰胺致免疫低下小鼠的体质量、免疫脏器指数、免疫组织形态结构、外周血白细胞数量、外周血T淋巴细胞亚群、细胞因子、骨髓有核细胞和DNA浓度的影响,结果提示鹰嘴豆肽对环磷酰胺所致免疫低下小鼠的多项免疫功能均有较显著的改善作用,为鹰嘴豆肽的进一步开发利用提供了理论依据。
