国标法测定水中苯胺类化合物的不足与改进
2020-11-27李会平李赛男李明华王小燕
李会平,李赛男,李明华,王小燕
(青岛科技大学化学与分子工程学院,山东 青岛 266042)
苯胺是重要的化工原料,对人和生物危害极大,其含量是环境监测的重要指标,环境水中苯胺的测定是环境化学专业学生重要的实验内容。苯胺测定方法主要有分光光度法[1,2],荧光法[3],色谱法[4-6]等,其中国标法最经典。在实验教学中发现,该方法虽然灵敏度高,检测限低,但存在如下问题:(1)显色剂N-(1-萘基)乙二胺溶液浓度大,难于溶解,致使溶液浑浊,试剂空白值高,散射严重;(2)苯胺标准溶液用0.05 mol·L-1硫酸配制,导致后续的酸度调节操作难于标准化;(3)高浓度的苯胺储备液(约5000 m·gL-1)直接稀释为10 m·gL-1的苯胺使用液,稀释倍数太大而引起的操作误差;(4)重氮化反应及显色反应的酸度范围,直接影响反应时间和吸光度值,是最重要的实验条件之一。在国标法中用固体KHSO4调节标准溶液酸度,操作繁琐,且用固体KHSO4和无水Na2CO3调节水样酸度,可能导致水样盐度增大,使结果偏低[7]。以上诸因素导致国标法操作复杂、分析时间长、试剂空白值高、测定精密度和准确度差。
针对以上问题,分别从标样配制和稀释方法改进、酸度调节剂改变和操作方法标准化、显色剂配制方法和用量优化等方面,对国标法测定水中苯胺类化合物进行了探索和改进。简化了实验操作,降低了试剂空白、提高了实验精密度。并用改进后的方法测定了印染废水中苯胺的含量,通过精密度及回收率实验,并与国标法比较,评价了本实验方法。
1 实验部分
1.1 主要仪器与试剂
(1)仪器:Cary 60型紫外可见分光光度计(安捷伦),分析天平(梅特勒),PB-10型酸度计(赛特利斯),磁力搅拌器,1 cm玻璃比色皿,25 mL比色管,容量瓶(25 mL、50 mL),移液管(1.0 mL、2.0 mL、10.0 mL),吸量管(5.0 mL、10.0 mL),精密pH试纸(0.5~5.0)。
(2)试剂:5000 mg·L-1苯胺标准水溶液,5000 mg·L-1苯胺标准(0.05 mol·L-1H2SO4)溶液,NaOH(6 mol·L-1、0.1 mol·L-1),H2SO4(10 mol·L-1、0.05 mol·L-1),KHSO4(s),Na2CO3(s),5.0% NaNO2,2.5%氨基磺酸铵,20 g·L-1N-(1-萘基)乙二胺盐酸盐水溶液,5.0 g·L-1N-(1-萘基)乙二胺盐酸盐(0.05 mol·L-1H2SO4)溶液,实验用水为二次去离子水。
1.2 标样储备液和使用液的配制
(1)国标方法:加入10 mL 0.05 mol·L-1H2SO4于25 mL容量瓶中,称准至0.0001 g,加苯胺35滴,再称量,用0.05 mol·L-1H2SO4稀释,定容。此储备液浓度约为5000 mg·L-1。使用时直接将此溶液用0.05 mol·L-1H2SO4稀释至10 mg·L-1的苯胺使用液(现用现配)。
(2)改进方法:加入10 mL水于25 mL容量瓶中,称准至0.0001 g,滴加35滴苯胺,再称量,用水稀释,定容。此储备液浓度约为5000 mg·L-1。使用时先将此溶液用水稀释10倍,再配成浓度为10 mg·L-1的苯胺使用液(现用现配)。
1.3 酸度的调节
(1)国标方法:将水样过滤后,用KHSO4或无水Na2CO3调节pH=6,作为试样。在制作标准曲线和测定水样时,重氮化反应要求的酸介质,均以KHSO450 mg加入比色管中,用pH精密试纸(0.5~5.0)控制pH=1.5~2.0(不可用试纸直接测定酸度,需预先取另一份相同体积的该水样作为参考值)。
(2)改进方法:将水样过滤后,根据其酸度可先用10 mol·L-1H2SO4或6 mol·L-1NaOH调pH约为6,再用0.05 mol·L-1H2SO4或0.1 mol·L-1NaOH精调pH=6,作为试样。在制作标准曲线和测定水样时,重氮化反应要求的酸介质,均加入1.0 mL 0.05 mol·L-1H2SO4于比色管中,控制 pH=1.5~2.0(不必测定酸度)。
1.4 显色剂的配制
(1)国标方法:称2 gN-(1-萘基)乙二胺盐酸盐,溶于水中(必要时可温热助溶)。稀释至100 mL,过滤后使用。此溶液浓度为20 g·L-1。
(2)改进方法:称0.5 gN-(1-萘基)乙二胺盐酸盐,溶于100 mL 0.05 mol·L-1H2SO4中,过滤后使用。此溶液浓度为5.0 g·L-1。
1.5 标准曲线的制作及水样的测定
(1)国标方法:准确移取按国标法配制的10 mg·L-1苯胺标准溶液0.0、0.5、1.0、2.0、3.0、4.0 mL于6支25 mL比色管中,加水至10 mL,加入KHSO450 mg,摇匀,加1滴5% NaNO2溶液,摇匀,静置3 min,加入0.5 mL 2.5%氨基磺酸铵,充分振荡,静置3 min,待气泡除尽后,加入1.0 mL 20 g·L-1N-(1-萘基)乙二胺盐酸盐水溶液,用水稀释至刻度,摇匀,静置30 min,用1 cm的比色皿,以试剂空白为参比液,在545 nm处测定吸光度A,制作标准曲线。准确移取适量水样(含苯胺0.5~30 μg),以同样方法测定水样中苯胺,用标准曲线法计算结果。
(2)改进方法:准确移取按改进方法配制的10 mg·L-1苯胺标准溶液0.0、0.5、1.0、2.0、3.0、4.0 mL于6支25 mL比色管中,各加入1.0 mL 0.05 mol·L-1H2SO4,加水至10 mL,摇匀。加1滴5% NaNO2溶液,摇匀,放置3 min,加入0.5 mL 2.5%氨基磺酸铵,充分振荡,放置3 min,待气泡除尽后,加入8.0 mL 5.0g·L-1N-(1-萘基)乙二胺盐酸盐(0.05 mol·L-1H2SO4)溶液,用水稀释至刻度,摇匀,放置40 min,后续操作及水样测定同1.5(1)国标方法。
2 结果与讨论
2.1 标样配制方法的改进
2.1.1 标样的配制溶剂的改进
国标法中苯胺标准溶液用0.05 mol·L-1硫酸为溶剂,在制作标准曲线时,因不同浓度的溶液中加入的标准溶液体积不同(0.5~4.0 mL),所以在后续的酸度调节步骤中,各浓度的标准溶液中,需加入的固体KHSO4质量不同,且各标准溶液调节酸度时不可用试纸直接测定,均需预先取另一份相同体积的该水样作为参考值,操作繁琐,耗时费力,各溶液pH难于完全一致。
改进方法中苯胺标准溶液用水配制(苯胺在水中的溶解度为3.7 g/100 g), 在制作标准曲线时,各浓度的标准溶液浓度的标准溶液pH相同,在后续的酸度调节步骤中,每种溶液中,需加入的0.05 mol·L-1硫酸体积相同,操作简便,且各溶液pH完全一致。
2.1.2 标样稀释倍数的改进
国标法中苯胺标准储备液(约5000 mg·L-1)直接稀释为10 mg·L-1的苯胺使用液,如配制苯胺使用液体积为50 mL,移取储备液体积仅为0.10 mL,按读数误差最低为±0.01 mL计算,仅此项引起的浓度误差就为±10%。改进方法中先将苯胺标准储备液用水稀释10倍,再配成浓度为10 mg·L-1的苯胺使用液,从而把因稀释倍数引起的浓度误差降至±1.2%。
2.2 酸度的调节方法改进及用量优化
2.2.1 水样酸度调节方法改进:
国标法中水样经过滤后,用固体KHSO4或无水Na2CO3调节pH=6。印染厂含苯胺废水常常碱度很大,需要加入大量的固体KHSO4才可调节pH=6,这使得水样的盐度加大,使苯胺测定值偏低。改进方法中水样过滤后,先用10 mol·L-1H2SO4或6 mol·L-1NaOH溶液粗调pH约为6,再用0.05 mol·L-1H2SO4或0.1 mol·L-1NaOH溶液精调pH=6,操作简便,有效避免了水样的盐度加大产生的测定误差。
2.2.2 重氮化反应酸度调节方法改进及用量优化
重氮化反应前,国标法以KHSO4为酸度调节剂,用精密pH试纸控制pH=1.5~2.0,因不可用试纸直接测定酸度,需预先取另一份相同体积的该溶液作为参考值。这种方法除了如2.2.1中所述的导致溶液盐度加大之外,操作繁琐,费时费力且不易精确控制溶液酸度。
改进方法中,以0.05 mol·L-1H2SO4为酸度调节剂。为确定0.05 mol·L-1H2SO4用量,取7支25 mL比色管,各加入苯胺标准溶液(10 mg·L-1)1.0 mL,分别加入不同体积的 0.05 mol·L-1H2SO4,加水稀释至10 mL摇匀,用酸度计测定其pH值,结果见表1。
由表1可知,当0.05 mol·L-1H2SO4加入量在1.0~2.0 mL时,即可满足pH=1.5~2.0。本实验选择加入1.0 mL 0.05 mol·L-1H2SO4,这样在制作标准曲线和测定水样时,不必测定酸度即可精确控制溶液pH在要求的范围。
表1 重氮化反应酸度调节剂用量
Table 1 The dosage of acidity regulator for diazo reaction.0.05 molL-1 H2SO4
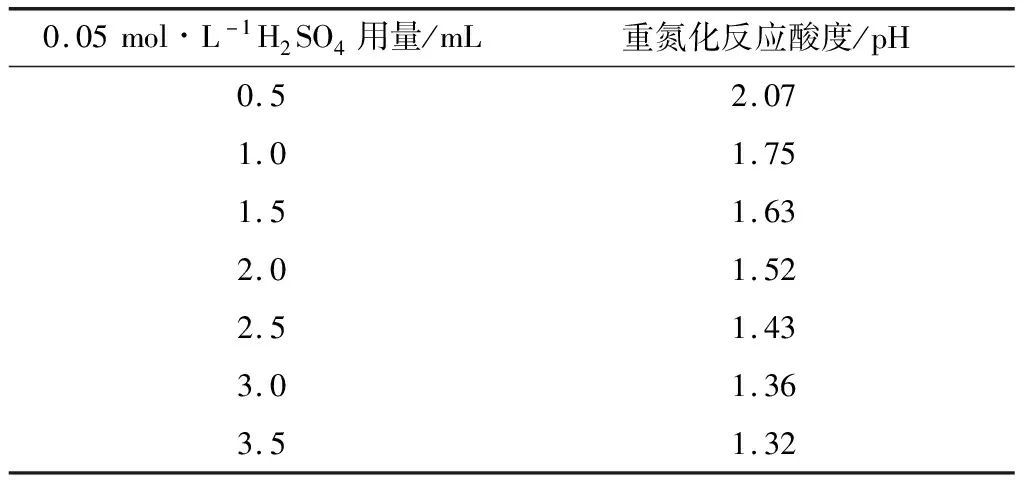
表1 重氮化反应酸度调节剂用量
0.05mol∙L-1H2SO4用量/mL重氮化反应酸度/pH0.52.071.01.751.51.632.01.522.51.433.01.363.51.32
2.2.3 显色反应酸度控制
重氮化后,显色反应酸度需在pH=1.0~2.0之间进行。国标法显色剂为20 g·L-1N-(1-萘基)乙二胺盐酸盐水溶液,加入量为1.0 mL。改进法显色剂为5 g·L-1N-(1-萘基)乙二胺盐酸盐(0.05 mol·L-1H2SO4)溶液,加入量为8.0 mL。显色反应完毕测定各标准溶液的酸度,数据见表2。
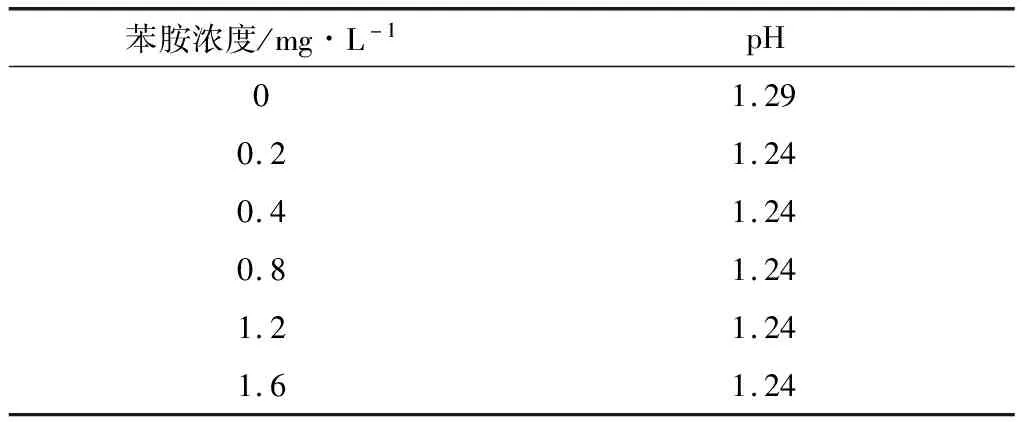
表2 改进法的显色反应酸度
由表2可知,改进法中显色剂以0.05 mol·L-1H2SO4为溶剂,显色反应酸度在pH=1.0~2.0之间,并且因前面的重氮化反应酸度控制精确,后面的显色剂加入量一致,所以改进法各标准溶液的显色反应酸度条件完全一致,可有效提高测定数据的精密度。
2.3 显色剂的配制方法改进、显色时间及用量选择
2.3.1 显色剂的配制方法改进
国标法中显色剂的浓度较大(20 g·L-1),难于溶解,致使溶液浑浊,过滤后仍不清澈,试剂空白值高。改进法将显色剂浓度降低为5.0 g·L-1,并根据其弱碱性,用0.05 mol·L-1H2SO4溶解,如图1所示,过滤后溶液清澈,试剂空白值大大降低,散射误差减小。

图1 改进前后的显色剂溶液照片
国标法要求显色剂溶液在冰箱中保存,不宜多配,当溶液变浑浊就应重新配制。而改进法配制的显色剂溶液室温放置1.5个月后,仍保持透明状态未变质。
2.3.2 显色剂用量和显色时间选择
为优化改进法的显色剂用量和显色时间,分别移取10 mg·L-1苯胺标准溶液2.0 mL于10支25 mL比色管中,按1.5(2)方法,依次加入不同体积的显色剂,改变显色时间,测定吸光度值,结果见图2。由图2数据可知,当显色时间为40 min时,显色剂加入量大于8.0 mL时,吸光度值基本不变。当显色时间为50 min和60 min时,显色剂加入量大于3.0 mL时,吸光度值基本不变。从提高实验效率的角度考虑,本实验选择显色剂加入量为8.0 mL,显色时间为40 min。
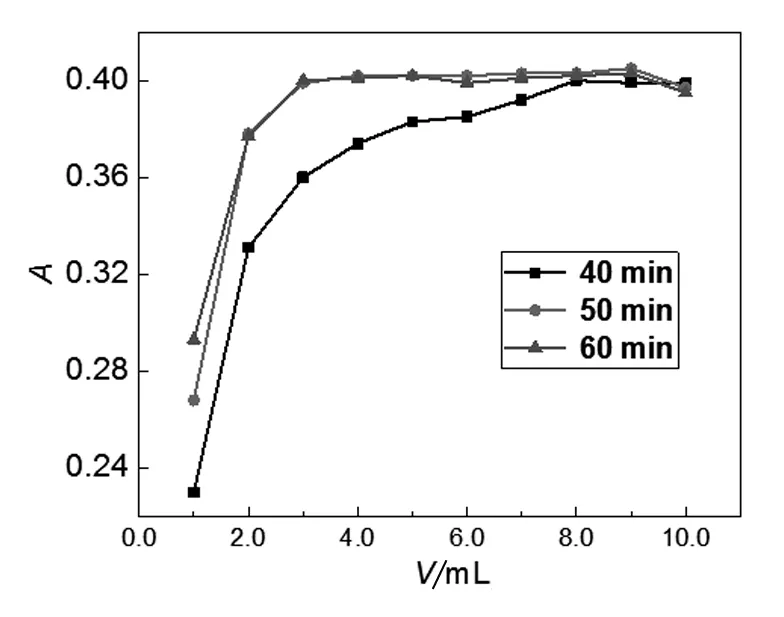
图2 显色时间和显色剂用量对吸光度的影响
2.4 改进法和国标法的标准曲线、检出限比较
按1.5(1)(2)操作方法,分别配制两种标准溶液系列,显色后如图3所示。由图3可见,改进法标准溶液系列明显比国标法标准溶液系列更清澈,因此散射引起的误差更小。

图3 改进前后的标准系列溶液照片
用国标法和改进法分别测定吸光度-苯胺浓度标准曲线,结果如图4。
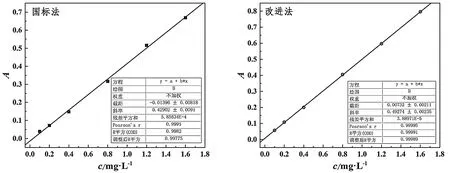
图4 国标法和改进法的标准曲线
由图4可知,国标法标准曲线的线性方程为A=0.42902c-0.01396,R2=0.9982,方法检出限为0.05 mg·L-1。改进法标准曲线的线性方程为A=0.49274c+0.00732,R2=0.99991,方法检出限为0.01 mg·L-1。
比较国标法和改进法的标准曲线,改进法的相关系数更高,方法检出限更低。
2.5 改进法的精密度
移取10 mg·L-1苯胺标准溶液1.0 mL,按1.5(2)节步骤用改进法配制标准溶液(苯胺浓度为0.40 mg·L-1)及吸光度测定,结果见表3。

表3 改进法的精密度测定
由表3数据可知,改进法的测定结果重复性好,精密度高。
2.6 水样分析
按1.5节操作方法,用国标法和改进法测定印染厂废水样品苯胺含量,同时用改进法做加标回收测定回收率。测定结果见表4。
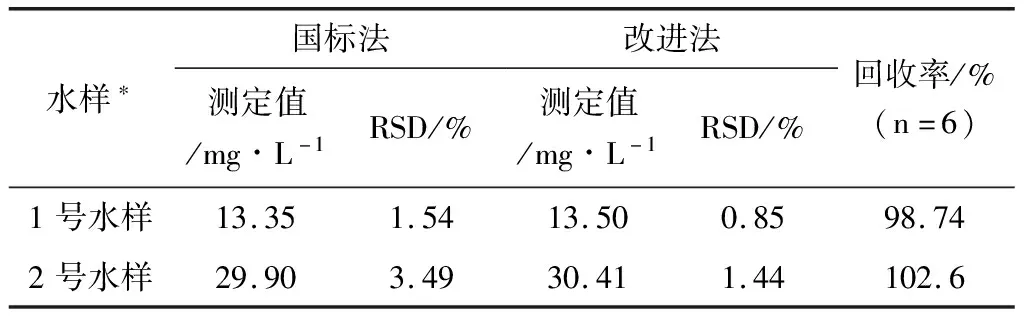
表4 国标法与改进法对废水中苯胺的测定
由表4可知,改进法测定两个废水样品的回收率为98.74%和102.6%,和国标法测定结果的相对误差分别为1.1%和1.7%。
3 结语
本实验以国标法为理论依据,改进的宗旨是在实验中最大程度地减免误差,规范、简化操作,使不同浓度的标准溶液和水样在进行重氮化及显色反应中条件一致,以提高实验的精密度和准确度。
实验表明,改进法的标样稀释方法误差大大降低;水样、重氮化反应及显色反应的酸度调节操作更简便、准确,节省了分析时间;显色剂溶解度明显增大,溶液清澈,试剂空白值低,散射误差小。通过精密度、回收率实验以及和国标法的对比可知,改进法结果重复性、精密度好,回收率高,测定结果和国标法一致。
