玉米籽粒突变体dek101的表型分析和精细定位
2020-11-27宋欣冉胡书婷崔则瑾李建生杨小红白光红
宋欣冉 胡书婷 张 凯 崔则瑾 李建生 杨小红 白光红*
玉米籽粒突变体的表型分析和精细定位
宋欣冉1,**胡书婷2,**张 凯2崔则瑾2李建生2杨小红2白光红1,*
1新疆农业大学, 新疆乌鲁木齐 830052;2中国农业大学 / 国家玉米改良中心 / 农业农村部玉米生物学重点实验室, 北京 100193
籽粒作为玉米储藏器官, 其发育程度和物质储存直接影响玉米的产量和品质。本研究在玉米双单倍体系选育过程中发现可稳定遗传的籽粒缺陷突变体, 命名为()。该突变体籽粒皱缩, 粒重显著降低, 胚致死, 胚乳发育缺陷, 不能成苗。在授粉后12 d,开始出现明显的发育异常, 授粉后21 d籽粒鲜重、干重、体积不再增加。扫描电镜观察发现, 与野生型相比,淀粉粒显著变小。遗传分析证实该突变性状受隐性单基因控制。利用441个F2单株和1648个F3单株, 将该基因定位在1号染色体的标记IDP2182和IDP4600之间, 物理区间约300 kb, 共有5个预测基因。这些结果为挖掘与玉米籽粒发育有关的功能基因, 解析籽粒发育机制奠定了基础。
玉米; 籽粒缺陷突变体; 精细定位
胚乳作为玉米籽粒储藏物质的重要器官, 占籽粒干物质的70%~90%[1]。在玉米生殖生长发育过程中, 胚乳作为主要的库器官积累淀粉、蛋白质等营养物质直至生理成熟。同时, 在玉米种子萌发过程中为胚的生长发育提供营养。所以, 深入挖掘玉米籽粒形成和发育的关键基因, 解析籽粒发育规律和遗传调控机制, 对提高玉米产量和改良玉米品质具有重要意义。
籽粒突变体是作物种子发育基因克隆的重要遗传材料。目前为止, 以籽粒突变体为材料已经克隆了大量控制玉米籽粒发育的基因, 如参与碳水化合物代谢相关基因、等, 这些基因的功能丧失降低了胚乳淀粉含量[2-6], 并在甜玉米、糯玉米等特用玉米品种选育中得到广泛的应用; 影响胚发育, 如、等基因突变通过扰乱线粒体RNA编辑、叶绿体中核糖体亚基组装、减数分裂中核内复制等过程导致胚败育[7-13]。除了影响胚发育和胚乳淀粉累积的基因突变体外, 影响玉米籽粒蛋白品质的基因, 如、、等突变改善了籽粒中赖氨酸等必需氨基酸比例, 使玉米蛋白品质大幅提高, 但同时也带来了许多不良性状, 如产量降低、籽粒变软、抗病性下降等, 难以达到育种推广的基本要求[14-17]。最近, 黄永财等[18]发现在籽粒发育早期特异性的高表达, 证明早期的胚乳细胞数目决定最终籽粒大小, 为玉米产量的遗传改良提供了候选基因。郑喜喜等[19]发现直接调控玉米胚盾片的发育, 并参与控制胚乳和胚间营养重分配的过程。综上, 对玉米籽粒发育有关突变体的遗传研究, 对选育高产优质玉米新品种具有重要的指导意义。
本研究以玉米DH系选育过程中发现的玉米籽粒突变体为研究材料, 通过对籽粒发育动态的观察、籽粒表型的测定和遗传分析与精细定位, 为玉米籽粒发育基因的克隆及籽粒发育机制的解析奠定一定的理论基础。
1 材料与方法
1.1 试验材料及田间试验
本研究所用的籽粒突变体来源于美国玉米带种质的双单倍体选系(double haploid, DH), 即以PH4CV/PHB1M//PH4CV为材料, 用诱导系CM500诱导产生的单倍体加倍材料。由于播种不能萌发, 故用杂合植株()与自交系B73杂交得到F1, 自交后, 获得F2和F3群体, 用于该突变基因的精细定位。种植方式为行长5 m, 每行21株, 行距0.5 m, 株距0.25 m, 按照当地的栽培方法管理。
1.2 突变体的籽粒表型观察
2015年在中国农业大学北京上庄试验站种植杂合植株(), 播种自交后, 分别取授粉后6、9、12、15、18、21、24、27、30、33和36 d的野生型和突变型籽粒各80粒, 观察授粉后不同发育时期表型变化。
1.2.1 籽粒发育动态观察 挑取授粉后不同天数具代表性的野生型和突变型籽粒各1粒,照相记录, 观察籽粒发育动态过程。
1.2.2 籽粒鲜重和干重 挑选具有代表性的纯合野生型和杂合果穗()各3个, 取每个果穗中部具有代表性的野生型和突变型籽粒各50粒, 使用分析天平称量, 记录籽粒鲜重后, 保存于−20℃冰箱, 待全部取样结束后, 将各个时期的籽粒取出并于65℃条件下烘72 h, 记录烘干后的干重。
1.2.3 籽粒体积测量 采用排酒精法进行测量, 取野生型和突变型籽粒各20粒, 倒入滴定管, 读取加入籽粒前后液面刻度变化的差值, 即为20粒籽粒体积。
1.2.4 胚乳扫描电镜观察 分别取15、21和27 DAP (days after pollination)具有代表性的正常和突变型籽粒各6粒, 纵切后保存在FAA固定液中并抽真空, 通过缓冲液冲洗、乙醇梯度脱水、喷金等过程, 利用日立S-3400N扫描电镜进行胚乳淀粉粒观察。
1.3 突变体的遗传分析
对杂合植株(+/)与B73杂交自交一代得到的4个结实较好的F2籽粒分离果穗进行表型鉴定, 计算每个果穗以及所有果穗中野生型籽粒和突变型籽粒的数目, 利用卡方测验进行3∶1分离比检验。
1.4 DNA提取和精细定位
种植F2定位群体, 采用CTAB法提取玉米叶片基因组DNA和44个突变籽粒的基因组DNA。从Maize GDB (https://www.maizegdb.org/)数据库, 下载均匀覆盖在玉米基因组10条染色体的271对InDel标记, 筛选103个在突变体和自交系B73间具有多态性的标记。根据/B73的F2分离群体中每个单株授粉后果穗的表型, 挑选野生型、杂合类型DNA个体以及15 DAP的杂合果穗上表现缺陷型籽粒胚乳DNA各44个, 每11个个体混为1个样品池。用筛选到的多态性引物扩增2个亲本和12个样品池, 使用琼脂糖凝胶电泳, 具有“”的带型记为1, 具有“B73”的带型记为2, 杂合的单株记为3。
利用组配的F2定位群体的441株个体及筛选得到的5个InDel标记, 将目的区段初步定位于标记IDP7291与IDP78之间。为验证该结果并进一步缩小定位区间, 对目的区间附近没有公共标记的区域, 利用NCBI数据库中的Primer-BLAST (https://www. ncbi.nlm.nih.gov/tools/primer-blast/)工具, 在有功能注释基因的5′-UTR、3′-UTR及跨内含子区域设计引物, 根据一代测序结果, 进一步开发InDel标记(表1)。再利用F2群体筛选到的重组类型播种所得1648株F3代个体, 以进一步缩小目的区间。

表1 在亲本间有多态性InDel引物
2 结果与分析
2.1 玉米籽粒突变体dek101的籽粒特征
观察突变体籽粒发现, 与野生型相比, 突变型籽粒严重干瘪, 粒重显著降低, 胚致死, 胚乳发育严重缺陷, 籽粒颜色灰白(图1-A, B)。对籽粒发育动态的观察发现, 在9 DAP时, 突变型籽粒与野生型籽粒相比发育状态基本一致; 12 DAP时, 野生型籽粒呈淡黄色, 突变型籽粒呈乳白色, 胚发育异常(图1-C), 表明该突变在籽粒发育早期阶段就能影响籽粒的发育。随着籽粒发育, 鲜重、干重和体积逐渐增大, 在21 DAP时达到最大, 之后突变体籽粒鲜重和体积逐渐减小, 干重不再增加, 表明突变籽粒无法进行正常的物质积累, 最终表现为胚败育的干瘪籽粒(图1-D~F)。
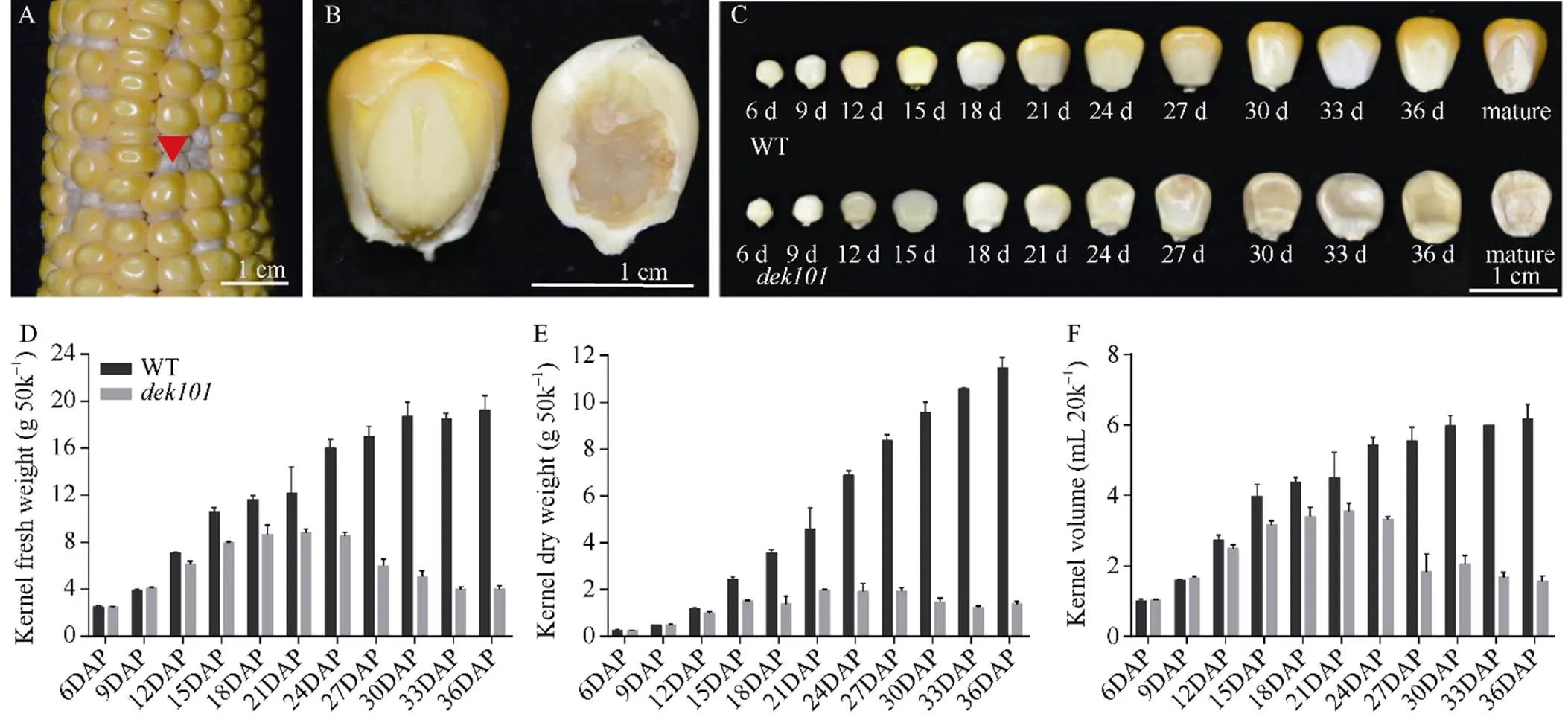
图1 籽粒发育动态及授粉后不同时期野生型籽粒和突变型籽粒对比
A: 杂合果穗; B: 30 DAP时突变型籽粒和野生型籽粒对比; C: 授粉后不同时期野生型与突变型籽粒发育动态; D~E: 50颗野生型和突变型籽粒不同时期干重、鲜重的变化; F: 20颗野生型和突变型籽粒不同时期体积的变化。WT: 野生型籽粒;: 突变体籽粒。A~C图标尺为1 cm。**, 突变型籽粒与野生型相比在统计学上有极显著差异(< 0.01)。DAP: 授粉后天数。
A: Ear performance of heterozygous plants; B: Comparison ofand wild-type kernels at 30 days after pollination; C: Developmental dynamics of wild-type and mutant kernels in different time series; D–E: Dynamics changes in dry weight, fresh weight of 50 wild-type andkernels at different stages. F: Dynamics changes in volume of 20 wild-type andkernels at different stages. WT: wild type;: mutant. Bar in A–C: 1 cm.**, indicates extremely significant difference of expression in specific tissues betweenand WT (< 0.01). DAP: days after pollination.
2.2 不同发育时期dek101胚乳细胞的扫描电镜观察
为了进一步观察突变型籽粒粒重降低原因, 我们使用扫描电镜分别观察15、21和27 DAP胚乳细胞中淀粉粒形态的变化。在相同时期, 野生型胚乳细胞中淀粉粒形态均匀, 排列有序; 突变体淀粉粒体积显著变小且排列疏松, 局部有明显空腔, 基质蛋白增多, 且有更多填充异常的小淀粉粒。随着授粉天数的增加, 野生型和突变体的淀粉粒不断增大, 发育过程中不断进行淀粉的积累, 且野生型淀粉粒物质填充更为饱满, 排列更为紧密, 证实了突变体在发育过程中籽粒重量的变化趋势(图2-A,B, D,E)。突变体籽粒的淀粉粒在发育过程中也有所增大, 但与野生型籽粒相比增长速率较为缓慢, 并在27 DAP籽粒胚乳细胞中发现较多小淀粉粒, 可能与突变基因参与调控胚乳细胞中淀粉粒的退化有关(图2-C, F)。
2.3 dek101由隐性单基因控制
对4个F2分离果穗中的野生型和突变型籽粒粒数进行统计, 并对两者的分离比进行卡方测验, 结果表明野生型籽粒与突变型籽粒的分离比例符合3∶1的孟德尔分离定律理论比例(表2), 表明该突变性状受隐性单基因控制。

图2 野生型与dek101籽粒淀粉粒扫描电镜观察
A~C: 授粉后15、21和27 d野生型籽粒扫描电镜观察; D~F: 授粉后15、21和27 d突变型籽粒扫描电镜观察。A~F图标尺: 5 µm。
A–C: SEM observation of wild-type kernel of 15, 21, and 27 DAP; D–F: SEM observation of mutant type kernel of 15, 21, and 27 DAP. Bar = 5 µm.
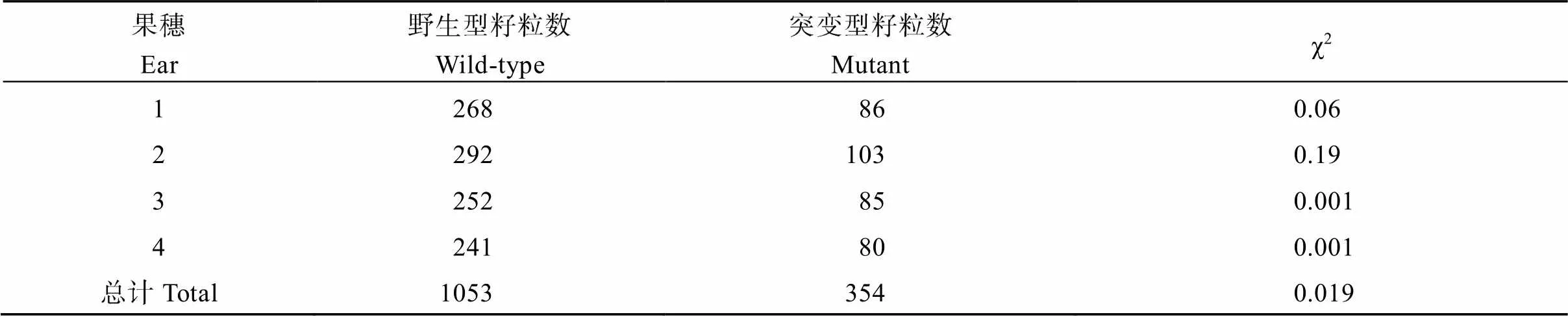
表2 F2果穗突变型籽粒的分离比例
χ20.05,1=3.84
2.4 dek101被精细定位到300 kb区间
为了克隆基因, 我们利用自交系B73和杂合植株()组配的F2群体进行初步定位。根据Maize GDB公共标记数据库, 选择均匀覆盖玉米10条染色体的271对InDel标记, 共筛选到103个在突变体和自交系B73间具有多态性的标记。采用集团分离分析法(bulked segregation analysis, BSA), 对F2群体中野生型、杂合型和突变型胚乳DNA的混池进行多态性筛选, 发现1号染色体上2个分子标记IDP7291和IDP78可能与目标性状连锁。
随后, 在IDP7291和IDP78之间加密3个InDel标记(IDP8216、IDP8266和IDP101), 利用F2群体的441个个体将初步定位在1号染色体短臂标记IDP101与IDP78之间, 物理区间为3.1 Mb。为进一步精细定位, 将检测到的重组单株于2019年夏季在内蒙播种, 获得1648个F3单株, 在IDP101与IDP78之间继续加密标记(IDP643、IDP2182和IDP4600) (表1), 筛选重组单株, 结合表型将精细定位在标记IDP2182和IDP4600之间, 物理距离约为300 kb (图3)。
: F2群体大小以及F3群体数目; 黑色竖线代表引物位置; 标记下方的红色数字代表重组单株数目; 矩形框代表5个重组类型的基因型以及对应的籽粒表型, 黑色矩形代表B73基因型, 灰色矩形代表杂合基因型。
: individuals of F2and recombinant-derivedF3population; the black vertical lines represent primary physical distance; the red numbers under InDel markers represent recombination events; the rectangular boxes represent the genotypes and phenotypes of five recombinants; the black and gray rectangles represent B73 and heterozygous genotypes, respectively.
利用Gramene网站检索, 在该区间内共有5个注释基因, 包括1个WD40家族蛋白、3个病程相关蛋白基因和1个钙蛋白酶型半胱氨酸蛋白酶(表3)。为了预测候选基因, 利用Chen等[20]发表的转录组数据研究目标区段5个基因的组织表达特性, 发现3个病程相关蛋白基因在籽粒发育早期表达量都较低, 在发育晚期表达较高; WD家族蛋白和钙蛋白酶型半胱氨酸蛋白酶基因在玉米各个组织都有表达, 且在籽粒发育早期具有较高的表达量(图4)。这些结果表明Zm00001d028813和Zm00001d028818很有可能是的候选基因。
3 讨论
籽粒作为玉米光合产物的重要贮藏器官, 由胚、胚乳和种皮3个部分构成, 其中胚乳在玉米籽粒发育过程中积累淀粉、蛋白质等营养物质; 胚作为新生植株的幼体, 其萌发所需的营养物质来自于胚乳。因此, 以籽粒突变体为遗传材料, 挖掘调控其发育的相关基因, 并揭示籽粒发育的分子机制, 对玉米产量和品质的遗传改良具有重要意义。
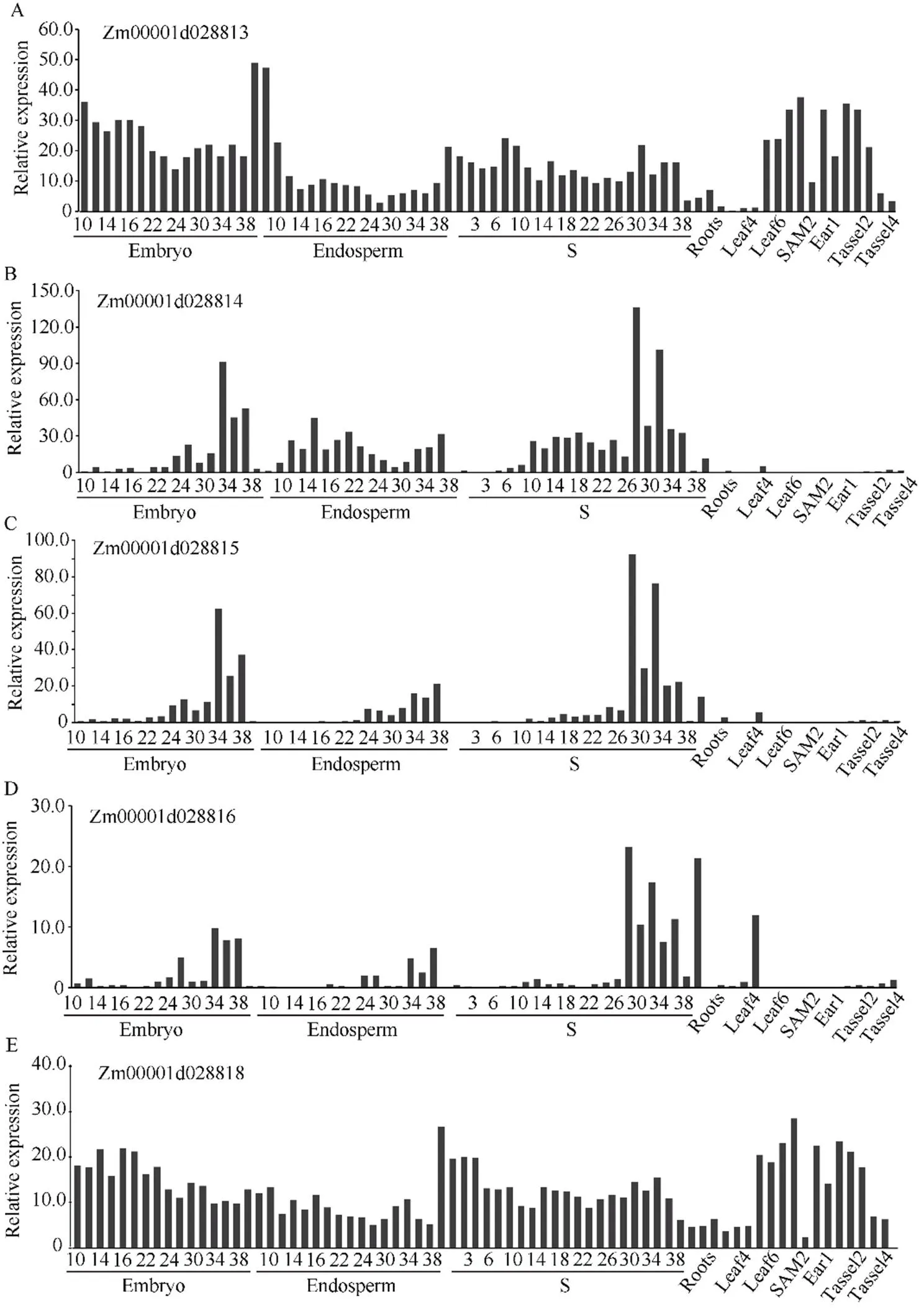
图4 区段内5个预测基因在玉米自交系B73中不同组织的表达量
SAM: shoot apical meristem.

表3 dek101定位区间的候选基因注释
籽粒缺陷突变体在12 DAP, 胚发育明显异常, 籽粒颜色发白; 完熟期的突变型籽粒, 胚败育, 胚乳发育异常, 籽粒严重皱缩。在目前已报道的籽粒突变体中, 如、、、、、[2-3,6,21-23]籽粒胚发育正常, 胚乳呈现不同程度的皱缩或变小;、、[12-13,24]等突变籽粒胚败育, 但几乎不影响胚乳发育;、、、、、、[25-31]有可以萌发的突变籽粒, 苗期致死;、、、、[9-11,32-33]种子完全不能萌发, 为胚致死突变。通过表型比较,突变籽粒则与、、、、等类似, 胚致死, 突变籽粒完全不能萌发。除这些表型之外, 本研究还系统地观察了突变体和野生型籽粒鲜重和干重的动态变化, 均表现出先升高后降低的趋势(图1-D~E), 这与籽粒不同发育时期的含水量以及干物质积累有关。
在已报道的籽粒突变体中,、、、、等[9-11,32-33]相关基因已被克隆。编码黏连蛋白亚基SCC4 (sister chromatid cohesion protein 4), 该基因突变后使细胞周期和核内复制受到扰乱, 导致种子完全不能萌发[9];基因编码TTI2 (Tel2-interaction protein 2)分子伴侣蛋白, 影响雄性生殖细胞的发育[10];编码三角状五肽重复蛋白, 该基因突变后导致线粒体复合体I亚基NAD4的第3个内含子剪切效率降低, 从而导致了烟酰胺腺嘌呤二核苷酸脱氢酶活性下降[33]; DEK44蛋白功能的丧失影响了线粒体和细胞核基因组中呼吸链相关蛋白编码基因的表达, 从而导致籽粒小、胚致死[11]。尽管这些籽粒发育相关基因已被克隆, 但是籽粒发育的调控机制有待于深入研究。本研究将基因定位在1号染色体47.1 Mb~47.4 Mb区间内, 包含已克隆基因(Zm00001d028818)。参与玉米籽粒糊粉层细胞的分化和发育, 具有21个跨膜区域, 1个胞外环多肽和1个半胱氨酸蛋白激酶结构域。该基因突变之后导致胚致死, 影响糊粉层的发育以及胚乳醇溶蛋白含量的积累[34], 表明的表型很有可能由的等位突变导致。
除之外,的定位区间还包含4个候选基因。其中, Zm00001d028813编码WD40家族蛋白, 在细胞质和细胞核中表达, 参与植物生长发育、环境胁迫响应、信号转导调控基因表达等[35]。Zm00001d028814、Zm00001d028815和Zm00001d028816均编码病程相关蛋白基因, 是植物受到病原物侵染或非生物因子刺激后产生的一类蛋白, 参与植物的诱导抗病性[36]。结合这些基因的功能注释和表达谱, Zm00001d028813和Zm00001d028818均有可能是的候选基因, 需要进一步确认。
4 结论
本研究以玉米DH系选育过程中发现的籽粒缺陷型突变体()为试验材料, 发现突变体胚致死、胚乳发育缺陷, 淀粉粒填充异常。该突变体由隐性单基因控制, 被精细定位到物理距离约为300 kb的区间, 包括5个功能注释的基因, 其中Zm00001d028813和Zm00001d028818可能为候选基因。
[1] Rossi V, Hartings H, Thompson R, Mario M. Genetic and molecular approaches for upgrading starch and protein fractions in maize kernels., 2001, 46: 147–158.
[2] Shannon J C, Pien F M, Cao H, Liu K C., an adenylate translocator, facilitates transfer of extraplastidial synthesized ADP-Glucose into amyloplasts of maize endosperms., 1998, 117: 1235–1252.
[3] Dickinson D B, Preiss J. Presence of ADP-Glucose pyrophosphorylase inandmutants of maize endosperm., 1969, 44: 1058–1062.
[4] Zhang X L, Colleoni C, Ratushna V, Colleoni M S, Martha J, Myers A. Molecular characterization demonstrates that thegenecodes for the starch synthase isoform SSIIa., 2004, 54: 865–879.
[5] Wang Y J, White P, Pollak L, Jane J L. Characterization of starch structure of 17 maize endosperm mutant genotypes with Oh43 inbred line background., 1993, 70: 171–179.
[6] Shure M, Wessler S, Fedoroff N. Molecular identification and isolation of thelocus in maize., 1983, 35: 225–233.
[7] Fu S N, Meeley R, Scanlon M J.encodes a negative regulator of the heat shock response and is required for maize embryogenesis., 2002, 14: 3119–3132.
[8] Jose F, Gutierrez M, Mauro D P.encodes a mitochondrion-targeted Pentatricopeptide repeat protein necessary for seed development and plant growth in maize., 2007, 19: 196–210.
[9] He Y H, Wang J G, Qi W W, Song R T. Maizeencodes the cohesin-loading complex subunit SCC4 and is essential for chromosome segregation and kernel development., 2019, 31: 465–485.
[10] Garcia N, Li Y B, Dooner H K, Messing J. Maize defective kernel mutant generated by insertion of a Ds element in a gene encoding a highly conserved TTI2 cochaperone., 2017, 114: 5165–5170.
[11] Qi W W, Lu L, Huang S C, Song R T. Maizeencodes mitochondrial ribosomal protein L9 and is required for seed development., 2019, 180: 2106–2119.
[12] Shen Y, Li C L, McCarty D R, Meeley R, Bao C T.encodes the plastid initiation factor 3 and is essential for embryogenesis in maize., 2013, 74: 792–804.
[13] Li C, Shen Y, Meeley R, McCarty D R, Bao C T.encodes a plastid-targeted cGTPase essential for embryogenesis in maize.,2015, 84: 785–799.
[14] Mertz ET, Bates L S, Nelson O E. Mutant gene that changes protein composition and increases lysine content of maize endosperm., 1964, 145: 279–280.
[15] Ueda T, Waverczak W, Ward K, Sher K, Ketuda M, Schmidt R J, Messing J. Mutations of the 22- and 27-kD zein promoters affect transactivation by the Opaque-2 protein., 1992, 4: 701–709.
[16] Coleman C E, Larkins B A. The Prolamins of Maize. Seed Proteins. Springer Netherlands, 1999. pp 109–139.
[17] Nelson O E, Mertz E T, Bates L S. Second mutant gene affecting the amino acid pattern of maize., 1966, 150: 1469–1470.
[18] Huang Y C, Wang H H, Huang X, Wang Q, Wang C J, An D, Li J Q, Wang W Q, Wu Y R. Maizeregulates mitosis and cytokinesis during early endosperm development., 2019, 31: 1238–1256.
[19] Zheng X X, Li Q, Li C S, An D, Xiao Q, Wang W Q, Wu Y R. Intra-kernel reallocation of proteins in maize depends on-mediated scutellum development and nutrient assimilation., 2019, 31: 2613–2635.
[20] Chen J, Zeng B, Zhang M, Xie S J, Wang G K, Hauck A, Lai J S. Dynamic transcriptome landscape of maize embryo and endosperm development., 2014, 166: 252–264.
[21] Chourey P S, Nelson O E. The enzymatic deficiency conditioned by the, mutations in maize., 1976, 14: 1041–1055.
[22] Hannah L C, Jr O E N. Characterization of ADP-glucose pyrophosphorylase from, and, mutants of maize., 1976, 14: 547–560.
[23] Gao M, Wanat J, Stinard P S, James M G, Myers A M. Characterization of, a maize gene coding for a novel starch synthase., 1998, 10: 399–412.
[24] Magnard J L, Heckel T, Massonneau A, Wisniewski J P, Cordelier S, Lassagne H, Perez P, Dumas C, Rogowsky P M. Morphogenesis of maize embryos requiresencoding a plastid ribosomal protein., 2004, 134: 649–663.
[25] Qi W, Tian Z, Lu L, Chen X, Chen X, Zhang W, Song R T. Editing of mitochondrial transcriptsandbyis essential for mitochondrial function and maize plant development., 2017, 205: 1489–1501.
[26] Chen X, Feng F, Qi W, Xu L, Yao D, Wang Q, Song R T.encodes a PPR protein that affects-splicing of mitochondrialintron 1 and seed development in maize., 2017, 10: 427–441.
[27] Wang G, Zhong M, Shuai B, Song J, Zhang J, Han L, Ling H, Tang Y, Wang G, Song R T. E+ subgroup PPR proteinis required for multiple mitochondrial transcripts editing and seed development in maize and., 2017, 214: 1563–1578.
[28] Dai D, Luan S, Chen X, Wang Q, Feng Y, Zhu C, Qi W, Song R T. Maizeencodes a P-type PPR protein that affects-splicing of mitochondrialintron 1 and seed development., 2018, 208: 1069–1082.
[29] Li X, Gu W, Sun S, Chen Z, Chen J, Song W, Zhao H, Lai J.encodes a PPR protein required for seed development in maize., 2018, 60: 45–64.
[30] Ren R C, Lu X, Zhao Y J, Wei Y M, Wang L L, Zhang L, Zhang W T, Zhang C, Zhang X S, Zhao X Y. Pentatricopeptide repeat protein DEK40 is required for mitochondrial function and kernel development in maize., 2019, 70: 6163–6179.
[31] Zuo Y, Feng F, Qi W W, Song R T.encodes an RNA-binding protein that affects alternative pre-mRNA splicing and maize kernel development., 2019, 61: 728–748.
[32] Stein E L, Darren G, Rudolf J, Jennifer A L, Evgueni A, Mark C, Niu X M, Meeley R, Nichols S, Olsen O A. The() gene required for aleurone cell development in the endosperm of maize grains encodes a membrane protein of the calpain gene superfamily., 2002, 99: 5460–5465.
[33] Zhu C, Jin G, Fang P, Zhang Y, Feng X, Tang Y, Qi W W, Song R T. Maize Pentatricopeptide repeat protein DEK41 affects cis-splicing of mitochondrialintron 3 and is required for normal seed development., 2019, 70: 3795–3808.
[34] Yi G, Lauter A M, Scott P, Becraft P W. The thickmutant defines a negative regulation of maize aleurone cell fate that functions downstream of., 2011, 156: 1826–1836.
[35] Xu C, Min J R. Structure and function of WD40 domain proteins., 2011, 2: 202–214.
[36] Xie Y R, Chen Z Y, Brown R L, Bhatnagar D. Expression and functional characterization of two pathogenesis-related protein 10 genes from., 2010, 167: 121–130.
Phenotypic analysis and fine mapping ofin maize
SONG Xin-Ran1,**, HU Shu-Ting2,**, ZHANG Kai2, CUI Ze-Jin2, LI Jian-Sheng2, YANG Xiao-Hong2, and BAI Guang-Hong1,*
1Xinjiang Agricultural University, Urumqi 830052, Xinjiang, China;2National Maize Improvement Center of China / Key Laboratory of Maize Biology of Ministry of Agriculture and Rural Affairs / China Agricultural University, Beijing 100193, China
As the storage organ of maize, kernel development and accumulation of storage production directly determines maize yield and quality. In this study, a stable defective kernel mutant, named as(), was identified during the development of double haploid (DH) lines in maize. Thekernels displayed severely shrunk kernel appearance, significantly reduced kernel weight, lethal embryo, defective endosperm and were incapable of germinating. Theshowed obvious developmental abnormalities at 12 days after pollination (DAP). The fresh weight, dry weight and volume of the kernels were no longer increased after 21 DAP. Scanning electron microscopy (SEM) observation revealed that the starch granules ofwere significantly smaller compared with wild-type kernels. Genetic analysis demonstrated that the mutant trait was controlled by a recessive single gene. Using 441 F2individuals and 1648 F3individuals,was narrowed down to a genomic region of about 300 kb between the InDel marker IDP2182 and IDP4600 on chromosome 1, which contains five predicted genes. These results laid the foundation for mining functional genes related to maize kernel development and deciphering the mechanism of grain development.
maize; defective-kernel mutant; fine mapping
本研究由国家自然科学基金项目(31421005)资助。
This study was supported by the National Natural Science Foundation of China (31421005).
白光红, E-mail: bgh601@126.com
**同等贡献(Contributed equally to this work)
宋欣冉, E-mail: songxinran916@163.com; 胡书婷, E-mail: hushutingcau@163.com
2020-03-17;
2020-07-02;
2020-08-18.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20200818.0903.002.html
10.3724/SP.J.1006.2020.03017
