作物对大气CO2浓度升高生理响应研究进展
2020-11-27李彦生刘晓冰
李彦生 金 剑 刘晓冰
综述
作物对大气CO2浓度升高生理响应研究进展
李彦生1,2,*金 剑2,*刘晓冰2
1中国农业科学院农业环境与可持续发展研究所 / 农业农村部农业环境重点实验室, 北京 100081;2中国科学院东北地理与农业生态研究所 / 中国科学院黑土区农业生态重点实验室, 黑龙江哈尔滨 150081
全球大气二氧化碳(CO2)浓度不断升高对农业生产带来巨大影响。二氧化碳是作物光合作用的底物, 其浓度的升高理论上有利于作物光合作用能力的提高, 从而促进作物生物量和产量的形成。但已有研究表明, 大气CO2浓度升高对作物产量的促进作用小于预期, 同时还存在使作物营养品质变劣的风险, 相关机制尚不清楚。为此, 本文从植物(作物)叶片对CO2的吸收和固定生理基础入手, 综述了不同类型作物关键光合生理指标如: 净光合速率、叶片胞间CO2浓度、Rubisco酶最大羧化速率及Rubp再生速率等对大气CO2浓度的响应差异。以作物整株水平碳-氮代谢平衡为基础, 总结了解释光合适应现象的2种主要假说,即“源-库”调节机制和N素抑制机制。综述了大气CO2浓度升高对不同作物籽粒蛋白质、脂肪、矿质元素和维生素等关键营养指标浓度的影响。分析了未来大气CO2浓度和温度升高的交互作用对作物生产所带来的潜在影响。展望了本领域未来需要关注的主要研究方向。该综述可以为准确评估未来气候条件下作物产量和品质变化, 最大发挥大气CO2浓度升高所带来的“肥料效应”, 减缓气候变化对作物生产带来的不利影响提供理论参考。
气候变化; 全球变暖; 水稻; 小麦; 大豆; 玉米
自18世纪60年代工业革命开始, 人类活动特别是煤炭、天然气和石油等化石燃料的大量开发与利用使大气中CO2浓度迅速增加。研究表明, 工业革命前大气中的CO2浓度约为280 µmol mol–1, 在随后的200年(1760—1960年)大约增加了50 µmol mol–1[1], 然而在刚过去的60年间(1960—2020年)却急剧增加了100 µmol mol–1, 达到目前的415 µmol mol–1左右(图1)。根据美国国家海洋和大气管理局全球温室气体监测系统的数据, 我们可以发现大气中CO2浓度的升高仍然在加速(图1), 所以联合国政府间气候变化专门委员会(IPCC)认为全球大气CO2浓度在2050年升高到550 µmol mol–1, 2100年达到700 µmol mol–1将是大概率事件[1]。在未来很长一段时间里人类的生产活动都将在高大气CO2浓度下完成。二氧化碳作为植物光合作用的底物, 其浓度的升高理论上有利于植物光合作用能力的提高, 从而促进植物(作物)生物量和产量的形成。然而, 在全球气候变化的大背景下, 高温、干旱和臭氧浓度升高等其他因子严重制约作物生产。所以解析植物(作物)生长对大气CO2浓度升高响应的生理生化机制, 最大程度利用大气CO2浓度升高所带来的“肥料效应”将有利于消减气候变化对作物生产带来不利影响, 也是保障不断增加的全球人口粮食安全的关键。
大气CO2浓度升高促进全球植物生产能力的推断主要基于目前陆地覆盖面积占比80%以上的C3植物的光合作用未达到其饱和CO2浓度, 仍然存在较大的提升空间[2]。此外, 虽然C4植物光合作用受到环境CO2浓度变化的影响不明显, 大气CO2浓度仍然会通过提高水分利用效率促进其在干旱等环境胁迫条件下生产能力的提高。已有的研究证明了大气CO2浓度升高对植物生产能力的促进, 例如Jablonski等[3]利用Meta分析方法系统总结了79种植物生殖生长指标对大气CO2浓度升高的响应, 结果表明大气CO2浓度升高到500~800 µmol mol–1, 植物(作物)的开花数量平均增加了19%, 籽实数量平均增加了16%~18%, 或者单个籽实重量平均增加4%。同时他也发现大气CO2浓度升高对栽培品种产量的促进作用比野生类型更大(21% vs. 4%)。
然而, 通过田间开放式大气CO2浓度升高处理(free air CO2enrichment, FACE)研究发现, 植物(作物)长期生长在高CO2浓度下存在光合适应现象(photosynthesis acclimation), 即植物在高CO2浓度下生长的初始期出现的光合作用增强会逐渐减弱, 甚至消失[4-5]。目前关于植物光合适应现象的产生具体机制还不清楚。不同种类植物(作物),甚至同种作物不同品种的光合作用对大气CO2浓度升高的响应都存在显著差异。为此, 本文将从作物光合生理角度入手, 系统总结国内外关于大气CO2浓度升高对作物生长影响的研究进展, 分析相关的生理机制, 为准确评估大气CO2浓度升高对作物产量和品质形成的影响提供参考。
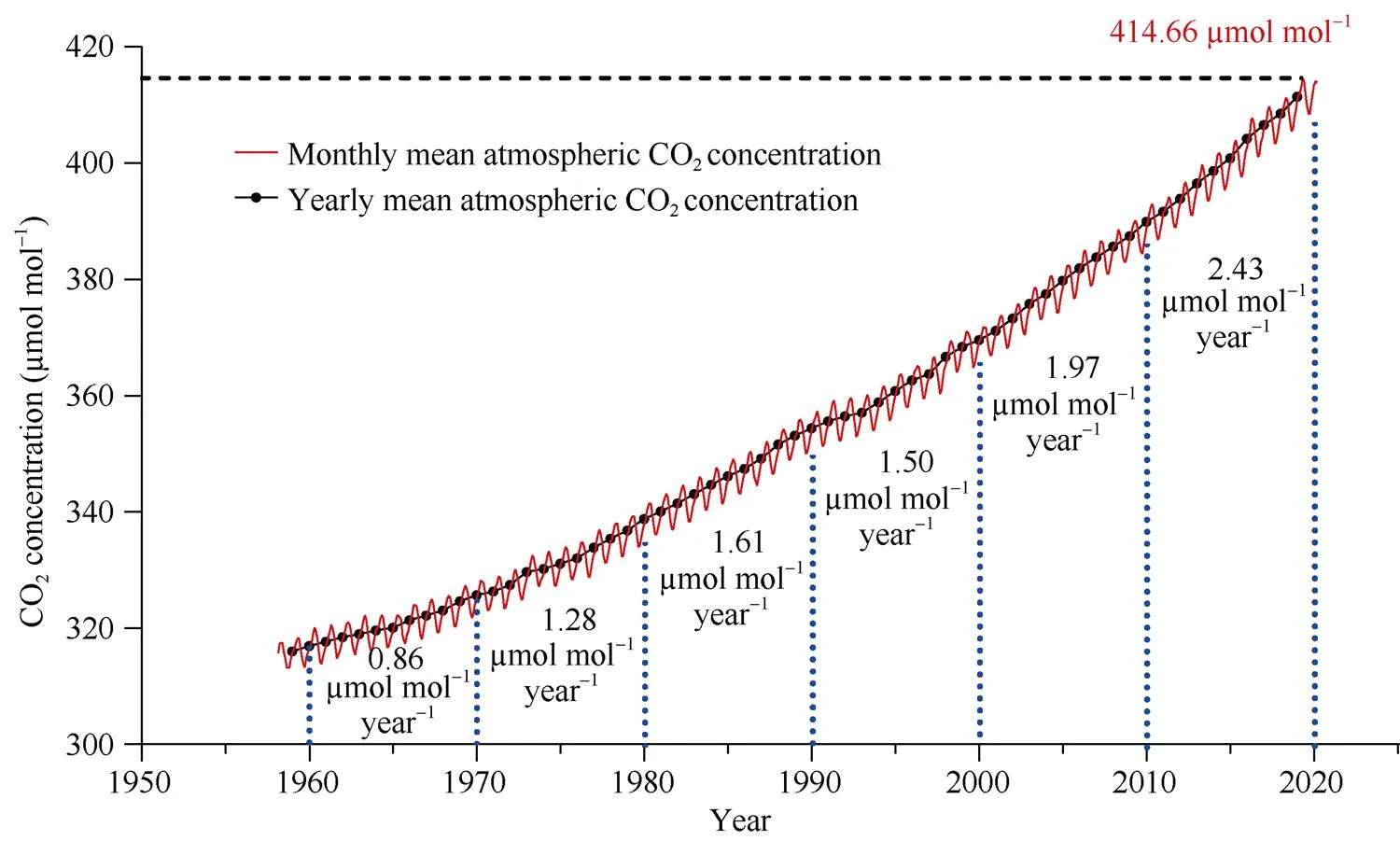
图1 1958–2020年大气CO2浓度年平均和月平均变化
图中蓝色虚线内数字代表每10年间大气CO2浓度年平均值的年增加量; 黑色虚线代表目前大气CO2浓度最高值为2019年5月测量值。
The data between the two blue dashed lines represent the increases of CO2concentration per 10 years. The black dashed line represents the highest atmospheric CO2concentration measured in May 2019. All the data in this figure are from https://www.esrl.noaa.gov/gmd/ccgg/ trends/data.html.
1 大气CO2浓度升高促进C3植物光合作用的生理基础
1.1 光合作用的关键酶——Rubisco
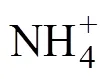
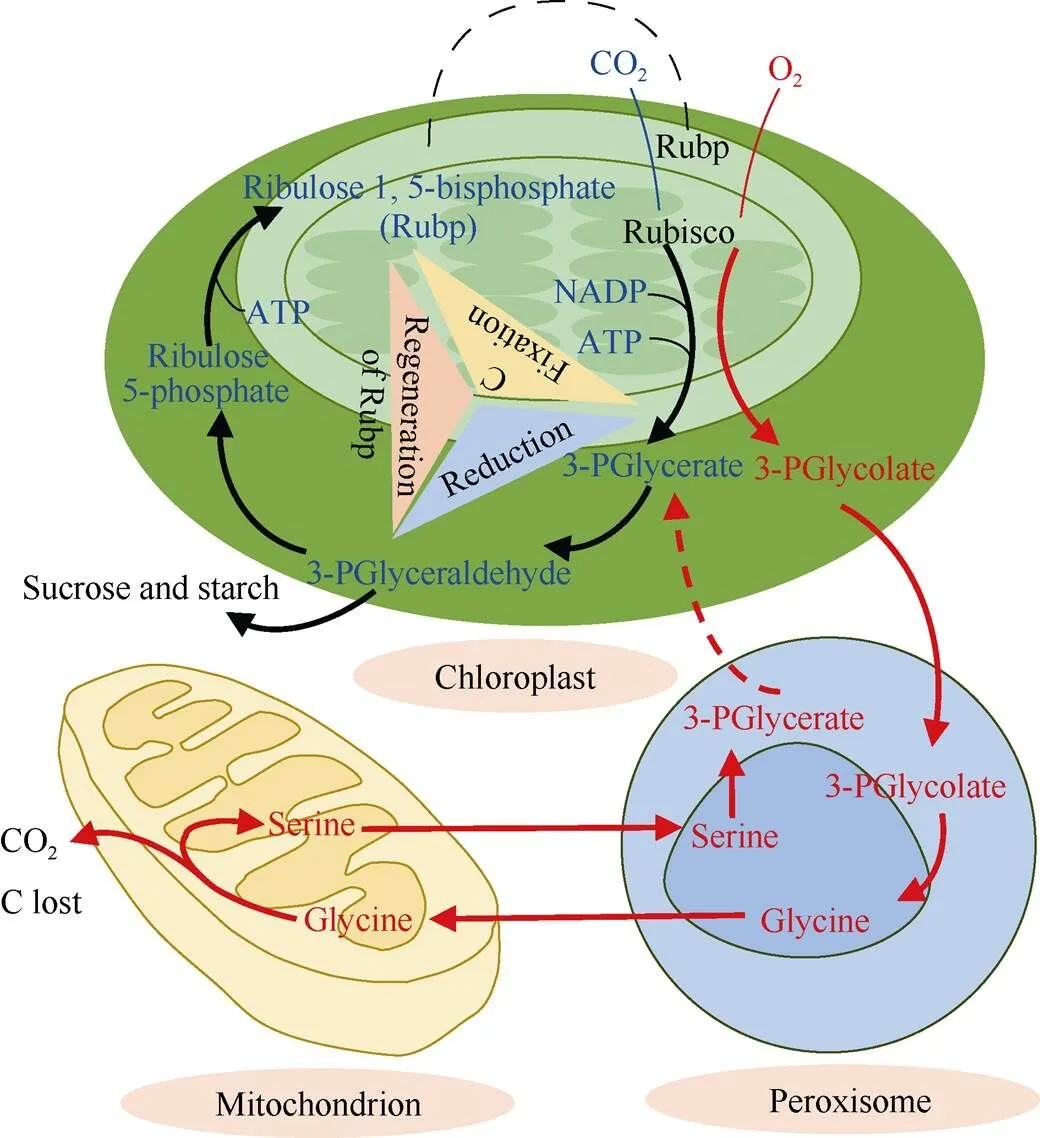
图2 C3植物卡尔文循环(黑色线条循环)和光呼吸(红色线条循环)
示意图参考https://www.knowablemagazine.org/article/sustainability/ 2017/photosynthesis-fix。
This schematic diagram is modified according to https://www.knowablemagazine.org/article/sustainability/2017/photosynthesis-fix.
1.2 叶片气孔对大气CO2浓度升高的响应
植物叶片与大气之间的气体交换和蒸腾作用都是通过气孔完成的, 气孔是由一对保卫细胞(guard cells)围成的空腔结构。气孔对CO2浓度敏感是保卫细胞的固有属性, 测量气孔导度(s)评估大气CO2浓度升高对气孔的影响是公认的有效方法。气孔导度可以用Ball等[15]的模型进行预测:
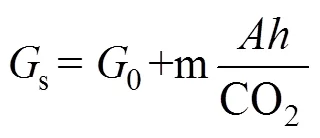
在该模型中,代表植物光合C同化能力;代表相对湿度; CO2代表叶片表面大气CO2浓度;0代表y轴截距; m代表直线的斜率, 其中0和m具有专一性, 在不同的物种中不同。该公式表明植物叶片气孔导度与大气CO2浓度成反比关系, 但也有研究认为气孔导度与胞间CO2浓度的关系更大[16]。不管叶片表面CO2浓度还是胞间CO2浓度变化对气孔导度影响的重要性大小如何, 目前绝大多数试验表明大气CO2浓度升高植物叶片s下降, 但是不同试验方式, 不同物种叶片s下降幅度差别也很大[17-18]。在美国伊利诺大学FACE试验平台, 正常大气CO2浓度条件下三叶草()叶片s在不同季节无显著差异(> 0.05); 当大气CO2浓度升高到600 µmol mol–1时, 整个生长季叶片s平均降低25%, 同时秋季叶片s显著(< 0.05)低于春季[19]。Sanz-Saez等[20]报道在FACE条件下大气CO2浓度升高后大豆品种HS93-4118和Loda叶片s连续3年均表现出显著下降的趋势。通过连续2年的FACE试验表明, 在生殖生长期虽然大气CO2浓度升高到600 µmol mol–1条件下大豆s下降, 但光合速率可以维持相对较高水平, 一定程度上缓解了高温(+4oC)条件下s降低所造成的光合C同化能力降低, 从而保证大豆的产量形成[21]。
C4植物可以利用其特殊的维管束鞘花环结构富集CO2, 通常胞间CO2浓度可以达到大气CO2浓度的3~8倍[22]。所以有研究者认为大气CO2浓度升高对玉米光合速率的影响很小或者可以忽略不计, 但是有研究报道大气CO2浓度升高后叶片s下降有利于提升C4植物的水分利用效率, 从而促进C4植物光合速率和生物量的增加[23-24]。Cunniff等[25]利用4种C3作物和4种C4作物在生长箱中进行对比研究, 结果表明C4作物的产量在高大气CO2浓度下有所增加,但是增幅(10%~15%)小于C3作物; 同时该研究还发现只有一种C4作物的光合速率显著增加。目前, 更多研究倾向于大气CO2浓度升高对C4植物碳水化合物积累能力的影响是水分利用效率提高所带来的间接效果[17,26-27]。Maroco等[28]在生长箱条件下将大气CO2浓度从350 µmol mol–1升高到1000 µmol mol–1时发现玉米叶片的气孔导度下降71%, 水分利用效率提高225%, 最终地上部生物量显著增加20%。长期FACE试验结果表明大气CO2浓度升高到550 µmol mol–1, 玉米和高粱的叶片气孔导度下降20%以上, 整株水分利用效率显著提高, 同时5~25 cm耕层土壤含水量增加31%, 25~55 cm耕层土壤含水量增加11%, 而产量却无明显变化[29]。
大气CO2浓度升高引起植物叶片s下降从而提高水分利用效率并不是C4植物的专一响应, C3植物中同样有这种现象。所以, 大气CO2浓度升高可能会提高作物抵抗轻、中度干旱胁迫对产量形成带来的不利影响, 大气CO2浓度升高后C4作物的增产潜能同样很大, 特别是在半干旱地区。
2 光合适应现象
植物长期生长在高大气CO2浓度下出现的光合适应现象内在机制虽然还不是很清楚, 目前有两种假说对这方面进行解释。第一, “源-库”调节假说: “源端”光合产物合成速率变大, 不能即时运往“库端”造成的负反馈, 以及“库强”不足造成的负反馈(图3)。第二, N素抑制假说: N素缺乏抑制光合C固定对大气CO2浓度升高的持续响应。
2.1 “源-库”调节理论
有研究人员认为光合适应现象可以用“源-库”调节理论解释[30-31]。“源-库”关系变化对植物叶片光合速率的调节较为复杂, 涉及植物内部生理生化反应以及整株形态水平上的变化, 但我们仍然可以通过不同指标进行评估。植物叶片碳水化合物合成能力增加后会改变植物的地上部/地下部的比值, 引起整株水平上的C平衡变化[32]。生长箱模拟条件下大气CO2浓度升高后小麦的叶片和茎秆会积累更多的碳水化合物而不是将增加的碳水化合物运输到“库端”籽粒中[33]。碳水化合物特别是非结构性碳水化合物(蔗糖、果糖及淀粉等)在叶片中的积累会抑制光合相关基因的表达, 导致光合C固定能力下降[34]。Zhu等[30]利用FACE研究发现, 当大气CO2浓度增加200 µmol mol–1后水稻和小麦叶片中淀粉和可溶性糖含量显著增加, 但与光合作用降低之间的相关关系不显著。此时光合作用的下调很可能是由非结构性碳水化合物积累引起己糖激酶表达上调, 最终加速了叶片衰老速度引起的[30,35-36]。水稻叶片碳水化合物合成能力在高大气CO2浓度下迅速增加, 但是在午后碳水化合的转运能力成为关键的限制因素, 最终表现出光合速率下调[37]。树木中也有类似研究报道, 例如杨树在高大气CO2浓度下光合C固定能力提高55%[38]。这主要得益于杨树较强的光合C输出能力, 白杨可以将90%以上白天合成的光合C转运出“源端”, 同时把剩余的光合产物以淀粉的形式储存起来,这样就可以避免光合适应的发生, 最大限度保证大气CO2浓度升高对光合C固定能力的促进作用[39]。此外, “源-库”平衡改变后叶片磷酸丙糖浓度变化与叶片最大光合速率密切相关, 当蔗糖在叶片迅速积累后, 磷酸丙糖和c,max均表现出降低[40]。
除了碳水化合物在“源端”大量积累导致的光合作用的下调, “库强”大小也是限制植物光合作用对大气CO2浓度升高的重要因素。相同作物, 当大气CO2浓度升高后, “源端”-叶片的光合产物供应能力大幅度提高, 理论上“库强”较大的品种光合C固定能力增幅更大[41]。Ainsworth等[42]利用不同大豆品种为试验材料, 分析了FACE条件下大气CO2浓度升高后库强在“源-库”调节中所发挥的作用, 结果表明“库强”较小(分支少, 结荚少)的大豆品种光合适应现象明显, 叶片c,max和max均表现出下降。在长期FACE试验条件下, 通过改变环境因子限制“库强”的方式同样被证明会使植物产生光合适应现象[14,17]。豆科作物对大气CO2浓度升高响应高于非豆科作物, 不仅因为共生固氮作用可以使其一定程度上避免N胁迫, 还因为共生固氮系统进行固氮作用时消耗较多的碳水化合物, 是除去茎、根和籽粒以外的重要碳库。研究表明豆科植物共生生物固氮系统进行固氮时地上部分的光合碳以蔗糖形式运输到根部, 来满足氮固定过程中所需要的能量[4,43]。光合产物蔗糖对根瘤固氮的影响最早是在基因突变豆科植物中发现, 由于此基因突变导致蔗糖合成能力下降, 豆科植物体内来自根瘤共生生物固氮的氮素比例显著降低[44]。有研究者对大豆进行暗处理, 发现6 h后根瘤固氮酶活性显著降低60%, 但如果在暗处理同时淋浇蔗糖溶液, 根瘤固氮酶活性则会明显提高[45]。根瘤不具备蔗糖合成能力却广泛存在蔗糖转化酶(sucrose invertase, INV)和蔗糖合成酶(sucrose synthetase, SUS), 这两种酶在植物体内主要功能是蔗糖不同部位转运过程中的卸载和分解, 这从另一角度证明了根瘤是重要的碳库。
2.2 氮素抑制假说
有理论认为这种光合适应现象是由于叶片Rubisco酶蛋白含量下降引起, 而不是Rubisco酶的催化能力发生了改变[46-47]。研究表明Rubisco酶每秒大约只能羧化3.3个Rubp, 其效率之低在酶促反应中极为罕见。植物为了弥补Rubisco酶催化效率低下的问题不得不合成大量的Rubisco酶蛋白来完成对CO2的固定。据统计植物叶片中氮有50%用来合成Rubisco酶, 所以Rubisco酶也成为世界上存量最多的单一蛋白[48-49]。当大气CO2浓度升高之后, Rubisco的催化效率显著提高, 植物减少了Rubisco酶蛋白的合成量, 最终抑制了光合作用对大气CO2浓度升高的持续响应[50]。利用Meta分析c, max对大气CO2浓度升高的响应表明, 在大田条件下植物叶片c,max平均下降10%[14]。在不同的研究中均发现作物叶片Rubisco酶含量在高大气CO2浓度下表现出下降的现象, 并最终大幅提高叶片氮的利用效率[50]。例如, 在开顶式气室模拟条件下, 当大气CO2浓度从330 µmol mol–1升高到660 µmol mol–1后水稻叶片Rubisco酶蛋白含量降低22%左右, 大豆叶片Rubisco酶蛋白含量则降低8%~17%[51]。利用FACE研究表明黑麦草()叶片Rubisco酶蛋白含量在高大气CO2浓度下降低25%, 同时c,max降低30%, 这也间接证明了Rubisco酶催化效率的升高[52]。
大气CO2浓度升高导致叶片氮利用效率的升高最终使得植物叶片氮浓度表现出显著降低的趋势[6]。很多研究认为大气CO2浓度升高后C3作物植株体内氮素浓度下降是抑制产量持续增加的主要原因[53-55]。那么如果提高供氮水平是否会缓解叶片氮浓度降低呢?有研究发现, 在开顶式气室模拟条件下高CO2浓度下增施硝态氮, 黄瓜的产量可以显著增加同时还能维持叶片中氮的浓度不降低[56]。然而, 更多研究证明增施氮肥不能有效抑制CO2升高条件下植物叶片氮浓度的降低, 例如高CO2浓度条件下大麦、小麦和水稻籽粒中氮含量会降低14%左右[57]。不过值得注意的是豆科植物植株氮浓度在高大气CO2浓度下降低程度小于非豆科植物[58]。例如, 草地生态系统中的豆科植物在高CO2条件下并没有发现叶片氮含量和C︰N有明显的变化, 而非豆科植物叶片氮浓度则明显降低[4]。在农田生态系统中, 高大气CO2浓度下大豆生长早期叶片浓度下降, 但在共生生物固氮发挥作用之后这种叶片氮含量下降的现象也随即消失[59]。利用开顶式气室对比24个大豆品种叶片氮浓度对大气CO2浓度升高的响应发现, 当大气CO2浓度从390 µmol mol–1升高到550 µmol mol–1后大豆叶片氮浓度平均降低3.2%, 表明即使是具有固氮能力的豆科植物依然受到叶片氮浓度下降的制约[60]。
此外, 大气CO2浓度升高条件下, 植物蒸腾速率下降引起氮素吸收能力降低的理论也受到研究人员广泛关注, 这种理论认为, 高CO2浓度条件下, 植物不再需要较大的蒸腾作用换取气孔的打开进而增加对CO2的吸收和固定[61]。植物气孔导度的下降会使蒸腾速率降低, 进一步导致质流的下降, 限制植物对可移动的氮(硝态氮)的被动吸收[62]。虽然植物对大气CO2浓度升高的响应依赖于环境和物种, 但是气孔导度和蒸腾作用的下降在很多研究中都有报道[63-65]。这个理论的支撑点是可移动元素从土壤运转到植物的地上依赖于质流, 通过蒸腾作用来实现。许多的研究者讨论了蒸腾作用对高CO2下植物营养元素吸收的潜在作用大小[55,66-67]。然而, 也有研究者认为质流作用对氮素吸收的影响并不重要, 因为植物体内的蒸腾作用变化与质流作用主导的元素吸收变化并不匹配, 其次, 质流作用只是植物对氮的被动吸收, 作用远没有植物根系的主动吸收重要[68-70]。
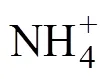
所以, 如何协调高CO2浓度作物对氮素的吸收利用, 最大程度发挥“CO2肥料效应”将是未来很长一段时间的研究重点。

图3 大气CO2浓度升高条件下C3作物(大豆)光合适应现象相关假说
3 大气CO2浓度升高对作物品质的影响
植物对大气CO2浓度升高的响应不仅包括生物量或产量的变化, 还包括籽实品质的变化, 特别是与人类健康息息相关的籽实营养品质变化。满足全球70亿人口40%碳水化合物需求的水稻和小麦均是C3作物, 受益于大气CO2浓度的升高, 这两种作物籽粒中的糖及其他碳水化合物含量增幅潜力很大,特别是蔗糖、果糖、葡萄糖、麦芽糖等这些易于人类消化吸收的非结构性碳水化合物浓度预计增加10%~45%[74-75]。此外, 与碳贮存和能量代谢密切相关的脂肪浓度在大气CO2浓度升高后也会出现升的趋势[76], 这种现象在脂肪含量较高的作物中表现明显。利用开顶式气室研究表明, 当大气CO2浓度升高到550 µmol mol–1后, 4个大豆品种成熟籽粒脂肪浓度增加8.3%~13.0%[77]。同时脂肪酸组分发生变化, 其中油酸(18:1)浓度显著增加, 亚油酸(18:2)浓度显著降低, 这种变化趋势可以增加大豆油的保存时间,降低亚油酸对人类心血管带来的负面影响[77-80]。Högy等[81]利用FACE研究发现油菜籽中的脂肪浓度在大气CO2浓度升高条件下未发生改变, 但脂肪酸组分发生了改变, 显著变化体现在油酸(18:1)浓度的增加1.3%, 而亚麻酸(18:3)、二十碳烯酸(20:1)和神经酸(24:1)分别降低4.1%、2.2%和5.3%。
越来越多的研究表明大气CO2浓度升高后作物籽实中除碳水化合物以外的营养物质的浓度有下降的风险。例如, 大气CO2浓度升高到550 µmol mol–1后,C3作物小麦和水稻籽粒蛋白质浓度下降幅度趋同, 均在7.8%左右; C4作物玉米下降5%左右, 高粱则基本保持不变[82]。豆科作物由于具有共生生物固氮能力, 所以被认为可以避免籽粒蛋白质浓度的下降[83]。利用开顶式气室, 以24个大豆品种为材料分析大气CO2浓度升高到550 µmol mol–1后大豆籽粒中氮浓度变化, 结果表明大豆籽粒中氮浓度依然有下降的趋势, 平均降低6.2%左右, 如果按照氮浓度和粗蛋白浓度之间的换算方法, 意味着大豆籽粒中粗蛋白浓度下降6.2%左右, 小于非豆科C3作物[84]。大气CO2浓度升高导致作物籽实蛋白质浓度的降低给许多贫困国家和地区人群带来健康隐患, 特别像印度等国家日常蛋白质摄入主要来自于C3谷物, 未来面临的营养风险变得更加严峻[85]。游离氨基酸在作物籽粒灌浆过程中具有合成蛋白质的功能, 当蛋白质浓度降低时我们可以推断游离氨基酸的浓度也会下降。半自然条件下的研究发现大气CO2浓度升高到550 µmol mol–1大豆籽粒在灌浆盛期和成熟期游离氨基酸浓度均呈降低趋势[77]。在籽粒灌浆盛期谷氨酰胺和精氨酸浓度的降低表明大气CO2浓度升高后作物合成代谢速度变快, 功能性蛋白需求量变大, 游离氨基酸更多被用来合成与代谢相关的功能性蛋白而不是贮存蛋白[77,86-87]。
大气CO2浓度升高对作物籽实矿质元素浓度的影响也是关注的焦点问题。模型研究表明大气CO2浓度升高有利于增加植物根系生物量, 通过扩大根系所能控制土壤的体积实现对矿质元素的被动吸收能力增强[67]; 而FACE研究表明大气CO2浓度升高有利于增加松树()细根(直径 < 0.05 mm)的比例从而提高对矿质元素的主动吸收能力[88]。这两种变化都有利于植物对矿质元素的吸收。所以理论上大气CO2浓度升高后, 作物籽粒的矿质元素含量至少不会降低。目前最受到人们关注的是作物锌(Zn)和铁(Fe)元素浓度的变化。研究表明世界上至少有20亿人, 特别是未成年人面临Zn和Fe元素缺乏带来的健康风险, 包括阻碍发育、免疫力下降、增加儿童死亡率以及引起贫血造成孕妇死亡等[74,89-90]。Myers等[82]统计了世界不同地区关于作物籽粒Zn和Fe元素浓度对大气CO2浓度升高的响应, 其中包括64个小麦品种、31个水稻品种、25个大豆品种、4个玉米品种和4个高粱品种, 结果表明大气CO2浓度升高后Zn元素浓度在小麦、水稻、大豆、玉米和高粱籽粒中的变幅分别为-9.3%、-3.2%、-5.1%、-5.1%和-1.3%; Fe元素浓度在小麦、水稻、大豆、玉米和高粱籽粒中的变幅分别为-5.0%、-5.3%、-4.2%、-5.7%和+1.6%。所以, 当大气CO2浓度升高条件下, C3和C4作物籽粒中Zn和Fe元素浓度均有下降的趋势。Zhu等[91]利用FACE试验方法分析了亚洲18个主要水稻品种籽粒营养品质对大气CO2浓度升高(≈580 µmol mol–1)的响应。结果同样发现水稻籽粒中蛋白质含量、Zn和Fe元素浓度降低, 同时还发现水稻籽粒中维生素B1、B2、B5和B9浓度显著降低。随着大气CO2浓度不断升高, 收入较低且将水稻作为主要食物的国家面临严峻的国民健康问题, 受到影响的人口可能在6亿以上[91]。目前关于大气CO2浓度升高导致作物营养品质下降的机制还不是很清楚。有研究者用“稀释效应”解释这种作物营养品质下降的现象。在大气CO2浓度升高条件下作物对碳水化合物的积累速度大于其他化合物合成以及矿质元素的吸收速度, 最终使得其他化合物及矿质元素的浓度表现为下降的现象。但这种假说不能解释为什么部分元素(Zn和Fe等)浓度下降, 部分元素(Mg、S、Ca和P等)浓度升高, 稀释作用不应该具有选择性[77,84]。另外一种假说认为大气CO2浓度升高降低了气孔导度, 减小了蒸腾作用, 同时也会降低土壤质流作用(见2.1), 这会抑制植物对可移动元素的吸收[65,92]。但是这种假说仍然面临挑战, 很多研究报道大气CO2浓度升高条件下,可移动性元素氮浓度降低, 但仍然有可移动性元素如: 磷元素和钾元素浓度未发生变化甚至呈增加趋势[77,84,93]。此外, Pérez-López等[94]认为大气CO2浓度升高条件下, C3作物生长旺盛, 所以那些作为辅酶因子参与合成代谢反应的元素(如Ca、Mg和Mn)需求量增多, 而参与氧化还原反应的元素(Fe、Zn和Cu)的需求量相对少, 正是这种差异造成了不同元素浓度的变化不同。以上3种假说都不能完全解释大气CO2浓度升高对作物籽实品质的影响, 相关机制研究工作仍需进一步开展, 这不仅可以完善植物生理学, 还可以为高品质作物育种工作提供理论参考。
4 大气CO2浓度和温度升高的交互作用
全球人口不断增加使得粮食安全问题变得尤为突出。大气温度升高等不利于作物生产的环境因子变化给全球作物生产带来前所未有的挑战。根据IPCC (2013)预测, 到21世纪末全球地表平均气温将会增加1.8~4.0oC。大气温度升高所带来的负面作用会抵消大气CO2浓度升高对产量的促进。考虑到大气CO2浓度和温度升高的交互作用对作物生产的影响, 未来的粮食安全挑战将会更严峻。首先, 温度增加1.5oC以上时, 大气CO2浓度升高的“肥料效应”将会变得不确定[95]。模型研究表明, 在未来大气温度升高条件下(2050—2100年),东北亚和非洲的水稻产量均会有较大幅度的下降(15%~45%), 大气CO2浓度升高会部分抵消温升对产量的负面效应, 但程度受到作物品种和生产地区纬度的影响[96-97]。例如, 利用FACE研究表明, 大气CO2浓度升高到500 µmol mol–1,中国江苏地区水稻产量显著提高8%左右, 如果同时进行大气温度升高2oC处理, 大气CO2浓度升高所带来的肥料效应则完全消失[98]。但也有模型研究认为全球温度增高对水稻产量形成的不利影响只发生在中低纬度, 在高纬度地区水稻生产将受到大气温度和CO2浓度升高的双重促进作用[99]。玉米产量对大气温度升高的响应结果与水稻类似, 例如模型研究表明欧洲地区玉米产量在温升条件下有增加的趋势[100], 在美洲和非洲地区的研究表明大气温度每升高1oC玉米产量下降0.5 t hm–2[101-102]。通过对历史大气温度和大豆产量耦合进行模型研究分析发现, 在大气温度高的年份大豆产量相对较低[103-104]。但温度对大豆产量形成的不利影响依然取决于不同地区的本底温度。美国中西部大豆主产区生长季的平均温度是22.5oC, 大气温度升高0.8oC该地区大豆的平均产量提高1.7%; 而在美国南部大豆主产区长季的平均温度是26.7oC, 大气温度升高0.8oC则该地区大豆平均产量下降2.4%[105]。在大田试验条件下升高大气CO2浓度到585 µmol mol–1同时升高大气温度3.5oC处理(eCO2+eT), 大豆的光合碳固定能力比只升高大气CO2浓度处理(eCO2)低10%左右。但这种处理间的差异在年际间变异很大, 变异来源于年际间平均温度和降水量的差别[106]。大豆光合作用对大气温度和CO2浓度升高交互作用的响应不是因为c, max和max变化引起的, 而是由于大气温度和CO2浓度升高引起叶片s下降, 最终导致光合碳固定能力的降低[106]。所以, 大气CO2浓度升高可以一定程度上抵消大气温度升高对作物产量形成的不利影响, 但程度取决于大气温度的增幅以及持续天数。在美国主要产区, 小麦、玉米和大豆生育期内经历大于30oC的天数分别为6.0、10.8和13.1 d, 未来高温程度和持续天数都呈增加趋势, 这会完全抵消掉大气CO2浓度升高对作物光合的促进作用[107]。
前文讨论了大气CO2浓度升高可以提高作物的水分利用效率(见1.2), 降低蒸腾作用, 提高土壤含水量从而增加了作物在干旱条件下的生产能力。但是通过模型计算表明, 大气CO2浓度升高给作物带来的抗旱能力来抵消大气温度升高带来的干旱作用是微乎其微的[107]。此外, 大气CO2浓度升高后作物群体叶面积的增加会加剧冠层蒸腾作用, 最终作物的水分需求量并未表现出下降的趋势[108], 这也使得大气CO2浓度升高增强植物高温条件下抗旱能力假设失去了理论基础。但上述论断仅仅是针对雨养区或低纬度地区, 在一些本底温度较低的地区(如高纬度地区)和半干旱地区关于大气CO2浓度和温度升高对作物产量的影响仍然需要进一步研究。
5 研究展望
研究大气CO2浓度升高对植物(作物)生长影响的最主要目的是提高作物产量, 保障不断增加的全球人口粮食安全。如果我们可以完全发挥大气CO2浓度升高对作物特别是对C3作物产量的促进作用, 在2050年大气CO2浓度达到550 µmol mol–1时作物产量可以提高15%左右, 那么对于全球新增的近30亿人口来说意义重大[17]。作物产量和品质对气候变化的响应受到基因型差异的影响, 这是同种作物对气候变化的响应存在较大变异的基础。目前关于气候变化对作物产量形成影响的研究还没把这方面工作放到重要位置。历史上的作物品种选育工作很可能不自觉地利用了大气CO2浓度升高所带来的产量促进作用, 那么在较低大气CO2浓度下选育的年代久远的品种是否在未来气候条件下具有更大的增产潜能呢?能否在同种作物中找到某些更加适应高大气CO2浓度的优势基因?
开展大气CO2浓度升高对植物(作物)生长发育影响的机理机制研究工作可以让我们了解作物高产的潜在可能, 但对于预测未来作物产量变化还远远不够。未来的作物生产受大气CO2浓度不断升高影响的同时还会受到大气温度不断攀升, 极端高温气候事件频发, 大尺度的降雨带迁移造成部分地区干旱(洪涝)加剧以及大气O3浓度不断增加等多因子的交互影响。应该针对我国不同地区气候变化特点, 开展多气候因子对作物生长发育的影响研究可以更加准确判断未来作物生产变化趋势。例如, 在本底温度较低的东北地区开展大气CO2浓度和温度升高的交互作用试验评估该地区水稻、玉米和大豆的增产潜能; 在西北干旱区开展大气CO2浓度升高和不同灌溉水平的交互作用试验为该地区未来节水农业发展提供理论参考; 在东部沿海地区不同季节O3浓度变化大的特点开展大气CO2浓度和O3浓度升高的交互试验评估环境变化对该区的作物产量和品质的影响。这些都是未来我们需要关注的研究方向。
[1] IPCC. Climate Change 2013: the Physical Science Basis. Contribution of Working Group I to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge: Cambridge University Press,2013. pp 95–123.
[2] Still C J, Berry J A, Collatz G J, DeFries R S. Global distribution of C3and C4vegetation: carbon cycle implications.,2003, 17: 1006.
[3] Jablonski L M, Wang X Z, Curtis P S. Plant reproduction under elevated CO2conditions: a meta-analysis of reports on 79 crop and wild species.,2002, 156: 9–26.
[4] Rogers A, Ainsworth E A, Leakey A D B. Will elevated carbon dioxide concentration amplify the benefits of nitrogen fixation in legumes?,2009, 151: 1009–1016.
[5] 韩雪, 林而达, 郝兴宇, 马占云, 王贺然. FACE条件下冬小麦的光合适应. 中国农业气象,2009, 30: 481–485. Han X, Lin E D, Hao X Y, Ma Z Y, Wang H R. Photosynthetic acclimation of winter wheat under free air CO2enrichment (FACE)., 2009, 30: 481–485 (in Chinese with English abstract).
[6] Stitt M, Schulze D. Does Rubisco control the rate of photosynthesis and plant growth? An exercise in molecular ecophysiology.,1994, 17: 465–487.
[7] Eisenhut M, Ruth W, Haimovich M, Bauwe H, Kaplan A, Hagemann M. The photorespiratory glycolate metabolism is essential for cyanobacteria and might have been conveyed endosymbiontically to plants.,2008, 105: 17199–17204.
[8] Brown M E, Funk C C. Food Security and Climate Change. Chichester: Wiley-Blackwell Press, 2018. pp 51–69.
[9] Farquhar G D, von Caemmerer S V, Berry J A. A biochemical model of photosynthetic CO2assimilation in leaves of C3species.,1980, 149: 78–90.
[10] Zhao D L, Reddy K R, Kakani V G, Mohammed A R, Read J J, Gao W. Leaf and canopy photosynthetic characteristics of cotton () under elevated CO2concentration and UV-B radiation.,2004, 161: 581–590.
[11] Long S P, Bernacchi C J. Gas exchange measurements, what can they tell us about the underlying limitations to photosynthesis? Procedures and sources of error.,2003, 54: 2393–2401.
[12] Liu B B, Li M, Li Q M, Cui Q Q, Zhang W D, Ai X Z, Bi H G. Combined effects of elevated CO2concentration and drought stress on photosynthetic performance and leaf structure of cucumber (L.) seedlings.,2018, 56: 942–952.
[13] Chen G Y, Yong Z H, Liao Y, Zhang D Y, Chen Y, Zhang H B, Chen J, Zhu J G, Xu D Q. Photosynthetic acclimation in rice leaves to free-air CO2enrichment related to both ribulose- 1,5-bisphosphate carboxylation limitation and ribulose- 1,5-bisphosphate regeneration limitation.,2005, 46: 1036–1045.
[14] Ainsworth E A, Rogers A. The response of photosynthesis and stomatal conductance to rising CO2: mechanisms and environmental interactions.,2007, 30: 258–270.
[15] Biggins J. Progress in Photosynthesis Research. Berlin: Springer Science & Business Press, 1987. pp 221–224.
[16] Mott K A. Do stomata respond to CO2concentrations other than intercellular?,1988, 86: 200–203.
[17] Leakey A D B, Ainsworth E A, Bernacchi C J, Rogers A, Long S P, Ort D R. Elevated CO2effects on plant carbon, nitrogen, and water relations: six important lessons from FACE.,2009, 60: 2859–2876.
[18] Medlyn B E, Barton C V M, Broadmeadow M S J, Ceulemans R, De Angelis P, Forstreuter M, Freeman M, Jackson S B, Kellomaki S, Laitat E, Rey A, Roberntz P, Sigurdsson B D, Strassemeyer J, Wang K, Curtis P S, Jarvis P G. Stomatal conductance of forest species after long-term exposure to elevated CO2concentration: a synthesis.,2001, 149: 247–264.
[19] Ainsworth E A, Rogers A, Blum H, Nosberger J, Long S P. Variation in acclimation of photosynthesis inafter eight years of exposure to Free Air CO2Enrichment (FACE).,2003, 54: 2769–2774.
[20] Sanz-Saez A, Koester R P, Rosenthal D M, Montes C M, Ort D R, Ainsworth E A. Leaf and canopy scale drivers of genotypic variation in soybean response to elevated carbon dioxide concentration.,2017, 23: 3908–3920.
[21] Thomey M L, Slattery R A, Köhler I H, Bernacchi C J, Ort D R. Yield response of field-grown soybean exposed to heat waves under current and elevated [CO2].,2019, 25: 4352–4368.
[22] Sage R F, Monson R K. C4Plant Biology. Amsterdam: Elsevier Press, 1999. p 87.
[23] Morgan J A, LeCain D R, Read J J, Hunt H W, Knight W G. Photosynthetic pathway and ontogeny affect water relations and the impact of CO2on(C4) and(C3).,1998, 114: 483–493.
[24] Seneweera S P, Ghannoum O, Conroy J. High vapour pressure deficit and low soil water availability enhance shoot growth responses of a C4grass (cv.) to CO2enrichment.,1998, 25: 287–292.
[25] Cunniff J, Jones G, Charles M, Osborne C P. Yield responses of wild C3and C4crop progenitors to subambient CO2: a test for the role of CO2limitation in the origin of agriculture.,2017, 23: 380–393.
[26] Samarakoon A, Gifford R. Elevated CO2effects on water use and growth of maize in wet and drying soil.,1996, 23: 53–62.
[27] Ghannoum O, Caemmerer S V, Ziska L H, Conroy J P. The growth response of C4plants to rising atmospheric CO2partial pressure: a reassessment.,2000, 23: 931–942.
[28] Maroco J P, Edwards G E, Ku M S B. Photosynthetic acclimation of maize to growth under elevated levels of carbon dioxide.,1999, 210: 115–125.
[29] Leakey A D, Uribelarrea M, Ainsworth E A, Naidu S L, Rogers A, Ort D R, Long S P. Photosynthesis, productivity, and yield of maize are not affected by open-air elevation of CO2concentration in the absence of drought.,2006, 140: 779–790.
[30] Zhu C, Ziska L, Zhu J, Zeng Q, Xie Z, Tang H, Jia X, Hasegawa T. The temporal and species dynamics of photosynthetic acclimation in flag leaves of rice () and wheat () under elevated carbon dioxide.,2012, 145: 395–405.
[31] Gamage D, Thompson M, Sutherland M, Hirotsu N, Makino A, Seneweera S. New insights into the cellular mechanisms of plant growth at elevated atmospheric carbon dioxide concentrations.,2018, 41: 1233–1246.
[32] Arp W. Effects of source-sink relations on photosynthetic acclimation to elevated CO2.,1991, 14: 869–875.
[33] Smart D, Chatterton N, Bugbee B. The influence of elevated CO2on non-structural carbohydrate distribution and fructan accumulation in wheat canopies.,1994, 17: 435–442.
[34] Moore B, Cheng S H, Sims D, Seemann J. The biochemical and molecular basis for photosynthetic acclimation to elevated atmospheric CO2.,1999, 22: 567–582.
[35] Ludewig F, Sonnewald U. High CO2-mediated down-regulation of photosynthetic gene transcripts is caused by accelerated leaf senescence rather than sugar accumulation.,2000, 479: 19–24.
[36] Zhu C, Zhu J, Zeng Q, Liu G, Xie Z, Tang H, Cao J, Zhao X. Elevated CO2accelerates flag leaf senescence in wheat due to ear photosynthesis which causes greater ear nitrogen sink capacity and ear carbon sink limitation.,2009, 36: 291–299.
[37] Fabre D, Dingkuhn M, Yin X, Clément-Vidal A, Roques S, Soutiras A, Luquet D. Genotypic variation in morphological source and sink traits affects the response of rice photosynthesis and growth to elevated atmospheric CO2.,2019: 694307.
[38] Bernacchi C J, Calfapietra C, Davey P A, Wittig V E, Scarascia- Mugnozza G E, Raines C A, Long S P. Photosynthesis and stomatal conductance responses of poplars to free-air CO2enrichment (PopFACE) during the first growth cycle and immediately following coppice.,2003, 159: 609–621.
[39] Davey P, Olcer H, Zakhleniuk O, Bernacchi C, Calfapietra C, Long S P, Raines C. Can fast-growing plantation trees escape biochemical down-regulation of photosynthesis when grown throughout their complete production cycle in the open air under elevated carbon dioxide?,2006, 29: 1235–1244.
[40] Paul M J, Foyer C H. Sink regulation of photosynthesis.,2001, 52: 1383–1400.
[41] Aranjuelo I, Pardo A, Biel C, Savé R, Azcón-Bieto J, Nogués S. Leaf carbon management in slow-growing plants exposed to elevated CO2.,2009, 15: 97–109.
[42] Ainsworth E A, Rogers A, Nelson R, Long S P. Testing the “source-sink” hypothesis of down-regulation of photosynthesis in elevated [CO2] in the field with single gene substitutions in.,2004, 122: 85–94.
[43] Gordon A J, Minchin F R, James C L, Komina O. Sucrose synthase in legume nodules is essential for nitrogen fixation.,1999, 120: 867–878.
[44] Wang T, Hedley C. Seed development in peas: knowing your three ‘r’s’ (or four, or five).,1991, 1: 3–14.
[45] 邸伟. 大豆根瘤固氮酶活性与固氮量的研究. 东北农业大学硕士学位论文, 黑龙江哈尔滨, 2010. Di W. Study on Nodule Nitrogenous Activities and Amount of Nitrogen Fixation of Soybean. MS Thesis of Northeast Agricultral University, Harbin, Heilongjiang, China, 2010 (in Chinese with English abstract).
[46] Socias F X, Medrano H, Sharkey T D. Feedback limitation of photosynthesis ofL. grown in elevated CO2.,1993, 16: 81–86.
[47] Cen Y P, Sage R F. The regulation of Rubisco activity in response to variation in temperature and atmospheric CO2partial pressure in sweet potato.,2005, 139: 979–990.
[48] Ellis R J. The most abundant protein in the world.,1979, 4: 241–244.
[49] Spreitzer R J, Salvucci M E. Rubisco: Structure, regulatory interactions, and possibilities for a better enzyme.,2002, 53: 449–475.
[50] Drake B G, Gonzalez M A, Long S P. More efficient plants: a consequence of rising atmospheric CO2?,1997, 48: 609–639.
[51] Vu J C V, Allen L H, Boote K J, Bowes G. Effects of elevated CO2and temperature on photosynthesis and rubisco in rice and soybean.,1997, 20: 68–76.
[52] Rogers A, Fischer B U, Bryant J, Frehner M, Blum H, Raines C A, Long S P. Acclimation of photosynthesis to elevated CO2under low-nitrogen nutrition is affected by the capacity for assimilate utilization. Perennial ryegrass under free-air CO2enrichment.,1998, 118: 683–689.
[53] Yang L X, Wang Y L, Dong G C, Gu H, Huang J Y, Zhu J G, Yang H J, Liu G, Han Y. The impact of free-air CO2enrichment (FACE) and nitrogen supply on grain quality of rice.,2007, 102: 128–140.
[54] Zeng Q, Liu B A, Gilna B, Zhang Y L, Zhu C W, Ma H L, Pang J, Chen G P, Zhu J G. Elevated CO2effects on nutrient competition between a C3crop (L.) and a C4weed (L.).,2011, 89: 93–104.
[55] Uddling J, Broberg M C, Feng Z Z, Pleijel F. Crop quality under rising atmospheric CO2.,2018, 45: 262–267.
[56] Dong J L, Li X, Chu W Y, Duan Z Q. High nitrate supply promotes nitrate assimilation and alleviates photosynthetic acclimation of cucumber plants under elevated CO2.,2017, 218: 275–283.
[57] Long S P, Ainsworth E A, Leakey A D, Nösberger J, Ort D R. Food for thought: lower-than-expected crop yield stimulation with rising CO2concentrations.,2006, 312: 1918–1921.
[58] Taub D R, Wang X. Why are nitrogen concentrations in plant tissues lower under elevated CO2? A critical examination of the hypotheses.,2008, 50: 1365–1374.
[59] Li Y S, Yu Z H, Liu X B, Mathesius U, Wang G H, Tang C X, Wu J J, Liu J D, Zhang S Q, Jin J. Elevated CO2increases nitrogen fixation at the reproductive phase contributing to various yield responses of soybean cultivars.,2017, 8: 1546.
[60] Li Y S, Yu Z H, Yang S C, Jin J, Wang G H, Liu C K, Herbert S J, Liu X B. Soybean intraspecific genetic variation in response to elevated CO2.,2019, 65: 1733–1744.
[61] Feng Z, Rütting T, Pleijel H, Wallin G, Reich P B, Kammann C I, Newton P C, Kobayashi K, Luo Y, Uddling J. Constraints to nitrogen acquisition of terrestrial plants under elevated CO2.,2015, 21: 3152–3168.
[62] Conroy J, Hocking P. Nitrogen nutrition of C3plants at elevated atmospheric CO2concentrations.,1993, 89: 570–576.
[63] Field C B, Jackson R B, Mooney H A. Stomatal responses to increased CO2: implications from the plant to the global scale.,1995, 18: 1214–1225.
[64] Norby R J, Wullschleger S D, Gunderson C A, Johnson D W, Ceulemans R. Tree responses to rising CO2in field experiments: implications for the future forest.,1999, 22: 683–714.
[65] Bunce J A. Direct and acclimatory responses of stomatal conductance to elevated carbon dioxide in four herbaceous crop species in the field.,2001, 7: 323–331.
[66] Stitt M, Krapp A. The interaction between elevated carbon dioxide and nitrogen nutrition: the physiological and molecular background.,1999, 22: 583–621.
[67] BassiriRad H, Gutschick V P, Lussenhop J. Root system adjustments: regulation of plant nutrient uptake and growth responses to elevated CO2.,2001, 126: 305–320.
[68] Hawkesford M J, Barraclough P B. The Molecular and Physiological Basis of Nutrient Use Efficiency in Crops. Chichester: Wiley-Blackwell Press, 2011. pp 5–19.
[69] Tanner W, Beevers H. Transpiration, a prerequisite for long-distance transport of minerals in plants?,2001, 98: 9443–9447.
[70] Wu K, Chen D, Tu C, Qiu Y, Burkey K O, Reberg-Horton S C, Peng S, Hu S. CO2-induced alterations in plant nitrate utilization and root exudation stimulate N2O emissions.,2017, 106: 9–17.
[71] Luo Y, Su B, Currie W S, Dukes J S, Finzi A, Hartwig U, Hungate B, McMurtrie R E, Oren R, Parton W J. Progressive nitrogen limitation of ecosystem responses to rising atmospheric carbon dioxide.,2004, 54: 731–739.
[72] Cheng L, Booker F L, Tu C, Burkey K O, Zhou L, Shew H D, Rufty T W, Hu S. Arbuscular mycorrhizal fungi increase organic carbon decomposition under elevated CO2.,2012, 337: 1084–1087.
[73] Niu Y, Chai R, Dong H, Wang H, Tang C, Zhang Y. Effect of elevated CO2on phosphorus nutrition of phosphate-deficient(L.) Heynh under different nitrogen forms.,2013, 64: 355–367.
[74] Loladze I. Hidden shift of the ionome of plants exposed to elevated CO2depletes minerals at the base of human nutrition.,2014, 3.
[75] Robinson E A, Ryan G D, Newman J A. A meta-analytical review of the effects of elevated CO2on plant-arthropod interactions highlights the importance of interacting environmental and biological variables.,2012, 194: 321–336.
[76] Bates P D, Stymne S, Ohlrogge J. Biochemical pathways in seed oil synthesis.,2013, 16: 358–364.
[77] Li Y S, Yu Z H, Jin J, Zhang Q Y, Wang G H, Liu C K, Wu J J, Wang C, Liu X B. Impact of elevated CO2on seed quality of soybean at the fresh edible and mature stages.,2018, 9: 1413.
[78] Clemente T E, Cahoon E B. Soybean oil: genetic approaches for modification of functionality and total content.,2009, 151: 1030–1040.
[79] Demorest Z L, Coffman A, Baltes N J, Stoddard T J, Clasen B M, Luo S, Retterath A, Yabandith A, Gamo M E, Bissen J, Mathis L, Voytas D F, Zhang F. Direct stacking of sequence-specific nuclease-induced mutations to produce high oleic and low linolenic soybean oil.,2016, 16: 225.
[80] 蒋跃林, 张庆国, 岳伟, 姚玉刚, 王公明. 大气CO2浓度升高对大豆生长和产量的影响. 中国农学通报, 2005, 21: 355–355. Jiang Y L, Zhang Q G, Yue W, Yao G Y, Wang G M. Effects of elevated atmospheric CO2concentration on growth and yield of soybean., 2005, 21: 355–355 (in Chinese with English abstract).
[81] Högy P, Franzaring J, Schwadorf K, Breuer J, Schuetze W, Fangmeier A. Effects of free-air CO2enrichment on energy traits and seed quality of oilseed rape.,2010, 139: 239–244.
[82] Myers S S, Zanobetti A, Kloog I, Huybers P, Leakey A D, Bloom A J, Carlisle E, Dietterich L H, Fitzgerald G, Hasegawa T, Holbrook N M, Nelson R L, Ottman M J, Raboy V, Sakai H, Sartor K A, Schwartz J, Seneweera S, Tausz M, Usui Y. Increasing CO2threatens human nutrition.,2014, 510: 139–142.
[83] Soares J, Deuchande T, Valente L M, Pintado M, Vasconcelos M W. Growth and nutritional responses of bean and soybean genotypes to elevated CO2in a controlled environment.,2019, 8: 465.
[84] Li Y S, Yu Z H, Yang S C, Wang G H, Liu X B, Wang C Y, Xie Z H, Jin J. Impact of elevated CO2on C : N : P ratio among soybean cultivars.,2019, 694: 133784.
[85] Swaminathan S, Vaz M, Kurpad A V. Protein intakes in India.,2012, 108: S50–S58.
[86] Pratelli R, Pilot G. Regulation of amino acid metabolic enzymes and transporters in plants.,2014, 65: 5535–5556.
[87] Takahashi M, Uematsu Y, Kashiwaba K, Yagasaki K, Hajika M, Matsunaga R, Komatsu K, Ishimoto M. Accumulation of high levels of free amino acids in soybean seeds through integration of mutations conferring seed protein deficiency.,2003, 217: 577–586.
[88] Beidler K V, Taylor B N, Strand A E, Cooper E R, Schonholz M, Pritchard S G. Changes in root architecture under elevated concentrations of CO2and nitrogen reflect alternate soil exploration strategies.,2015, 205: 1153–1163.
[89] World Health Organization. The World Health Report 2002: Reducing Risks, Promoting Healthy Life. France: World Health Organization, 2002. [2020-04-26]. https://www.who.int/whr/2002/en/.
[90] Brown K H, Wuehler S E, Peerson J M. The importance of zinc in human nutrition and estimation of the global prevalence of zinc deficiency.,2001, 22: 113–125.
[91] Zhu C, Kobayashi K, Loladze I, Zhu J, Jiang Q, Xu X, Liu G, Seneweera S, Ebi K L, Drewnowski A. Carbon dioxide (CO2) levels this century will alter the protein, micronutrients, and vitamin content of rice grains with potential health consequences for the poorest rice-dependent countries.,2018, 4: eaaq1012.
[92] Saugier B. Carbon Dioxide and Environmental Stress. Amsterdam: Elsevier Press, 1999. pp 215–244.
[93] McDonald E P, Erickson J E, Kruger E L. Can decreased transpiration limit plant nitrogen acquisition in elevated CO2?,2002, 29: 1115–1120.
[94] Pérez-López U, Miranda-Apodaca J, Mena-Petite A, Muñoz- Rueda A. Responses of nutrient dynamics in barley seedlings to the interaction of salinity and carbon dioxide enrichment.,2014, 99: 86–99.
[95] IPCC. Global Warming of 1.5°C: an IPCC Special Report, IPCC Secretariat. Cambridge: Cambridge University Press,2018. pp 175–311.
[96] Kim H Y, Ko J, Kang S, Tenhunen J. Impacts of climate change on paddy rice yield in a temperate climate.,2013, 19: 548–562.
[97] Van Oort P A, Zwart S J. Impacts of climate change on rice production in Africa and causes of simulated yield changes.,2018, 24: 1029–1045.
[98] Wang J, Liu X, Zhang X, Smith P, Li L, Filley T R, Cheng K, Shen M, He Y, Pan G. Size and variability of crop productivity both impacted by CO2enrichment and warming—a case study of 4 year field experiment in a Chinese paddy.,2016, 221: 40–49.
[99] Ainsworth E A, Ort D R. How do we improve crop production in a warming world?,2010, 154: 526–530.
[100] Supit I, Van Diepen C, De Wit A, Kabat P, Baruth B, Ludwig F. Recent changes in the climatic yield potential of various crops in Europe.,2010, 103: 683–694.
[101] Bassu S, Brisson N, Durand J L, Boote K, Lizaso J, Jones J W, Rosenzweig C, Ruane A C, Adam M, Baron C. How do various maize crop models vary in their responses to climate change factors?,2014, 20: 2301–2320.
[102] Sultan B, Gaetani M. Agriculture in West Africa in the twenty-first century: climate change and impacts scenarios, and potential for adaptation.,2016, 7: 1262.
[103] Lobell D B, Field C B. Global scale climate-crop yield relationships and the impacts of recent warming.,2007, 2: 014002.
[104] Kucharik C J, Serbin S P. Impacts of recent climate change on Wisconsin corn and soybean yield trends.,2008, 3: 034003.
[105] Hatfield J L, Boote K J, Kimball B, Ziska L, Izaurralde R C, Ort D, Thomson A M, Wolfe D. Climate impacts on agriculture: implications for crop production.,2011, 103: 351–370.
[106] Ruiz-Vera U M, Siebers M, Gray S B, Drag D W, Rosenthal D M, Kimball B A, Ort D R, Bernacchi C J. Global warming can negate the expected CO2stimulation in photosynthesis and productivity for soybean grown in the midwestern United States.,2013, 162: 410–423.
[107] Schauberger B, Archontoulis S, Arneth A, Balkovic J, Ciais P, Deryng D, Elliott J, Folberth C, Khabarov N, Müller C, Thomas A M, Rolinski S, Schaphoff S, Schmid E, Wang X H, Schlenker W, Frieler K. Consistent negative response of US crops to high temperatures in observations and crop models.,2017, 8: 1–9.
[108] Frenck G, van der Linden L, Mikkelsen T N, Brix H, Jørgensen R B. Increased [CO2] does not compensate for negative effects on yield caused by higher temperature and [O3] inL.,2011, 35: 127–134.
Physiological response of crop to elevated atmospheric carbon dioxide concentration: a review
LI Yan-Sheng1,2,*, JIN Jian2,*, and LIU Xiao-Bing2
1Institute of Environment and Sustainable Development in Agriculture, Chinese Academy of Agricultural Sciences / Key Laboratory of Agricultural Environment, Ministry of Agriculture and Rural Affairs, Beijing 100081, China;2Key Laboratory of Mollisols Agroecology / Northeast Institute of Geography and Agroecology, Chinese Academy of Sciences, Harbin 150081, Heilongjiang, China
The increase of atmospheric concentration of carbon dioxide ([CO2]) has substantially had a huge impact on agricultural production. As the sole substrate for photosynthesis, the increase of atmospheric [CO2] stimulates the net photosynthetic rate, thus promoting the biomass accumulation and yield level in many crops. However, the ‘fertilization’ effect of the elevated atmospheric [CO2] on crop production is less than theoretical expectation, and elevated [CO2] increases the health risk due to the decline in grain quality. The relevant mechanism is still unclear. In this paper, we analyzed the effect of elevated [CO2] on crop photosynthesis system, reviewed various responses of key photosynthesis indicators, such as the leaf net photosynthetic rate, the intercellular [CO2] of leaves, maximum carboxylation rate of Rubisco (c, max), and the capacity of Rubp-regeneration (max) in different crops, in response to the elevated atmospheric [CO2]. Based on the C-N metabolism of the whole plant, we summarized two prevailing hypotheses about the acclimation of photosynthetic capacity under elevated atmospheric [CO2], namely the source-sink regulation mechanism and N limitation mechanism, respectively. We summarized the influence of elevated [CO2] on the nutritional quality of the grain, such as the change in the protein, oil, mineral elements, and vitamin concentrations. Furthermore, we also reviewed the potential interactive effect of the elevated atmospheric temperature and [CO2] on crop growth. Finally, the main research directions of this field in the future are proposed. In summary, this review can provide theoretical reference for accurately assessing the changes in crop yield and quality under climate change conditions, maximizing the ‘fertilization’ effect of elevated [CO2], and mitigating the adverse effects of climate change on crop production.
climate change; global warming; rice; wheat; soybean; maize
本研究由农业农村部农业环境重点实验室开放基金, 国家重点研发计划项目(2017-YFD0300300)和国家自然科学基金项目(31501259)资助。
The study was supported by the Foundation of Key Laboratory for Agricultural Environment, the Ministry of Agriculture of China, the National Key Research and Development Program of China (2017YFD0300300), and the National Natural Science Foundation of China (31501259).
李彦生, E-mail: liyansheng@iga.ac.cn; 金剑, E-mail: jinjian@iga.ac.cn
2020-04-15;
2020-08-19;
2020-08-28.
URL: https://kns.cnki.net/kcms/detail/11.1809.s.20200828.1121.002.html
10.3724/SP.J.1006.2020.02027
