甘薯IbCAF1基因的克隆及耐盐性、抗旱性鉴定
2020-11-27陈杉彬孙思凡何绍贞刘庆昌
陈杉彬 孙思凡 聂 楠 杜 冰 何绍贞 刘庆昌 翟 红
甘薯基因的克隆及耐盐性、抗旱性鉴定
陈杉彬 孙思凡 聂 楠 杜 冰 何绍贞 刘庆昌 翟 红*
中国农业大学/ 农业农村部甘薯生物学与生物技术重点实验室/ 教育部作物杂种优势研究与利用重点实验室/ 北京市作物遗传改良重点实验室, 北京 100193
(CCR4-associated factor 1)基因在植物发育、抗病等方面发挥着重要的作用。本研究根据前期获得的差异表达EST序列, 克隆得到甘薯基因。基因的开放阅读框(open reading frame, ORF)长度为846 bp, 编码281个氨基酸, 分子量为32.13 kD, 等电点为4.83。氨基酸序列比对和系统进化树分析表明, IbCAF1与甘薯近缘野生种(2)同源蛋白ItlCAF1有较高的同源性, 序列一致性为96.8%。基因受到NaCl、PEG、ABA和H2O2的诱导表达。利用根癌农杆菌介导法将基因转入烟草, 过表达基因显著提高了转基因烟草植株的耐盐性和抗旱性。在200 mmol L-1NaCl和10% PEG-6000的胁迫下,基因的过表达显著上调了转基因烟草植株中活性氧清除系统和脯氨酸合成相关基因的表达, 增加了SOD活性、POD活性、脯氨酸含量, 降低了H2O2含量和丙二醛含量。表明基因能够提高转基因烟草植株的耐盐性和抗旱性。本研究为后续甘薯基因耐盐抗旱基因工程研究奠定了基础。
甘薯;; 转基因烟草; 耐盐; 抗旱
土壤盐害和干旱严重影响了作物的产量, 成为限制农业生产的主要因素之一。据统计, 世界上存在着8亿公顷盐渍化土地, 约20%灌溉农业用地受到盐碱化的影响[1]。我国耕地中盐渍化面积达到920.9万公顷, 占全国耕地面积6.62%, 其中只有少部分被改良利用, 绝大部分仍未脱盐及不断遭受盐渍危害[2]。全球气候变化和人口增长引发的全球水资源短缺问题威胁着农业的可持续发展[3]。因此, 提高作物的耐盐性和抗旱性迫在眉睫。
Ccr4-Not复合物是一种多亚基的蛋白质复合物, 在真核生物中高度保守, 主要参与转录调控、mRNA降解、组蛋白修饰等重要生理过程[4-5]。CAF1 (CCR4-associated factor 1)是Ccr4-Not复合物中关键的亚基, 对复合物的形成及功能的行使起着重要作用[6]。CAF1属于DEDD家族, 是参与mRNA降解的主要脱腺苷酸酶之一, 在植物生长、胁迫响应和抵御微生物病原菌等方面发挥着重要作用[7-8]。Sarowar等[9]将辣椒基因转入番茄发现,基因的过量表达不但显著促进番茄的生长, 还增强了对番茄晚疫病病菌()的抗性。Liang等[10]研究发现,基因的过量表达, 上调了和基因的表达量, 从而增强了拟南芥转基因植株对丁香假单胞菌(DC3000)的抗性。基因的过表达增强了拟南芥转基因植株对坏死性真菌病原菌()的敏感性[11]。Shimo等[12]研究发现, 甜橙基因与甜橙溃疡病的抗性有关。有关基因提高植物的耐盐性报道较少。Walley等[13]研究发现, 在200 mmol L-1NaCl胁迫下, 拟南芥突变体种子的发芽率显著高于野生型对照。目前, 有关基因提高植物的抗旱性研究还未见报道。
甘薯是世界上第七大重要粮食作物, 同时也是饲料、工业原料、生物质能源作物[14]。然而, 其产量也受到盐和干旱胁迫的严重制约。因此, 培育耐盐抗旱品种是甘薯育种的重要目标之一。基因工程为定向改良甘薯耐盐抗旱性提供了可行的方法[15-29]。本研究从甘薯中克隆得到基因, 其过量表达显著提高了转基因烟草植株的耐盐性和抗旱性。
1 材料与方法
1.1 植物材料
以甘薯品种鲁薯3号为材料克隆基因。利用烟草品种Wisconsin 38 (W38)分析基因的功能。
1.2 IbCAF1基因的克隆与序列分析
根据前期逆境胁迫获得的基因EST序列, 在甘薯近缘野生种(2=2=30)数据库(http://sweetpotato-garden.kazusa.or.jp/blast.html)中进行BLAST分析, 获得的ORF序列。参照杨元军等[30]的方法提取甘薯总RNA。用TaKaRa公司的PrimeSript RT Kit合成cDNA。使用Primer Premier 5软件, 根据基因ORF序列设计扩增引物(表1), 以cDNA为模板, 进行PCR扩增。PCR扩增体系为25 μL, 包含模板1.0 μL、10×Reaction buffer 2.5 μL、DNA Polymerase (5 U μL-1) 0.2 μL、dNTP (10 mmol L-1) 0.5 μL、-F和-R (10 μmol L-1) 各0.5 μL、ddH2O 19.8 μL。PCR扩增程序为94℃ 5 min; 95℃ 30 s, 57℃ 30 s, 72℃ 1 min, 35个循环; 72℃ 5 min; 4℃保温。
利用ProtParam (https://web.expasy.org/protparam/) 分析蛋白质的理化性质, 利用SOPMA (https://npsa- prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html) 在线预测蛋白质二级结构, 利用CDS (https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)预测保守结构域, 利用NCBI数据库进行Blastp分析(http://blast.ncbi.nlm.nih.gov/Blast.cgi), 寻找该基因的同源序列, 并利用MEGA7.0 (http://www. megasoftware.net/)构建同源进化树。
1.3 IbCAF1基因的表达分析
选取长势良好的甘薯试管苗, 在MS固体培养基中继代培养30 d, 在1/2 Hoagland溶液中培养3 d, 然后将试管苗分别浸入含有200 mmol L-1NaCl、20% PEG-6000、100 μmol L-1ABA和10 mmol L-1H2O2的1/2 Hoagland溶液中处理0、0.5、1、3、6、12、24、48 h, 处理后的试管苗存于−80℃冰箱待用。以甘薯肌动蛋白基因()作为内参基因, 用Primer Premier 5软件根据基因的ORF非保守区间设计实时定量PCR引物(表1)。使用SYBR(Tli RNaseH Plus)荧光定量试剂盒(宝生物工程(大连)有限公司, RR420)进行qRT-PCR分析。
1.4 烟草遗传转化
将构建的pCAMBIA1300-质粒通过冻融法转入根癌农杆菌EHA105中。采用叶盘法对烟草品种W38进行转化[31]。将侵染后的烟草叶盘接种于含有15 mg L-1潮霉素、400 mg L-1头孢氨苄、1.0 mg L-16-BA和0.1 mg L-1NAA的MS培养基上, 每天13 h、54mmol m-2s-1光照, (27±1)℃培养30 d, 然后将再生芽培养于含有15 mg L-1潮霉素、400 mg L-1头孢氨苄、1.0 mg L-16-BA和0.1 mg L-1NAA的1/2 MS培养基上, 直至长成完整植株。对再生植株进行PCR检测, 所用引物序列见表1。
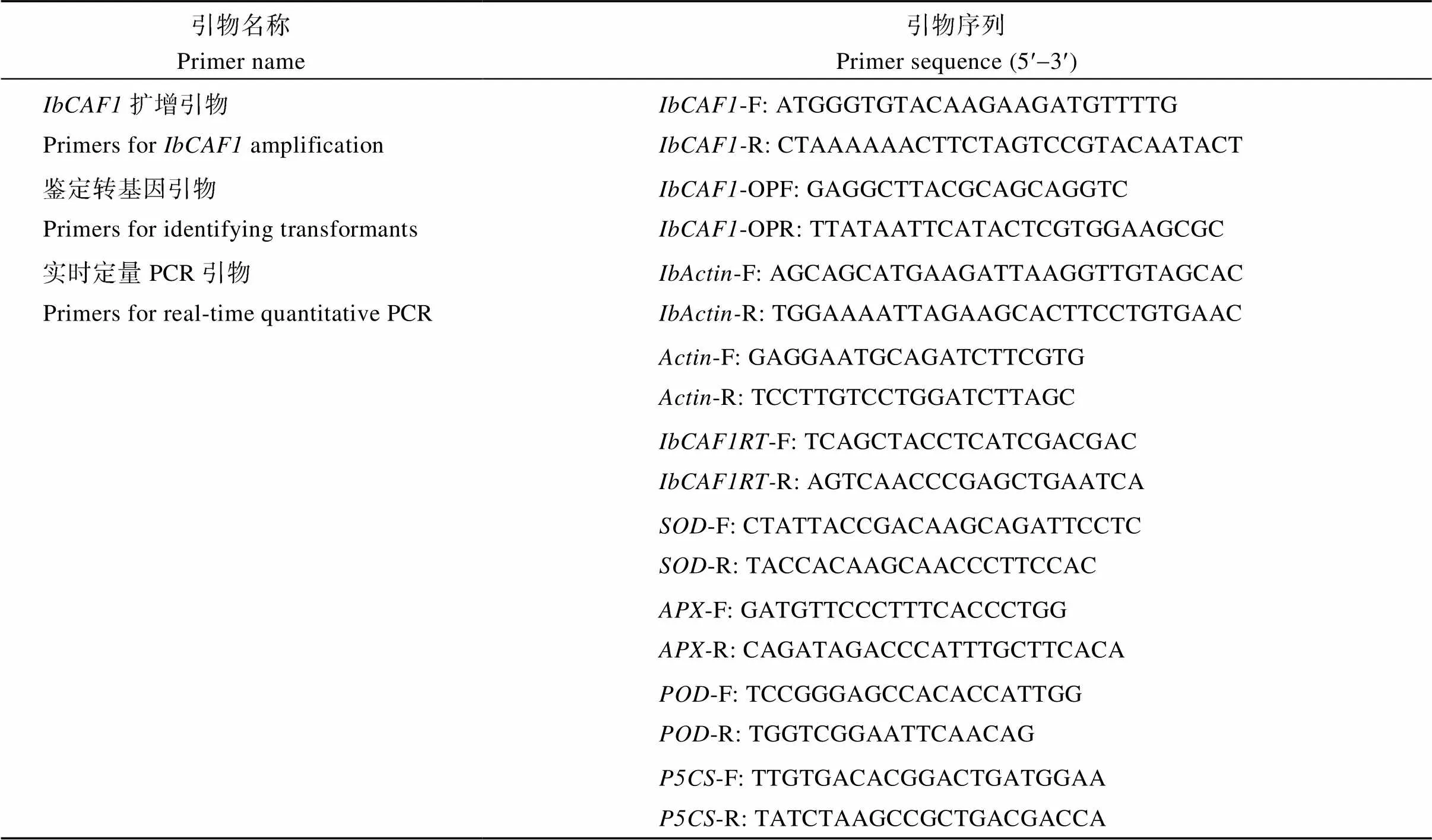
表1 本研究所用引物
1.5 耐盐性、抗旱性鉴定
参照Jiang等[32]和喻娜等[33]的方法(略有改动), 对转基因烟草植株进行耐盐和抗旱性离体鉴定。将转基因植株和野生型对照植株分别培养于含有200 mmol L-1NaCl和10% PEG-6000的MS培养基上, 培养条件为(27±1)℃, 每天13 h、54mmol m-2s-1光照, 胁迫培养4周后, 观察植株生长状态, 并测定相关生理生化指标。参考Zhai等[26]的方法测定脯氨酸、MDA、H2O2含量、SOD和POD活性。
1.6 抗逆相关基因的表达分析
对0、200 mmol L-1NaCl或10% PEG-6000处理4周的转基因烟草植株的抗逆相关基因的表达量进行分析。用Primer Premier 5软件设计基因的特异扩增引物。抗逆相关基因包括活性氧清除相关基因、、, 以及脯氨酸合成相关基因。参照Huo等[34]设计内标基因烟草肌动蛋白基因()的检测引物。引物序列见表1。
1.7 统计分析
每个试验设置3次重复, 通过<0.01或<0.05的检验分析差异显著性。
2 结果与分析
2.1 IbCAF1基因的克隆与序列分析
从甘薯品种鲁薯3号中克隆了基因, 该基因的ORF长度为846 bp, 编码281个氨基酸, 分子量为32.13 kD, 理论等电点pI为4.83, 是酸性蛋白, 不稳定系数为36.36, 亲水性平均系数为-0.167, 说明该蛋白是一个稳定的亲水蛋白。基因编码蛋白是由45.55%的α螺旋、36.30%的不规则卷曲、13.52%的延伸链和4.63%的β折叠组成。IbCAF1属于CAF1超家族成员(图1-A)。基因与甘薯近缘野生种(2=2=30)亲缘关系最近, 序列一致性为96.8% (图1-B, C)。
2.2 IbCAF1基因的表达分析
基因在鲁薯3号茎中的表达水平显著高于在叶和根中(图2-A)。其在离体培养的鲁薯3号植株中的表达受到NaCl、PEG-6000、ABA和H2O2的强烈诱导, 在200 mmol L-1NaCl处理24 h时达到高峰(1.4倍), 在20% PEG-6000处理12 h时达到高峰(15.4倍), 在100 μmol L-1ABA处理12 h时达到高峰(4.4倍), 在10 mmol L-1H2O2处理0.5 h时达到高峰(1.7倍)(图2-B)。

图1 IbCAF1基因序列分析
A: IbCAF1蛋白序列分析; B: 甘薯CAF1蛋白和其他植物中的CAF1蛋白序列比对; C: 甘薯CAF1蛋白和其他植物中的CAF1蛋白的同源进化树分析。ItlCAF1: 三裂叶野牵牛(XP_031110715.1); InCAF1: 牵牛(XP_019199562.1); NtCAF1: 烟草(XP_016511744.1); SpCAF1: 番茄近缘野生种(XP_015079674.1); CaCAF1: 辣椒(NP_001312000.1); SlCAF1: 番茄(XP_004241342.1); StCAF1: 马铃薯(XP_006361099.1)。
A: sequence analysis of IbCAF1 protein. B: multiple sequence alignment of IbCAF1 and CAF1 proteins from other plants. C: phylogenetic analysis of IbCAF1 and CAF1 proteins from other plants. ItlCAF1:(XP_031110715.1); InCAF1:(XP_019199562.1), NtCAF1:(XP_016511744.1); SpCAF1:(XP_015079674.1), CaCAF1:(NP_001312000.1), SlCAF1:(XP_004241342.1), StCAF1:(XP_006361099.1).
2.3 转基因烟草植株的获得
利用Wang等[31]的方法获得12株转基因烟草植株, 即L1, L2, …, L12。qRT-PCR结果显示, 转基因植株中的表达量均显著高于WT (图3)。选取表达量较高的L1、L5和L9株系进行后续的分析。
2.4 过表达IbCAF1基因能够提高烟草的耐盐性和抗旱性
将3个转基因株系(L1、L5和L9)和野生型植株分别在200 mmol L-1NaCl和10% PEG-6000的MS培养基上和无胁迫条件下培养4周。转基因植株和野生型植株在无胁迫条件下生长无明显差异。在盐胁迫和干旱胁迫下, 转基因植株生长良好(图4-A), 叶片中积累了较少的H2O2(图4-B, D)和O2-(图4-C), SOD活性、POD活性和脯氨酸含量均显著高于WT, MDA含量在盐和干旱胁迫下显著低于WT (图4-E~H)。
2.5 转基因植株抗性相关基因的表达分析
在200 mmol L-1NaCl和10% PEG-6000的胁迫下, 过表达株系与WT相比, ROS清除相关基因、和上调表达, 脯氨酸合成相关基因上调表达(图5)。
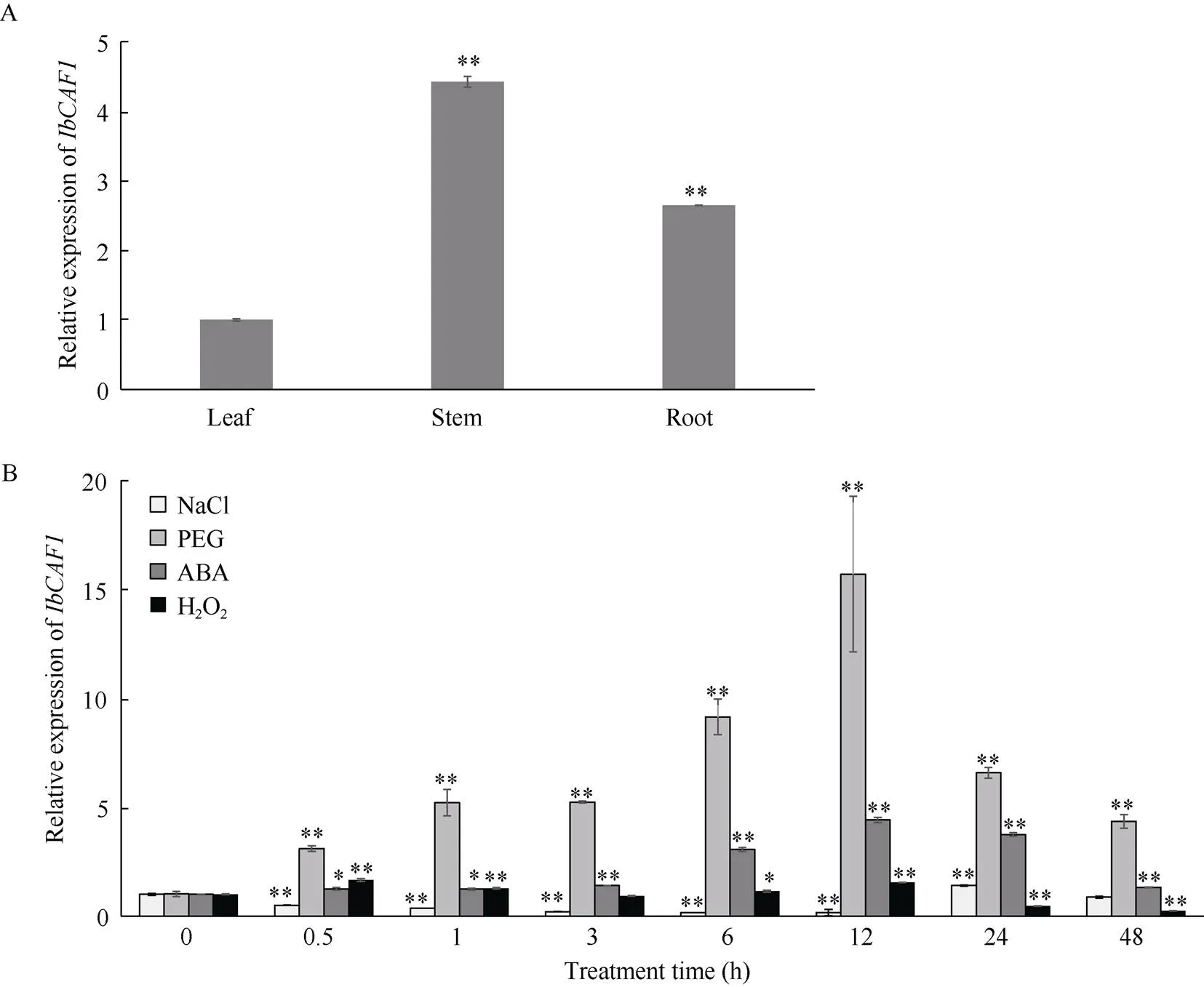
图2 IbCAF1基因在鲁薯3号中的表达分析
A:基因在鲁薯3号不同组织中的表达; B: 200 mmol L–1NaCl、20% PEG-6000、100mmol L–1ABA和10 mmol L–1H2O2分别处理不同时间后, 鲁薯3号中基因的表达分析。*与**分别表示在0.05和0.01水平下差异显著。
A: expression analysis ofgene in different tissues of Lushu 3; B: expression analysis of thegene in Lushu 3 after different times (h) in response to 200 mmol L–1NaCl, 20% PEG-6000, 100 μmol L–1ABA and 10 mmol L–1H2O2, respectively.* and ** indicate significantly different at the 0.05 and 0.01 probability levels, respectively.
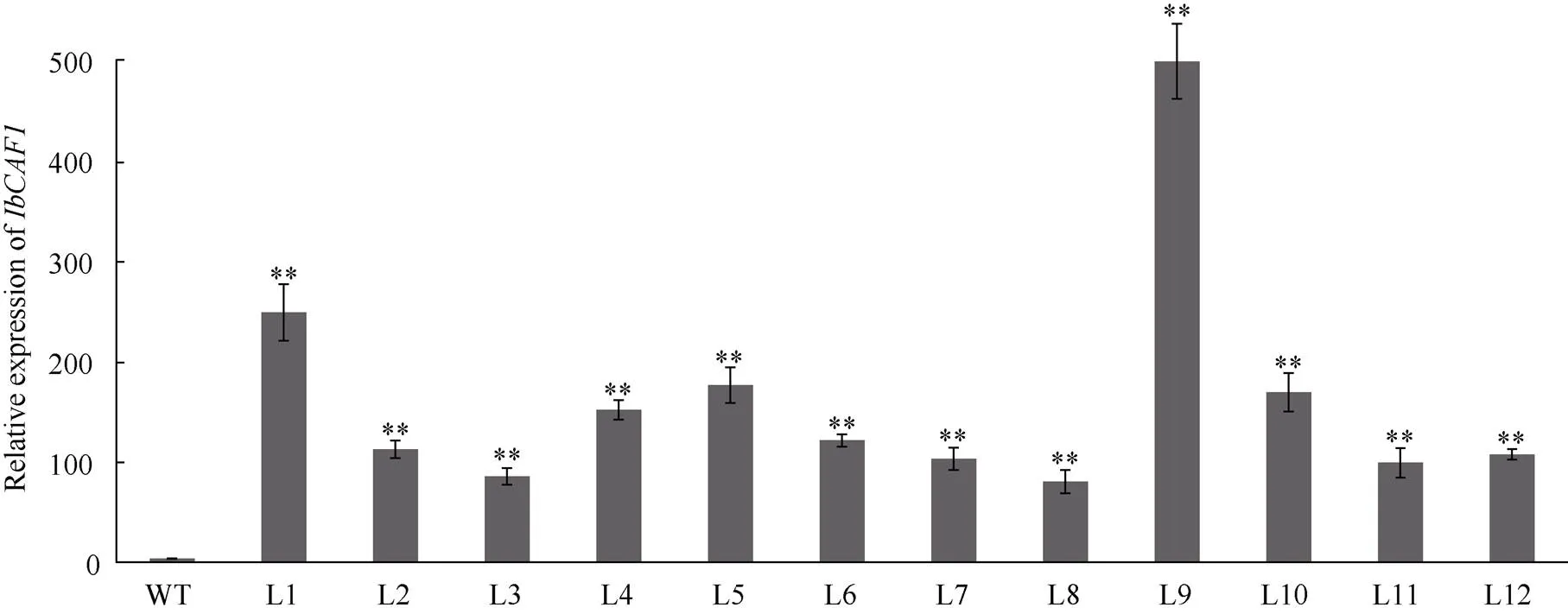
图3 转基因烟草植株的IbCAF1基因的qRT-PCR分析
**表示在0.01水平下差异显著。**: significantly different at the 0.01 probability level.
3 讨论
CAF1是参与mRNA降解的主要脱腺苷酸酶之一, 在调控基因表达和影响生物学性状方面起着重要作用[7]。目前, CAF1在酵母和动物中被广泛研究,在植物中的作用还不清楚。只有少数植物, 如拟南芥[10-11,13]、辣椒[9]、甜橙[12]等有基因功能的研究报道, 表明该基因在植物的生长发育及生物和非生物胁迫的应答过程中发挥重要作用。到目前为止,基因在植物中的耐盐作用还不清楚, 抗旱性研究还未见报道。本研究发现基因能够被NaCl、PEG、ABA和H2O2诱导上调表达(图2-B), 并且基因的过量表达增强了转基因烟草植株的耐盐抗旱性(图4)。
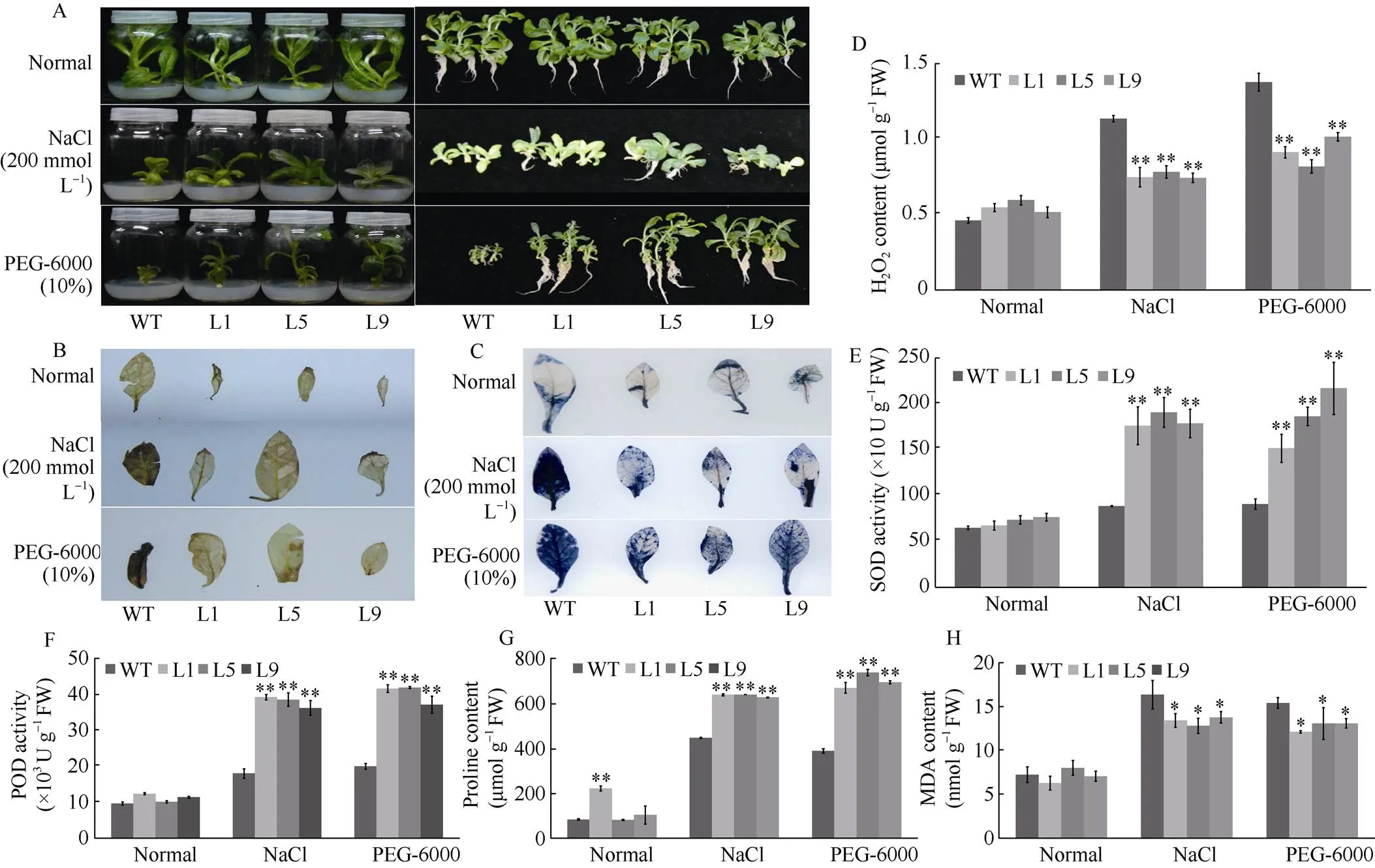
图4 IbCAF1增强了转基因烟草植株的耐盐性和抗旱性
A: 转基因烟草植株和WT烟草植株在无胁迫或添加200 mmol L–1NaCl或10% PEG-6000的1/2 MS培养基上培养4周; B~H: 在无胁迫、200 mmol L–1NaCl或10% PEG-6000的1/2 MS培养基上培养4周的转基因烟草和WT烟草叶片的DAB染色(B)、NBT染色(C)、H2O2含量(D)、SOD活性(E)、POD活性(F)、脯氨酸含量(G)、丙二醛含量(H)。*与**分别表示在0.05和0.01水平下差异显著。
A: responses of-transgenic and WT tobacco plants cultured for 4 weeks on half-MS medium supplemented without stress or with 200 mmol L–1NaCl or 10% PEG-6000; B–H: DAB staining (B), NBT staining (C), H2O2content (D), SOD activity (E), POD activity (F), proline content (G), and MDA content (H) in the leaves oftransgenic and WT tobacco plants cultured for 4w on half-MS medium supplemented with no stress, 200 mmol L–1NaCl or 10% PEG-6000. * and ** indicate significantly different at the 0.05 and 0.01 probability levels, respectively.
在盐或干旱胁迫下, 植物体内常常会产生大量的活性氧(ROS), 如超氧阴离子(O2܋)和过氧化氢(H2O2)等。ROS的大量累积会造成细胞氧化损伤, 对植物有很大的毒害作用。超氧化物歧化酶(SOD)、抗坏血酸过氧化物酶(APX)和过氧化物酶(POD)等ROS清除系统, 可以解毒ROS, 以减少植物细胞中的氧化损伤而增强抗逆性[19,35]。在盐或干旱胁迫下, 脯氨酸水平的升高增强了植物的耐盐性和抗旱性[28,35]。脯氨酸可以调节植物细胞质pH防止其酸化, 保护膜完整性, 同时还具有清除活性氧的功能[36]。丙二醛(MDA)的含量变高时会致使细胞发生膜损伤, 植物的耐盐抗旱性也会因此减弱[37-38]。在本研究中, 盐或干旱胁迫条件下, 在过量表达的烟草植株中, 活性氧清除相关基因、和和脯氨酸合成相关基因被显著上调表达, 增加了SOD活性, POD活性, 脯氨酸含量, 降低了H2O2含量和MDA含量, 从而增强了转基因烟草植株的耐盐性和抗旱性(图4和图5)。
4 结论
基因的过表达通过上调活性氧清除和脯氨酸合成相关基因的表达, 增加SOD活性、POD活性、脯氨酸含量, 降低H2O2含量和丙二醛含量, 从而增强转基因烟草植株的耐盐性和抗旱性。基因将在提高甘薯等植物耐盐抗旱性方面具有一定的应用潜力。
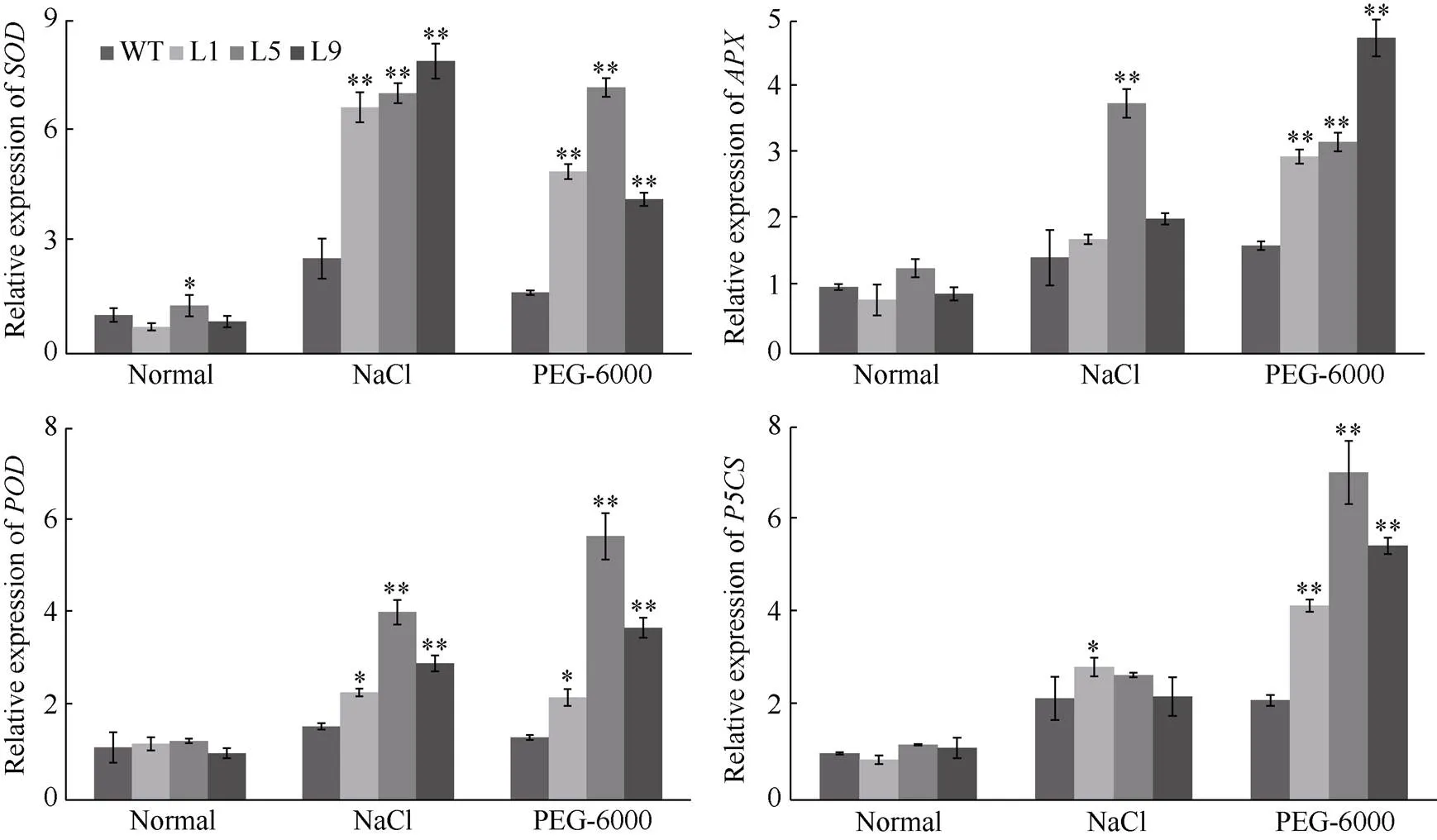
图5 转基因植株及WT植株的抗逆相关基因的表达分析
*与**分别表示在0.05和0.01水平下差异显著。
* and ** indicate significantly different at the 0.05 and 0.01 probability levels, respectively.
[1] Munns R, Tester M. Mechanisms of salinity tolerance., 2008, 59: 651–681.
[2] 王佳丽, 黄贤金, 钟太洋, 陈志刚. 盐碱地可持续利用研究综述. 地理学报, 2011, 66: 673–684. Wang J L, Huang X J, Zhong T Y, Chen Z G. Review on sustainable utilization of salt-affected land., 2011, 66: 673–684 (in Chinese with English abstract).
[3] Yang S J, Vanderbeld B, Wan J X, Huang Y F. Narrowing down the targets: towards successful genetic engineering of drought tolerant crops., 2010, 3: 469–490.
[4] Molin L, Puisieux A.homologue of thegene, which encodes a subunit of the CCR4-NOT complex, is essential for embryonic and larval development and for meiotic progression., 2005, 358: 73–81.
[5] Collart M A. The CCR4-NOT complex is a key regulator of eukaryotic gene expression., 2016, 7: 438–454.
[6] Berthet C, Morera A M, Asensio M J, Chauvin M A, Morel A P, Dijoud F, Magaud J P, Durand P, Rouault J P. CCR4-associated factor CAF1 is an essential factor for spermatogenesis., 2004, 24: 5808–5820.
[7] Cui Y J, Ramnarain D B, Chiang Y C, Ding L H, McMahon J S, Denis C L. Genome wide expression analysis of the CCR4-NOT complex indicates that it consists of three modules with the NOT module controlling SAGA-responsive genes., 2008, 279: 323–337.
[8] Feng L K, Yan Y B. The N-terminus modulates human Caf1 activity, structural stability and aggregation., 2012, 51: 497–503.
[9] Sarowar S, Oh H W, Cho H S, Baek K H, Seong E S, Joung Y H, Choi G J, Lee S, Choi D.CCR4-associated factoris necessary for plant development and defence response., 2007, 51: 792–802.
[10] Liang W X, Li C B, Liu F, Jiang H L, Li S Y, Sun J Q, Wu X Y, Li C Y. Thehomologs of CCR4-associated factor 1 show mRNA deadenylation activity and play a role in plant defence responses., 2009, 19: 307–316.
[11] Kwon T, Yi Y B, Nam J. Overexpression of, CCR4-associated factor 1 homologue in, negatively regulates wounding-mediated disease resistance., 2011, 38: 278–284.
[12] Shimo H M, Terassi C, Lima Silva C C, de Lima Zanella J, Mercaldi G F, Rocco S A, Benedetti C E. Role of theRNA deadenylase CsCAF1 in citrus canker resistance., 2019, 20: 1105–1118.
[13] Walley J W, Kelley D R, Nestorova G, Hirschberg D L, Dehesh K.deadenylases AtCAF1a and AtCAF1b play overlapping and distinct roles in mediating environmental stress responses., 2010, 152: 866–875.
[14] Liu Q C. Sweet potato omics and biotechnology in China., 2011, 4: 295.
[15] Park S C, Kim Y H, Jeong J C, Kim C Y, Lee H S, Bang J W, Kwak S S. Sweetpotato late embryogenesis abundant 14 () gene influences lignification and increases osmotic- and salt stress-tolerance of transgenic calli., 2011, 233: 621–634.
[16] Kim S H, Ahn Y O, Ahn M J, Lee H S, Kwak S S. Down-regulation of β-carotene hydroxylase increases β-carotene and total carotenoids enhancing salt stress tolerance in transgenic cultured cells of sweetpotato., 2012, 74: 69–78.
[17] Kim S H, Kim Y H, Ahn Y O, Ahn M J, Jeong J C, Lee H S, Kwak S S. Downregulation of the lycopene ε-cyclase gene increases carotenoid synthesis via the β-branch-specific pathway and enhances salt-stress tolerance in sweetpotato transgenic calli., 2013, 147: 432–442.
[18] Kim S H, Jeong J C, Park S, Bae J Y, Ahn M J, Lee H S, Kwak S S. Down-regulation of sweetpotato lycopene β-cyclase gene enhances tolerance to abiotic stress in transgenic calli., 2014, 41: 8137–8148.
[19] Liu D G, He S Z, Zhai H, Wang L J, Zhao Y, Wang B, Li R J, Liu Q C. Overexpression ofenhances salt tolerance in transgenic sweetpotato., 2014, 117: 1–16.
[20] Liu D G, Wang L J, Liu C L, Song X J, He S Z, Zhai H, Liu Q C. Aniron-sulfur cluster scafold protein gene,, is involved in salt tolerance., 2014, 9: e93935.
[21] Liu D G, Wang L J, Zhai H, Song X J, He S Z, Liu Q C. A novel ɑ/β-hydrolase geneenhances salt tolerance in transgenic sweetpotato., 2014, 9: e115128.
[22] Liu D G, He S Z, Song X J, Zhai H, Liu N, Zhang D D, Ren Z T, Liu Q C., a novel salt-induced methyltransferase gene from, is involved in salt tolerance., 2015, 120: 701–715.
[23] Wang B, Zhai H, He S Z, Zhang H, Ren Z T, Zhang D D, Liu Q C. A vacuolar Na+/H+antiporter gene,, enhances salt and drought tolerance in transgenic sweetpotato., 2016, 201: 153–166.
[24] Wang F B, Tong W J, Zhu H, Kong W L, Peng R H, Liu Q C, Yao Q H. A novel Cys2/His2zinc fnger protein gene from sweetpotato,, is involved in salt and drought tolerance in transgenic., 2016, 243: 783–797.
[25] Wang F B, Zhai H, An Y Y, Si Z Z, He S Z, Liu Q C. Overexpression ofgene enhances salt tolerance in transgenic sweetpotato., 2016, 15: 271–281.
[26] Zhai H, Wang F B, Si Z Z, Huo J X, Xing L, An Y Y, He S Z, Liu Q C. A-inositol-1-phosphate synthase gene,, enhances salt and drought tolerance and stem nematode resistance in transgenic sweet potato., 2016, 14: 592–602.
[27] Li R J, Kang C, Song X J, Yu L, Liu D G, He S Z, Zhai H, Liu Q C. A ζ-carotene desaturase gene,, increases β-carotene and lutein contents and enhances salt tolerance in transgenic sweetpotato., 2017, 262: 39–51.
[28] Kang C, Zhai H, Xue L Y, Zhao N, He S Z, Liu Q C. A lycopene β-cyclase gene,, enhances carotenoid contents and abiotic stress tolerance in transgenic sweetpotato., 2018, 272: 243–254.
[29] Zhang H, Gao X R, Zhi Y H, Li X, Zhang Q, Niu J B, Wang J, Zhai H, Zhao N, Li J G, Liu Q C, He S Z. A non-tandem CCCH-type zinc-finger protein, IbC3H18, functions as a nuclear transcriptional activator and enhances abiotic stress tolerance in sweet potato., 2019, 223: 1918–1936.
[30] 杨元军, 王玉萍, 翟红, 刘庆昌. 甘薯块根总RNA的高效快速提取方法. 分子植物育种, 2008, 6: 193–196. Yang Y J, Wang Y P, Zhai H, Liu Q C. A simple and rapid procedure for RNA isolation from storage roots of sweetpotato ()., 2008, 6: 193–196 (in Chinese with English abstract).
[31] Wang L J, He S Z, Zhai H, Liu D G, Wang Y N, Liu Q C. Molecular cloning and functional characterization of a salt tolerance-associated genefrom sweetpotato., 2013, 12: 27–35.
[32] Jiang T, Zhai H, Wang F B, Zhou H N, Si Z Z, He S Z, Liu Q C. Cloning and characterization of a salt tolerance-associated gene encoding trehalose-6-phosphate synthase in sweetpotato., 2014, 13: 1651–1661.
[33] 喻娜, 郭新勇, 焦天奇, 祝建波. 转小拟南芥基因烟草获得及其抗旱性鉴定. 西北植物学报, 2010, 30: 2385–2393. Yu N, Guo X Y, Jiao T Q, Zhu J B. Transformation ofgene and drought-tolerance identification of transgenic plants in tobacco., 2010, 30: 2385–2393 (in Chinese with English abstract).
[34] Huo J X, Du B, Sun S F, He S Z, Zhao N, Liu Q C, Zhai H. A novel aldo-keto reductase gene,, from sweet potato confers higher tolerance to cadmium stress in tobacco., 2018, 5: 206–213.
[35] Gill S S, Tuteja N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants., 2010, 48: 909–930.
[36] Smirnoff N, Cumbes Q J. Hydroxyl radical scavenging activity of compatible solutes., 1989, 28: 1057–1060.
[37] Bao A K, Wang S M, Wu G Q, Xi J J, Zhang J L, Wang C M. Overexpression of theH+-PPase enhanced resistance to salt and drought stress in transgenic alfalfa (L.)., 2009, 176: 232–240.
[38] Kumar V, Shriram V, Kishor P B K, Jawali N, Shitole M G. Enhanced proline accumulation and salt stress tolerance of transgenicrice by over-expressinggene., 2010, 4: 37–48.
Cloning ofand identification on tolerance to salt and drought stress in sweetpotato
CHEN Shan-Bin, SUN Si-Fan, NIE Nan, DU Bing, HE Shao-Zhen, LIU Qing-Chang, ZHAI Hong*
Key Laboratory of Sweetpotato Biology and Biotechnology, Ministry of Agriculture and Rural Affairs / Laboratory of Crop Heterosis and Utilization, Ministry of Education / Beijing Key Laboratory of Crop Genetic Improvement, China Agricultural University, Beijing 100193, China
(CCR4-associated factor 1)gene plays an important role in plant development and disease resistance. In this study, thegene of sweetpotato was cloned according to the EST sequence. The ORF ofwas 846 bp, encoding 281 amino acids, with a molecular weight of 32.13 kD and an isoelectric point of 4.83. The results of amino acid sequence alignment and phylogenetic tree analysis showed that IbCAF1 had higher homology with ItlCAF1, a homologous protein of(2), and the homology was 96.8%.gene was induced and expressed by NaCl, PEG, ABA, and H2O2. Thegene was transferred into tobacco bymediated transformation. The overexpression ofgene significantly improved the salt and drought tolerance of transgenic tobacco plants. After 200 mmol L-1NaCl and 10% PEG-6000 treatments, the transgenic tobacco plants showed significant upregulation of the genes involved in ROS scavenging system and proline biosynthesis related genes, significant increase of SOD activity, POD activity and proline content and significant decrease of H2O2and malondialdehyde contents. These results demonstrate that thegene could improve salt and drought tolerance in transgenic tobacco. This study will lay a foundation on salt and drought tolerance gene engineering ofgene in sweetpotato for the following research.
sweetpotato;; transgenic tobacco; salt tolerance; drought tolerance
本研究由国家自然科学基金项目(31872878), 国家重点研发计划项目(2018YFD1000700, 2018YFD1000704)和国家现代农业产业技术体系建设专项(CARS-10)资助。
This study was supported by the National Natural Science Foundation of China (31872878), the National Key Research and Development Program of China (2018YFD1000700, 2018YFD1000704), and the China Agriculture Research System (CARS-10).
翟红, E-mail: zhaihong@cau.edu.cn
E-mail: 757015572@qq.com
2020-02-27;
2020-06-02;
2020-07-02.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20200702.1029.002.html
10.3724/SP.J.1006.2020.04045
