基于CaCC的TRPV4调节剂高通量筛选细胞模型的建立
2020-11-26肖云萍解宇浩张嘉琪洪啟元郝峰王国庆
肖云萍,解宇浩,张嘉琪,洪啟元,郝峰*,王国庆
1吉林医药学院检验学院,吉林省吉林市 132013;2北华大学医学技术学院,吉林省吉林市 132013;3吉林医药学院公共卫生学院,吉林省吉林市 132013
瞬时受体电位离子通道(transient receptor potential,TRP)是一种在生物体内分布广泛的非电压依赖的非选择性阳离子通道。TR P家族分为7个亚族:TRPA、TRPC、TRPM、TRPML、TRPN、TRPP及TRPV[1]。瞬时受体电位香草酸亚型4(transient receptor potential vanilloid 4,TRPV4)是TRPV亚家族的成员,广泛分布于心脏、大脑、肾脏、肺脏、肝脏、骨组织及皮肤等[2],参与许多生理、病理过程,可能是多种疾病的潜在治疗靶点。TRPV4调节剂在许多生理和病理过程中起着重要作用,如TRPV4激活剂可以减少动脉粥样硬化斑块的形成,促进成年海马齿回神经干细胞的增殖,以及促进血管和动脉的生成[3-5];TRPV4拮抗剂可治疗水肿、疼痛、胃肠道疾病和肺部疾病,如咳嗽、支气管收缩、肺动脉高压和急性肺损伤等[6]。然而,大多数TRPV4的激活剂和抑制剂存在选择性不强、效力不佳等问题。因此,筛选TRPV4特异性调节剂具有重要意义。TRPV4对Ca2+具有选择通透性,其激活会引起Ca2+内流,从而增加细胞内游离Ca2+的浓度[7]。钙激活氯离子通道蛋白1(anoctamin 1, ANO1)是钙激活氯离子通道(calcium-activated chloride channels,CaCC)的分子基础之一,在细胞内Ca2+浓度升高的作用下开放并向细胞内转运Cl-、I-等阴离子[7]。YFP-H148Q/I152L是遇I-会发生荧光淬灭的黄色荧光蛋白双突变体[8]。因此,本研究利用稳定共转染ANO1和YFP-H148Q/I152L的Fischer大鼠甲状腺滤泡上皮(Fischer rat thyroid,FRT)细胞系构建基于CaCC靶向TRPV4的细胞筛选模型。
1 材料与方法
1.1 实验试剂及仪器 FRT细胞为本实验室保存;ANO1真核表达载体和YFP-H148Q/I152L真核表达载体由本实验室前期构建[9-10]。Lipofectamine 3000脂质体、Zeocin抗生素、G418抗生素、TRIzol试剂盒(美国Invitrogen公司);兔抗大鼠TRPV4多克隆抗体、兔抗大鼠β-actin单克隆抗体、山羊抗兔IgG(英国Abcam公司);RT-PCR试剂盒、全蛋白提取试剂盒、BCA蛋白测定试剂盒、质粒提取试剂盒(北京全式金生物技术有限公司);ECL检测试剂盒(北京索莱宝科技有限公司);F-12基本培养基、Eact、NFA、GSK1016790A、4α-PDD、 RN-1747、GSK2193874、HC-067047、RN-1734、Fura-2/AM(美国Sigma公司);胎牛血清(以色列Biological Industries公司);PCR引物、切胶回收试剂盒(生工生物工程股份有限公司)。倒置荧光显微镜(日本Nikon公司);PCR仪(美国ABI公司);FLUOstar多功能酶标仪(德国BMG公司);CO2培养箱(日本Panasonic公司);凝胶成像仪(美国Bio-Rad公司);Nanodrop 2000微量分光光度计(美国Thermo Fisher公司)。
1.2 RT-PCR检测FRT细胞中TRPV4 mRNA的表达 取生长状态良好的FRT细胞株,按照TRIzol试剂盒说明书提取总RNA,应用Nanodrop 2000检测总RNA的浓度,测定RNA溶液A260/A280的比值范围。对提取的RNA进行琼脂糖凝胶电泳,检测总RNA的完整性。
本研究设计合成了8对特异性引物:TRPV1~ TRPV6和β-actin,其中TRPV4设计了2对引物:TRPV4-1和TRPV4-2。TRPV4-1、TRPV4-2及管家基因β-actin的引物序列如表1所示。按照2×EasyTaq PCR SuperMix试剂盒说明书进行PCR扩增,将所得PCR产物进行琼脂糖凝胶电泳,利用凝胶成像仪曝光成像。将目的条带切下,采用切胶回收试剂盒对目的条带进行切胶回收,回收后的DNA溶液进行核酸测序。
1.3 Western blotting检测FRT细胞中TRPV4蛋白的表达 取生长状态良好的FRT细胞,经RIPA裂解液裂解,提取总蛋白。采用SDS-PAGE凝胶电泳分离蛋白,转膜、封闭后分别孵育兔抗大鼠TRPV4多克隆抗体(1:2000)、兔抗大鼠β-actin单克隆抗体(作为内参),4 ℃下孵育过夜。次日,PBST洗膜,室温孵育HRP标记的山羊抗兔IgG(1:500)2h,PBST洗膜,采用ECL化学发光法显色,暗室显影技术采集化学发光图像。

表1 TRPV4-1、TRPV4-2及β-actin引物序列Tab.1 Primer sequence of TRPV4-1, TRPV4-2 and β-actin
1.4 构建共表达ANO1和YFP-H148Q/I152L的FRT细胞模型
1.4.1 最适抗生素浓度的选择 取生长状态良好的FRT细胞,分别加入浓度为1500、1000、800、600、400、200、100 μg/ml的Zeocin抗生素,培养2周后细胞全部死亡的最低浓度为Zeocin抗生素筛选的最适浓度。同理筛选G418抗生素的最适浓度。
1.4.2 脂质体转染法构建共表达ANO1和YFPH148Q/I152L的细胞株 取生长状态良好的FRT细胞,按照Lipofectamine 3000说明书步骤将ANO1转染到FRT细胞中,2 d后于倒置荧光显微镜下观察。利用最适浓度的Zeocin抗生素进行筛选,3周后挑取倒置荧光显微镜下可见细胞膜上表达绿色荧光的细胞进行有限稀释。经过多次有限稀释得到稳定转染ANO1的单克隆细胞并进行扩大培养,获得表达ANO1的FRT细胞株。同理,将YFP-H148Q/I152L转染到已稳定表达ANO1的FRT细胞中,应用最适浓度的G418抗生素进行筛选,挑取倒置荧光显微镜下细胞膜上和细胞质中均可见绿色荧光的单细胞克隆团,扩大培养后获得共表达ANO1和YFP-H148Q/I152L的FRT细胞株。
1.5 荧光淬灭动力学实验验证FRT细胞模型的有效性及功能
1.5.1 有效性验证 取生长状态良好的共表达ANO1和YFP-H148Q/I152L的FRT细胞,分为实验组和对照组,每组3个复孔。实验组加入120 μl含有ANO1特异性激活剂Eact(10 μmol/L)及高浓度碘离子的PBS溶液,对照组加入钙激活氯离子通道抑制剂NFA(300 μmol/L)孵育10 min,再加入120 μl含高浓度碘离子的PBS溶液,采用FLUOstar多功能酶标仪(发射波长540 nm,激发波长500 nm)检测相对荧光强度(RFU)的动态变化。以5个点/s的速度动态检测RFU,其中前2 s为基线,2 s后以200 μl/s的速度向实验组孔中加入120 μl含有Eact及高浓度碘离子的PBS溶液,向对照组孔中加入120 μl含高浓度碘离子的PBS溶液。
1.5.2 功能验证 将生长状态良好的共表达ANO1和YFP-H148Q/I152L的FRT细胞分为4组,每组3个复孔。其中3组加入含TRPV4激活剂GSK1016790A、4α-PDD、RN-1747及高浓度碘离子的PBS溶液,另外1组加入含TRPV4抑制剂HC-067047孵育10 min,再加入含高浓度碘离子的PBS溶液,采用FLUOstar多功能酶标仪检测RFU的动态变化,利用Excel软件对原始数据进行宏计算,得到斜率(Slope)值。
将生长状态良好的共表达ANO1和YFP-H148Q/I152L的FRT细胞分为6组,采用倍比稀释法获得不同浓度的激活剂和抑制剂。其中3组分别加入不同浓度的TRPV4激活剂GSK1016790A、4α-PDD、RN-1747,采用多功能酶标仪进行检测,加入含高浓度碘离子的PBS溶液,记录RFU的动态变化,计算Slope值。另外3组加入不同浓度的TRPV4抑制剂GSK2193874、HC-067047、RN-1734孵育10 min,采用多功能酶标仪进行检测,加入含有GSK1016790A及高浓度碘离子的PBS溶液,记录RFU的动态变化,计算Slope值。
1.6 Fura-2荧光探针法检测FRT细胞模型中Ca2+的浓度 将稳定共表达ANO1和YFP-H148Q/I152L的FRT细胞制成细胞悬液,加入Fura-2/AM,终浓度为5 μmol/L,37 ℃下孵育30 min。洗涤细胞,离心后制成细胞悬液。采用FLUOstar多功能酶标仪(激发波长为340 nm和380 nm,发射波长510 nm)检测,记录静息时和加入不同浓度GSK1016790A后340 nm/380 nm的荧光比值。加入Triton X-100及EGTA,测定最大荧光比值和最小荧光比值,计算Ca2+浓度。
1.7 FRT细胞模型的Z'因子评估 Z'因子是评估高通量筛选的一种重要指标,计算公式如下:Z'=1-3×(|SDpositive|+|SDnegtive|)/(|Meanpositive|-|Meannegative|)[11]。将96孔板中的6列加入10 μmol/L GSK1016790A作为阳性对照(positive),另外6列加入PBS溶液作为阴性对照(negative),检测96孔板的Z'因子值。
1.8 统计学处理 采用GraphPad Prism 8.0软件对激活剂和抑制剂的剂量依赖关系进行非线性曲线拟合分析,绘制模型对不同激活剂和抑制剂的浓度依赖曲线,并计算半数有效浓度(EC50)、半数抑制浓度(IC50),统计分析采用单因素方差分析和Mann-Whitney检验,所有实验均重复3次。P<0.05为差异有统计学意义。
2 结 果
2.1 FRT细胞中TRPV4 mRNA的表达情况 FRT细胞总RNA浓度为413.2 ng/μl,总RNA溶液的A260/A280为1.83。琼脂糖凝胶电泳结果显示,总RNA完整性良好,可用于进一步cDNA的合成(图1A)。RT-PCR检测结果显示,TRPV4-1、TRPV4-2和β-actin分别在395 bp、455 bp和260 bp处出现特异性条带,与预期的目的产物大小一致(图1B)。TRPV1、TRPV2、TRPV3、TRPV5、TRPV6特异性引物均未扩增出 条带。
将TRPV4条带的切胶回收产物送生工生物工程股份有限公司测序,测序结果在Chromas软件上进行分析,峰图结果如图1C所示,无重叠峰,其中竖线位置为内含子。所测核苷酸序列采用美国生物技术信息中心(national center for biotechnology informatio,NCBI)的序列比对工具(basic local alignment search tool,BLAST)进行比对,结果显示其与GenBank数据库收录的TRPV4基因序列相似性为100%,表明所克隆的DNA片段即为目的基因片段,FRT细胞在mRNA水平上内源性表达TRPV4 (图1D)。
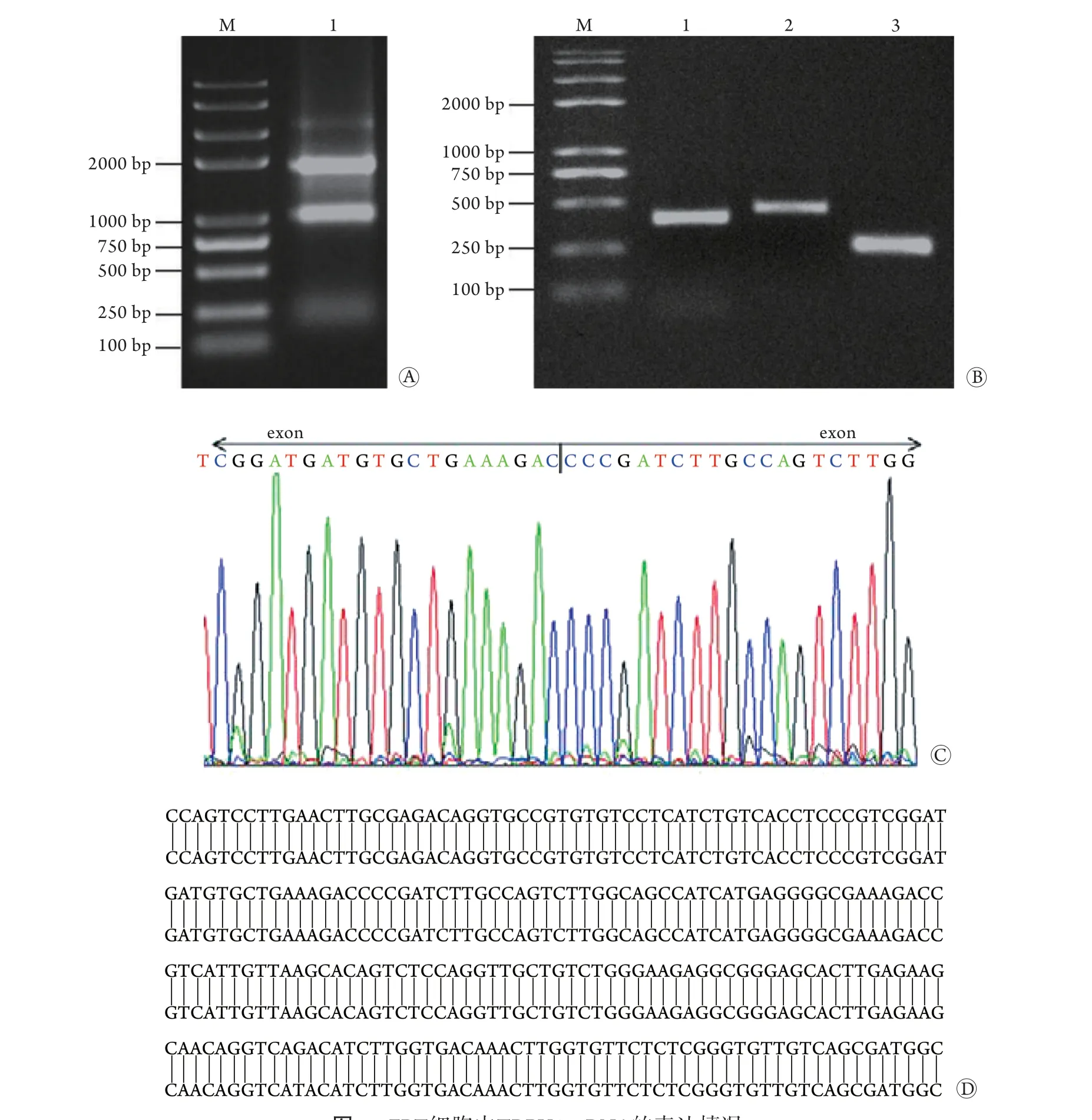
图1 FRT细胞中TRPV4 mRNA的表达情况Fig.1 Expression of TRPV4 mRNA in FRT cells
2.2 FRT细胞中TRPV4蛋白的表达情况 Western blotting检测结果显示,FRT细胞中有相对分子量为98 kD的TRPV4蛋白的表达(图2),表明FRT细胞在蛋白水平上内源性表达TRPV4蛋白。
2.3 共表达ANO1和YFP-H148Q/I152L的FRT细胞模型构建原理及结果 当TRPV4通道被激活时,Ca2+内流增加细胞内Ca2+浓度,从而引起CaCC的开放,细胞外I-被转运到细胞质内,使黄色荧光蛋白YFP-H148Q/I152L发生荧光淬灭,测定原理如图3所示。

图2 FRT细胞中TRPV4蛋白的表达情况(Western blotting)Fig. 2 Expression of TRPV4 protein in FRT cells (Western blotting)
Zeocin、G418抗生素筛选的最适浓度均为1000 μg/ml。倒置荧光显微镜下清晰可见,FRT细胞膜上呈绿色荧光,表明ANO1表达在细胞膜上(图4A);FRT细胞质中和细胞膜上均可见绿色荧光,表明YFP-H148Q/I152L表达在细胞质中(图4B)。即成功构建了稳定共表达ANO1和YFP-H148Q/I152L的FRT细胞株。
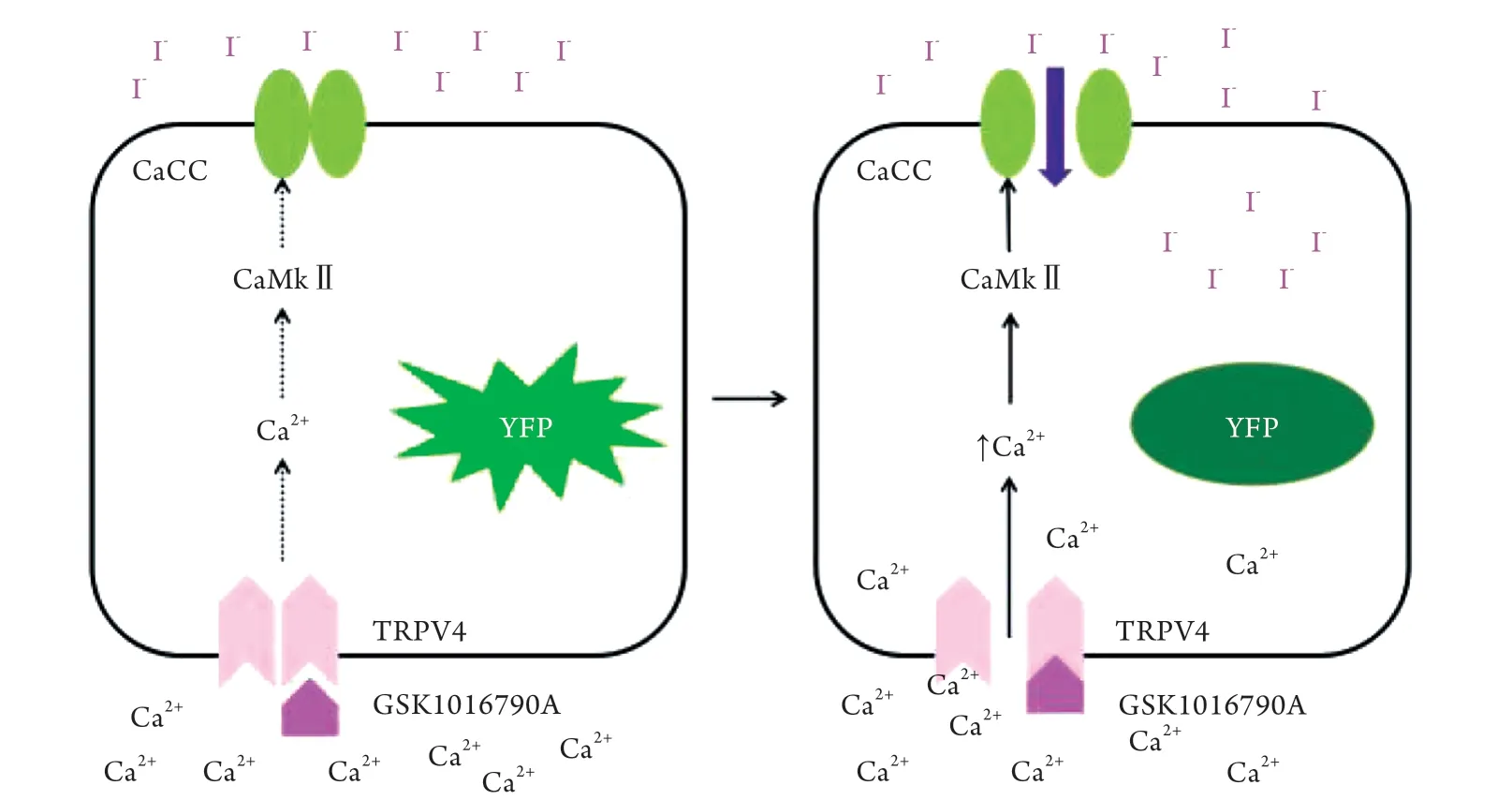
图3 基于CaCC靶向TRPV4的细胞筛选模型构建原理Fig. 3 Construction principle of the screening cell model targeting TRPV4 based on CaCC

图4 共表达ANO1和YFP-H148Q/I152L细胞模型的构建结果(×40)Fig.4 Construction of ANO1 and YFP-H148Q/I152L co-expression cell model (×40)
酶标仪检测结果显示,实验组R F U明显下降,表明ANO1开放,I-内流,黄色荧光蛋白发生淬灭;对照组RFU无明显变化,表明NFA抑制了ANO1的开放,如图4C所示。该结果表明细胞模型构建成功。
2.4 共表达ANO1和YFP-H148Q/I152L的FRT细胞模型的功能验证 加入TRPV4激活剂GSK1016790A、4α-PDD、RN-1747后,荧光迅速淬灭。而加入TRPV4抑制剂HC-067047后,荧光未淬灭(图5A)。加入激活剂组荧光Slope值明显高于加入抑制剂组,各激活剂组与抑制剂组差异有统计学意义(P<0.001,图5B),表明模型具有筛选TRPV4调节剂的功能。
在加入不同浓度的TRP V4激活剂和抑制剂后,荧光信号呈现不同的变化。激活剂和抑制剂的浓度与荧光Slope值呈现剂量-效应依赖关系。采用GraphPad Prism 8.0软件进行非线性曲线拟合分析,浓度取对数作图,得到浓度效应曲线:GSK1016790A、4α-PDD、RN-1747的EC50分别为9.17、50.06、147.50 μmol/L(图6A),GSK2193874、HC-067047、RN-1734的IC50分别为5.74、10.91、72.49 μmol/L(图6B)。该结果表明激活剂和抑制剂对TRPV4通道的作用具有浓度依赖性,证实了该模型可用于TRPV4调节剂的筛选。

图5 FRT细胞模型筛选TRPV4调节剂的功能鉴定(n=3)Fig.5 Functional identification of FRT cell model screening TRPV4 modulator (n=3)
2.5 共表达ANO1和YFP-H148Q/I152L的FRT细胞中Ca2+浓度的变化情况 加入不同浓度的GSK1016790A后,GSK1016790A浓度越高,RFU下降的幅度越大,荧光Slope值越大,如图7A所示,荧光Slope值与GSK1016790A浓度呈剂量依赖关系。同时细胞内Ca2+浓度瞬时升高,随着GSK1016790A浓度的升高,细胞质内Ca2+浓度随之升高,Ca2+浓度与GSK1016790A浓度呈剂量依赖关系(7B);荧光Slope值随着细胞质内Ca2+浓度增加而增大,Ca2+浓度越大,荧光Slope值越大,如图7C所示,FRT细胞模型荧光淬灭Slope值与细胞内Ca2+浓度呈正相关。
2.6 共表达ANO1和YFP-H148Q/I152L的FRT细胞模型的Z'因子评估 结果显示,SDpositive值为5.06,SDnegtive值为1.57,Meanpositive值为78.2,Meannegative值为5.07,根据公式计算得到Z'因子为0.728(图8)。一般认为当Z'因子>0.5时,该高通量方法比较理想,因此建立的细胞模型适用于TRPV4调节剂的高通量筛选。

图6 TRPV4激活剂及抑制剂的剂量依赖曲线(n=3)Fig.6 Dose-dependent curves of TRPV4 activators and inhibitors (n=3)
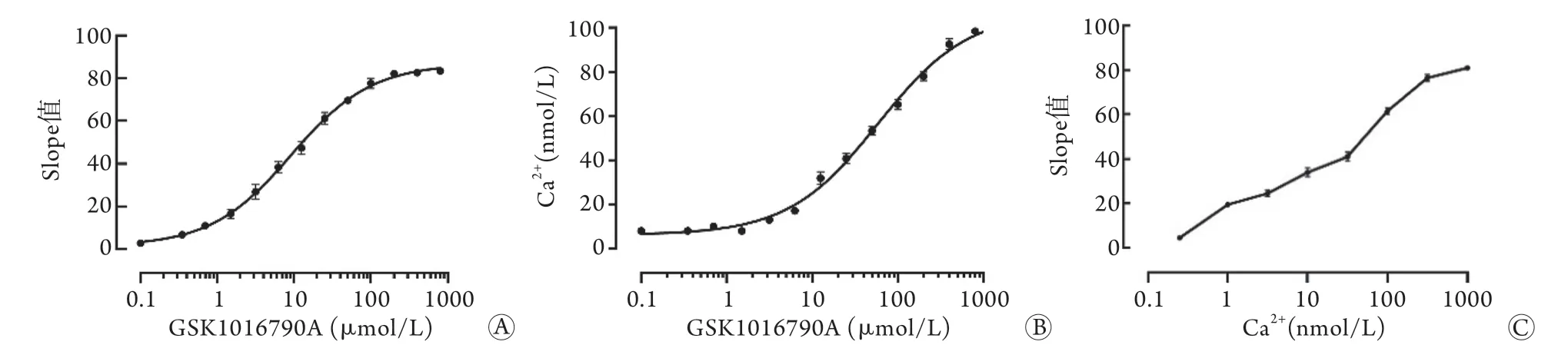
图7 荧光Slope值与细胞内Ca2+浓度的关系(n=3)Fig.7 Relationship between fluorescence slope value and intracellular Ca2+ concentration (n=3)
3 讨 论
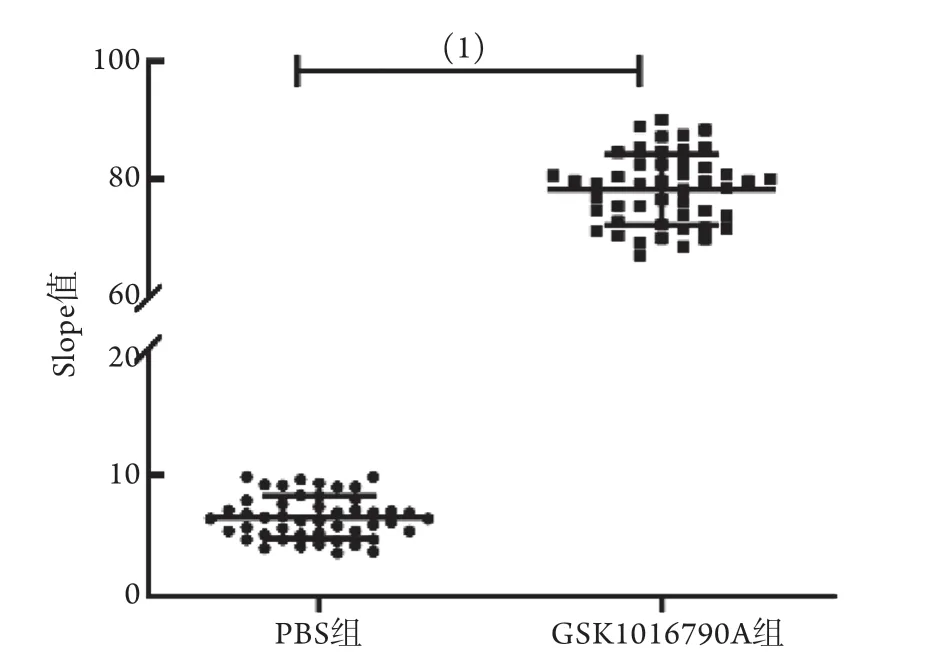
图8 共表达ANO1和YFP-H148Q/I152L的FRT细胞模型的Z'因子评估(n=48)Fig.8 Assessment of Z' factor in FRT cell model that coexpression of ANO1 and YFP-H148Q/I152L (n=48)
近年来,随着药物研发技术的迅速发展,离子通道作为重要的药物靶点而备受关注[12-13]。 TRPV4作为离子通道之一,广泛分布在消化、神经、呼吸和心脑血管等系统[2],可被温度、机械刺激、渗透压等因素激活,引起Ca2+的流动,通过对Ca2+和细胞内信号转导通路的调控,影响细胞的增殖、分化、迁移和凋亡等,进而在疾病的发生发展过程中发挥重要作用[14]。研究表明,TRPV4调节剂与动脉粥样硬化、纤维化、疼痛、炎症、肿瘤等密切相关[3,6,15-17]。但目前已发现的TRPV4调节剂均存在选择性不佳等问题,且尚无高通量筛选TRPV4调节剂的方法,因此研究筛选TRPV4调节剂的方法具有重要意义。
目前,筛选离子通道调节剂的方法主要有电生理技术和荧光染料法等,前者因具有直接、灵敏的优点而被公认为离子通道功能检测的“金标准”[18],但其操作繁琐、成本昂贵,对操作人员技术要求高,不适用于高通量药物筛选。而荧光染料如Fluo-3、Fluo-4等[19]与Ca2+结合后,染料荧光强度增强,能够直观、实时检测细胞内Ca2+浓度的变化,但操作复杂,试剂费用高,实验周期长,限制了TRPV4调节剂的高通量筛选。
常用的筛选离子通道调节剂的方法大多不适用于TRPV4大量化合物库的高通量筛选。因此,本研究建立了一种基于CaCC的高通量筛选TRPV4调节剂的方法,利用TRPV4可以升高细胞内Ca2+浓度进而开放CaCC,细胞外I-转运至细胞内,胞内黄色荧光蛋白YFP-H148Q/I152L的荧光发生淬灭的原理,检测荧光信号可实现对TRPV4调节剂的高通量筛选。FRT细胞具有贴壁紧、胰酶不易消化、生长速度适中、较CHO和COS-7等细胞更易使膜蛋白表达的特点,常用于研究氯离子通道及其调节剂的高通量筛选[20],因此本研究选择FRT细胞系作为目的细胞进行建模。利用荧光倒置显微镜观察共表达ANO1和YFP-H148Q/I152L的FRT细胞株,ANO1表达在细胞膜上,YFP-H148Q/I152L表达在细胞质内,若表达位置错误,FRT细胞将无法转运细胞外I-且不具备荧光淬灭的生物学功能,通过荧光淬灭动力学实验进一步验证了ANO1表达在细胞膜上而非细胞外,证实了ANO1定位和功能的准确性。同时,本模型可敏感检测细胞内Ca2+的浓度,用荧光Slope值表征细胞内Ca2+浓度,比Fura-2法具有更大的信号窗口且可以更直观地反映细胞内Ca2+浓度的变化情况。本模型经反复传代至30代以上,依然保持其稳定性,且Z'因子为0.728,能满足高通量筛选的要求。
本模型只是TRPV4调节剂的初筛方法,尚存在一系列不足。本模型在用于TRPV4激活剂的筛选时,可能会筛选出CaCC通道或其他内源性Ca2+通道的激活剂,筛选之后还需要通过后续实验区分出假阳性结果,可应用不同激活剂和抑制剂组合在一定程度上区分结果的真伪,而用于抑制剂筛选时则没有此问题。由于本模型内源性表达TRPV4,并不表达TRPV通道的其他蛋白,说明本研究筛选的激活剂和抑制剂均作用于TRPV4,但对于筛选的激活剂和抑制剂是否作用于TRPV通道的其他蛋白仍需后续实验进一步验证。
综上所述,本模型是高通量筛选TRPV4调节剂的新方法,可以快速敏感地检测细胞内钙信号的变化,实现对TRPV4调节剂的高通量筛选,具有筛选周期短、操作简便、成本低的优点,为进一步研究和开发TRPV4新型药物提供了初筛方法,还为其他离子通道调节剂的筛选提供了新思路,具有相当广阔的应用前景。
