新型冠状病毒肺炎重症化的高危因素分析
2020-11-26徐静谭林李莎莎王春艳高学武王金玲李风成姜宁纪冬
徐静,谭林,李莎莎,王春艳,高学武,王金玲,李风成,姜宁,纪冬*
1安徽省阜阳市第二人民医院肝脏病科二病区,安徽阜阳 236000,2解放军总医院第五医学中心肝硬化诊疗二中心,北京 100039
新型冠状病毒肺炎(coronavirus disease-2019,COVID-19)的特点为传播快、人群普遍易感,临床主要表现为发热、干咳和乏力,重症患者多出现呼吸困难和(或)低氧血症[1]。重症患者的救治占用大量的医疗资源,花费高额的经济费用,且往往治疗效果不佳。Guan等[2]报道,进入ICU治疗的COVID-19重症患者,其28d病死率高达61.5%[2]。因此,避免轻症向重症发展对COVID-19患者的救治至关重要[3]。既往相关研究描述了COVID-19患者的流行病学特点、临床表现和临床结局,多是对未明确预后结果的患者进行的研究[4-6]。本研究探讨了COVID-19患者病情重症化的高危因素,以期指导临床早期发现重症病例、早期治疗,为COVID-19的精准诊疗提供依据。
1 资料与方法
1.1 研究对象 回顾性分析安徽阜阳市第二人民医院2020年1月20日-2月13日收治的COVID-19确诊患者的临床资料。纳入标准:新型冠状病毒核酸检测两次阳性;住院时间长于1周,且临床资料完整。本研究获阜阳市第二人民医院伦理委员会批准(202000303006),因突发重大公共卫生事件豁免知情同意。
1.2 诊断标准 COVID-19确诊标准为呼吸道标本实时荧光RT-PCR检测新型冠状病毒核酸阳性;患者病情严重程度分级标准参考国家卫生健康委员会发布的《新型冠状病毒肺炎诊疗方案(试行第六版)》,分为轻型、普通型、重型和危重型[7]。所有患者按照病情进展与否分为稳定组和重症化组;疾病进展定义为出现症状2周内从普通型进展至重型或重型进展至危重型。基础疾病定义为至少有一种疾病(高血压、糖尿病、心脑血管疾病、慢性呼吸系统疾病、慢性乙肝、贫血或肿瘤)且病程半年以上。出院标准为体温恢复正常3 d以上、呼吸道症状明显好转、肺部影像学显示急性渗出性病变明显改善、连续两次呼吸道病原核酸检测阴性(采样时间间隔至少1 d)。
1.3 数据来源 收集患者的临床电子病历、护理记录、实验室检查和放射学检查结果。收集患者年龄、性别、吸烟、饮酒、基础疾病(高血压、糖尿病、心脑血管疾病、慢性呼吸系统疾病、贫血或肿瘤)、流行病学史、入院时的生命体征(心率、呼吸频率)、入院时的临床分型(轻型、普通型、重型、危重型)、入院时的化验值[淋巴细胞绝对值、乳酸脱氢酶(lactate dehydrogenase,LDH)、谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、总胆红素(total bilirubin,TBIL)、碱性磷酸酶(alkaline phosphatase,ALP)、γ-谷氨酰转肽酶(γ-glutamyl transpeptidase,GGT)、肌酐(creatinine,Cr)、降钙素原(procalcitonin,PCT)]。采用中国食品药品监督管理局批准的实时RT-PCR方法,对呼吸道标本(包括鼻咽拭子或痰)进行新型冠状病毒核酸、流感、副流感病毒检测。所有患者均行胸部CT检查。观察期截至2020年3月4日。
1.4 统计学处理 采用GraphPad Prism 8.0软件进行统计分析。符合正态分布的计量资料以表示,两组间比较采用Studentt检验;不符合正态分布的计量资料以M(P25,P75)表示,两组间比较采用Mann-Whitney检验;多组间比较采用方差分析,进一步两两比较采用Tukey's多重比较检验。计数资料采用χ2检验或Fisher精确概率法分析。均采用双侧检验。高危因素采用多因素COX比例风险回归模型进行分析。P<0.05为差异有统计学意义。
2 结 果
2.1 基线特征及单因素分析 共纳入148例患者,入院时9例(6.1%)为重型,139例(93.9%)为普通型,其中5例临床资料缺失,予以排除。最终纳入143例患者,年龄43.5(32.7,52.4)岁,81例(56.6%)为男性,28例(19.6%)存在基础疾病,入院时最常见的症状为发热[119(83.2%)],其次为干咳[(77(53.8%)]。按出现症状2周内是否从普通型进展至重型或重型进展至危重型分为稳定组(n=122)和重症化组(n=21),比较两组患者各项临床指标的差异,结果显示,重症化组患者年龄更高(55.1岁),合并基础疾病的比例更高(57.1%),淋巴细胞绝对值更低(0.7×109/L),AST更高[29.0 U/L, 但处于正常范围(15.0~40.0 U/L)],LDH值更高(322.0 U/L),差异均有统计学意义(P<0.05)。进一步将上述有差异的定量指标进行分层发现,重症化组年龄>60岁(占46.6%)、淋巴细胞绝对值<1.0×109/L (占81.0%)、LDH>250.0 U/L(占81.0%)的患者所占比例更高(P≤0.001);两组患者的AST均在正常范围,取总体患者的中位数26.0 U/L作为分层依据,两组AST>26.0 U/L的患者占比差异无统计学意义(P=0.285)。两组性别比例及ALT、ALP、GGT、Cr水平差异均无统计学意义(P>0.05,表1)。
2.2 两组患者淋巴细胞绝对值和LDH的动态变化分析 进一步分析稳定组患者入院时、入院4~6 d复查时(因重症化组患者病情进展的时间中位数为3.95 d,故对应的稳定组患者选取入院4~6 d的指标作为复查对照组)、出院时,以及重症化组入院时、病情进展时、出院时淋巴细胞绝对值和LDH的动态变化,结果显示,稳定组患者入院、复查及出院时淋巴细胞绝对值均>1.0×109/L,但在住院期间持续上升(组间比较P<0.001);重症化组患者入院时淋巴细胞绝对值<1.0×109/L,病情进展时较入院时明显降低(P=0.035),出院时恢复至1.0×109/L以上(P<0.001)。稳定组患者入院时LDH为233.5 U/L,未超过正常上限250.0 U/L,经治疗后持续下降(P<0.001);重症化组患者入院时LDH为322.0 U/L,病情进展时(355.0 U/L)较入院时未下降,甚至有所上升(P=0.114),经治疗至出院时明显下降(P<0.001,图1)。
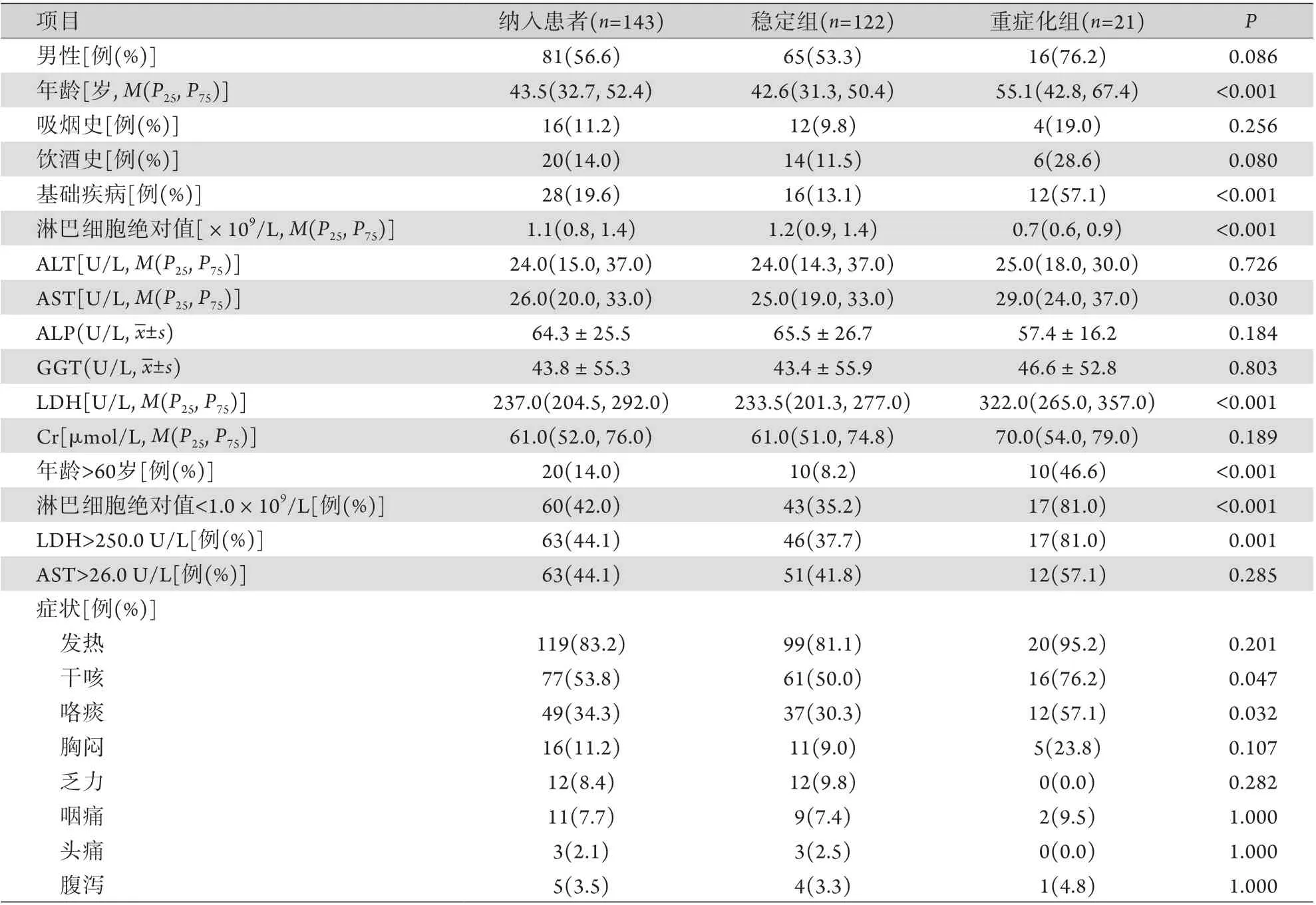
表1 两组COVID-19患者入院时各项临床指标比较Tab.1 Comparison of clinical indexes of COVID-19 patients on admission
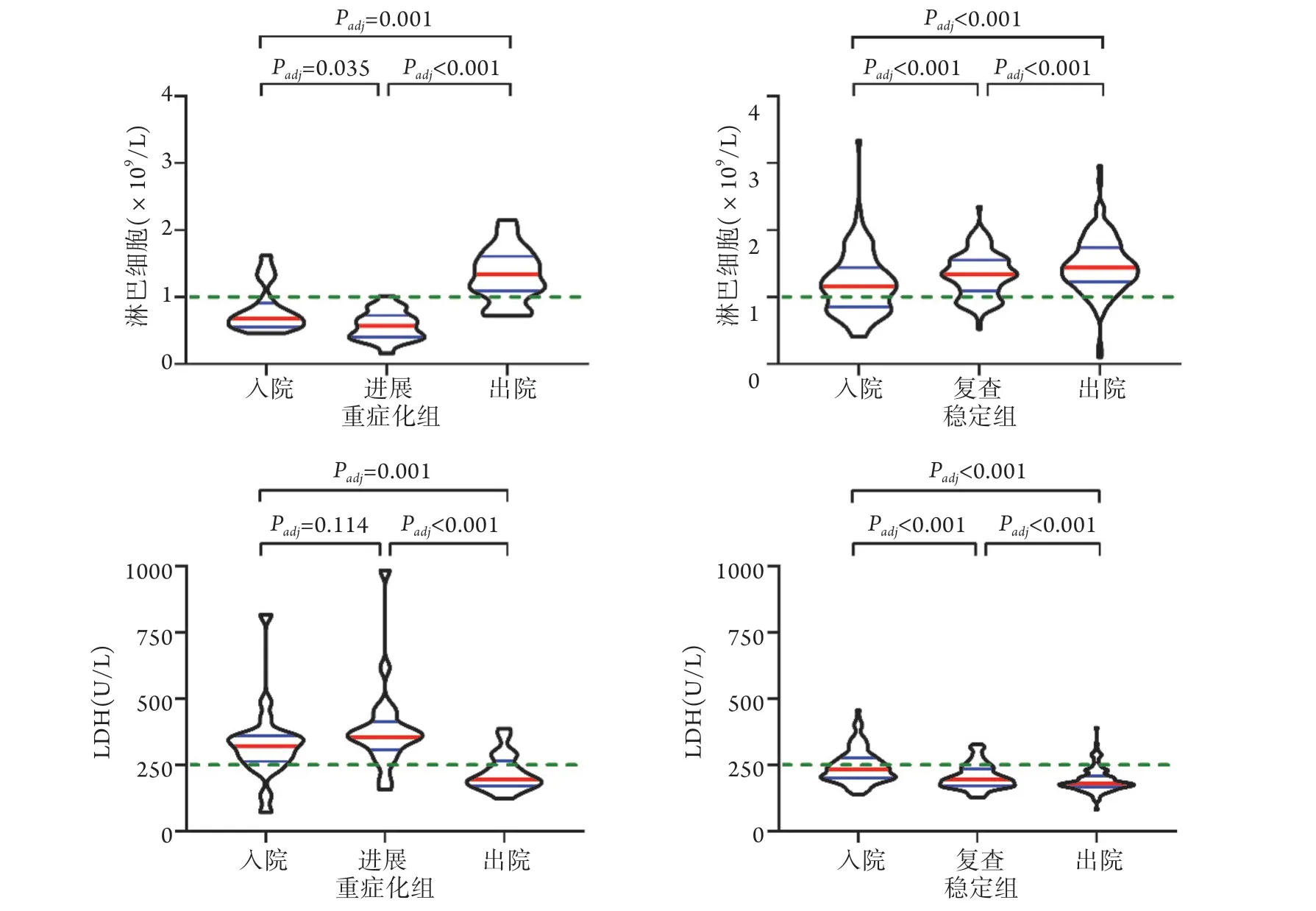
图1 两组COVID-19患者淋巴细胞绝对值及LDH的动态变化Fig.1 Dynamic changes of lymphocyte absolute value and LDH in patients in stable group and severe group
2.3 COVID-19患者病情重症化高危因素的多因素分析 将上述有差异的因素(干咳、咯痰、年龄、基础疾病、AST、LDH、淋巴细胞绝对值)纳入多因素COX比例风险回归模型,结果显示,在治疗基线时年龄60>岁(HR=3.5,95% CI 1.4~9.0)、合并基础疾病(HR=3.9,95% CI 1.5~10.4)、LDH>250.0 U/L (HR=4.1,95% CI 1.4~12.6)、淋巴细胞绝对值<1.0×109/L(HR=6.8,95% CI 2.3~20.7)为COVID-19患者重症化的高危因素(图2)。
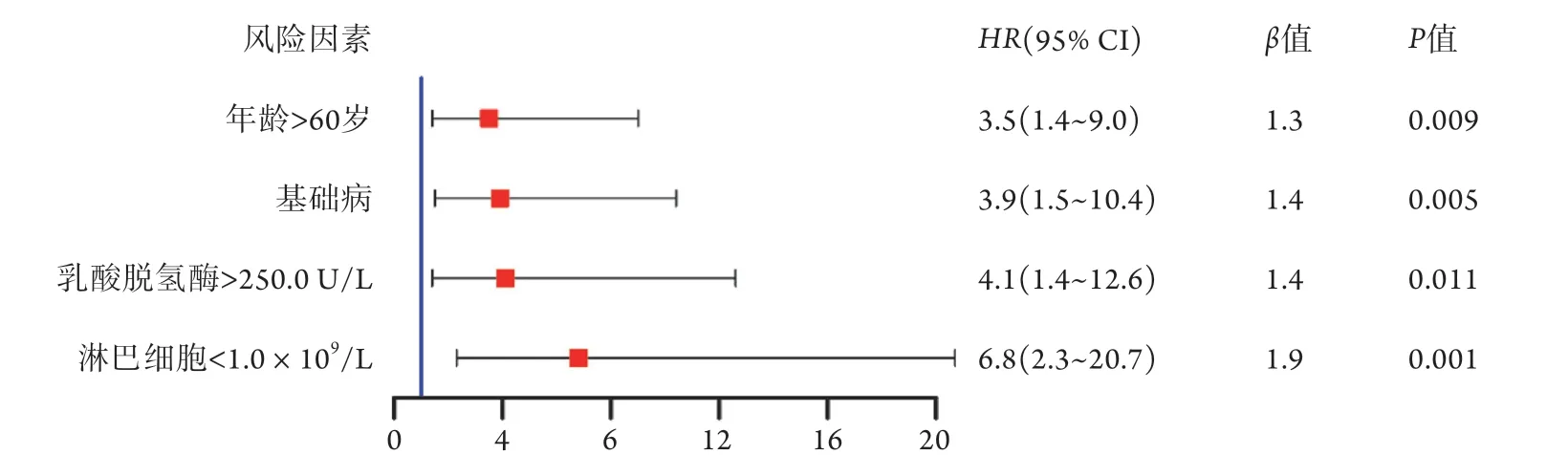
图2 143例COVID-19患者病情重症化高危因素的多因素分析Fig.2 Multivariate analysis of high risk factors associated with severity of COVID-19 patients
3 讨 论
新型冠状病毒(SARS-CoV-2)感染后的临床表现与非典冠状病毒(SARS-CoV)感染极为相似,疾病进展快,容易重症化,重症化患者易出现急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)。Huang等[4]的研究显示,41例COVID-19患者中,13例(31.7%)进展至重症且入住ICU治疗,6例(14.6%)死亡。Guan等[2]的研究纳入了1099例COVID-19患者,其中重症患者173例(15.7%)。Yang等[8]调查了201例COVID-19患者,其中重症患者55例(27.4%)。Zhou等[9]的研究显示,COVID-19重症患者的病死率为28.3%。由此可见,COVID-19患者重症化比例及病死率均较高。早期发现COVID-19重症化的高危因素并重点监测,有利于更早发现易于进展至重症的轻型患者,可对其实施精准治疗,从而降低病死率。本研究结果显示,年龄>60岁、合并基础疾病、淋巴细胞绝对值<1.0×109/L及LDH>250.0 U/L为COVID-19重症化的高危因素。
已有研究发现,高龄是SARS-CoV和中东呼吸综合征病毒(MERS-CoV)感染患者死亡的重要的独立预测因素[10-12],且高龄与COVID-19患者死亡有关[9]。 本研究发现,重症化组患者年龄更大,合并基础疾病者更多。Guan等[2]发现,COVID-19重症患者年龄大于非重症患者,且基础疾病在重症患者中更为常见(38.2%vs.22.5%,P<0.001)。Yang等[8]发现,与COVID-19幸存者相比,死亡患者年龄更大(64.6岁vs.51.9岁),合并慢性疾病者更多(53%vs.20%)。de Wit等[13]发现,老年人(>65岁)感染冠状病毒后更易患ARDS,且病情更重。对接种SARS-CoV的猕猴进行研究发现,老年猕猴对病毒感染的宿主固有反应比年轻猕猴更强,与炎症相关的基因差异表达增加,而Ⅰ型干扰素-β的表达减少[14];T细胞和B细胞功能的年龄依赖性缺陷以及2型细胞因子的过量产生可能引起病毒复制失控和更持久的促炎反应,从而导致不良结局[15],这可能是高龄患者更易进展至重症的原因。此外,宿主的免疫状态也是影响病情轻重的重要因素之一。老年人及合并基础疾病者的免疫功能低下,容易合并各种感染,病情更易进展至重症[5]。
本研究中80%以上的重症化患者出现淋巴细胞绝对值降低,且淋巴细胞绝对值随着疾病恢复而回升。淋巴细胞计数减少是SARS-CoV感染的危重患者的一个显著特征,因为SARS-CoV病毒颗粒的靶向侵袭破坏了淋巴细胞的细胞质成分并导致其破坏[16]。此外,淋巴细胞计数减少在MERS-CoV感染的危重患者中较常见,与淋巴细胞凋亡有关[17-18]。Zhou等[9]发现,76%的COVID-19死亡患者出现淋巴细胞明显下降,且此比例明显高于幸存者(26%)。与本研究结果一致。以往多个报道均指出与非重症患者相比,重症COVID-19患者有更显著的淋巴细胞计数减少[2,4-5]。Chan等[19]指出淋巴细胞减少是COVID-19患者的一个共同特征,且可能是与病情严重程度和病死率相关的一个关键因素。由此推测,SRAS-CoV-2感染的重症化患者淋巴细胞减少亦可能是淋巴细胞坏死或凋亡所致,淋巴细胞计数减少的严重程度反映了SRAS-CoV-2感染的严重程度。
LDH是一种糖酵解酶,广泛存在于机体的各种组织中,以心肌最为丰富,其次为肝脏、肺脏等。已有研究表明血清LDH水平升高与病毒性肺炎有密切关系[20-21]。本研究结果显示,重症化组患者LDH水平明显升高,在病情进展时较入院时升高,出院时下降,呈现动态变化。Zhou等[9]发现,在整个临床过程中,与存活者相比,死亡患者的LDH水平明显升高,并且随着病情加重而升高,随着病情好转而逐渐降低,与本研究结果一致。Guan等[2]的研究得出了相同的结论。目前有限的COVID-19患者尸检病理组织学检查显示,心脏组织有少量间质单核细胞炎性浸润[22]。此外,SRAS-CoV-2的受体血管紧张素转换酶2 (ACE2)在心肌细胞和血管内皮细胞上呈高表达,因此理论上存在病毒直接累及心脏的可能性[23],这也可能是LDH升高的主要原因,且病毒对肺组织的破坏亦有导致LDH升高的可能,而随着病情好转,病毒对各组织的破坏力下降,LDH逐渐下降。
既往多数研究为单因素研究,本研究采用考虑时间因素的多因素COX回归分析,可动态反映各指标的变化,结果更为可靠。本研究也存在一定的局限性。首先,样本量较小,有必要纳入其他中心及更多患者验证上述结果。其次,本研究为回顾性研究,需要前瞻性研究进一步证实上述结果的可靠性。
综上所述,本研究结果表明,年龄>60岁、合并基础疾病、淋巴细胞绝对值<1.0×109/L及LDH >250.0 U/L为COVID-19病情进展的高危因素。在目前全球冠状病毒疫情大流行的形势下,对上述高危因素进行密切监测,早期发现有重症化趋势的病例,早期采取措施遏制病情进展,可以有针对性地制定个体化治疗方案,缓解医疗资源紧缺的压力,降低病死率。
