新型冠状病毒肺炎药物预防、诊断、治疗与出院管理循证临床 实践指南(更新版)
2020-11-26靳英辉詹庆元彭志勇任学群尹训涛蔡林袁玉峰岳冀蓉0张笑春4杨启文3纪建光4夏剑李一荣4周福祥高亚东余追8徐峰9涂明利谭力铭2杨旻陈芳张晓菊曾玫朱渝2刘新灿2杨简赵东赤丁玉峰侯宁3汪付兵陈昊张永刚033李玮陈文施月仙3杨秀芝3王学军钟燕军赵明娟李柄辉40马琳璐訾豪王娜42王云云余绍福李路遥黄桥翁鸿40任相颖42罗丽莎范曼如黄笛薛竑飏余临心高锦萍43邓通曾宪涛李宏军程真顺姚晓梅4王
靳英辉,詹庆元,彭志勇,任学群,尹训涛,蔡林,袁玉峰,岳冀蓉0,,张笑春4,2,杨启文3,纪建光4,夏剑,李一荣4,,周福祥,高亚东,余追8,徐峰9,涂明利,谭力铭2,杨旻,陈芳,张晓菊,曾玫,朱渝2,刘新灿2,杨简,赵东赤,丁玉峰,侯宁3,汪付兵,陈昊,张永刚0,33, 李玮,陈文,施月仙3,杨秀芝3,王学军,钟燕军,赵明娟,李柄辉,,40,马琳璐,4,訾豪,,王娜,42, 王云云,余绍福,2,李路遥,,黄桥,翁鸿,40,任相颖,,42,罗丽莎,范曼如,黄笛,薛竑飏,余临心, 高锦萍,43,邓通,,曾宪涛,4*,李宏军,程真顺,姚晓梅4*,王行环,4,40*,中国医疗保健国际交流促进会循证医学分会,中国研究型医院学会
1武汉大学中南医院循证与转化医学中心,武汉 430071;2中日友好医院国家呼吸系统疾病临床研究中心,北京 100029;3中日友好医院呼吸与危重症医学科,北京 100029;4武汉雷神山医院,武汉 430200;5武汉大学中南医院重症医学科,武汉 430071;6河南大学循证医学与临床转化研究院,河南开封 475000;7贵州省人民医院医学影像科,贵阳 550002;8武汉大学中南医院骨科,武汉 430071;9武汉大学中南医院肝胆外科,武汉 430071;10四川大学华西医院国家老年疾病临床医学研究中心,成都 610041;11四川大学华西医院老年医学中心,成都 610041;12武汉大学中南医院医学影像中心,武汉 430071;13中国医学科学院/北京协和医学院检验学系,北京协和医院检验科,北京 100730;14瑞典隆德大学临床研究中心/斯科讷大学医院,马尔默 25002;15武汉大学中南医院急救中心,武汉 403371;16武汉大学中南医院过敏反应科,武汉 403371;17武汉大学中南医院肿瘤放化疗科,武汉 403371; 18武汉大学人民医院重症医学科,武汉 430060;19山东大学齐鲁医院急诊科与胸痛中心,济南 250002;20湖北医药学院附属随州市中心医院呼吸与重症医学科,湖北随州 441300;21湖南省怀化市第二人民医院药学部,湖南怀化 418000;22安徽医科大学第二附属医院重症医学科,合肥 230601;23郑州大学医院内科,郑州 450001;24河南省人民医院呼吸与危重症医学科,郑州 450003;25复旦大学附属儿科医院感染传染科,上海 201102;26四川大学华西第二医院感染科,成都 610041;27河南中医药大学第一附属医院心内科,郑州 450000;28三峡大学人民医院/宜昌市第一人民医院心内科,湖北宜昌 443000;29武汉大学中南医院儿科,武汉 430071;30华中科技大学同济医学院附属同济医院药学部,武汉 430030;31山东第一医科大学附属省立医院/山东省立医院药学部,济南 250021;32南京中医药大学教育部针药结合重点实验室,南京 210023;33四川大学华西医院华西期刊社,成都 610041;34青岛大学附属烟台毓璜顶医院检验医学中心,山东烟台 264000;35十堰市太和医院(湖北医药学院附属医院)医学影像中心, 湖北十堰 442000;36北京大学护理学院,北京 100191;37开封市中心医院呼吸与危重症医学科,河南开封 475000;38北京电力医院急诊科,北京 100073;39中南大学湘雅二医院重症医学科,长沙 410008;40武汉大学中南医院泌尿科,武汉 430071;41武汉大学中南医院血液科,武汉 430071;42河南大学医学院护理与健康学院,河南开封 475000;43山西医科大学护理学院,太原 030001;44首都医科大学北京佑安医院放射诊断科,北京 100069; 45武汉大学中南医院呼吸与危重症医学科,武汉 430071;46麦克马斯特大学卫生研究方法证据及影响系,安大略省哈密尔顿市 L8S 4L8,加拿大
2020年3月11日,世界卫生组织(World Health Organization,WHO)宣布新型冠状病毒肺炎(coronavirus disease 2019,COVID-19)为全球大流行病。截至2020年7月31日下午4:39(中欧夏令时间),全球已向WHO报告了17 106 007例COVID-19病例,包括668 910例死亡病例[1]。COVID-19对全球公共卫生和经济等造成了广泛的不良影响,如何对COVID-19患者进行预防管理和科学诊疗尤为重要。在COVID-19暴发早期,本团队根据WHO的快速建议指南手册[2],基于间接证据制定并发布了《新型冠状病毒(2019-nCoV)感染的肺炎诊疗快速建议指南(标准版)》[3]。疫情暴发后,国内外COVID-19相关的临床研究陆续发表,为COVID-19的管理提供了直接证据,这些证据可能会改变此前的部分推荐意见并推动指南的更新。基于此,本团队对上一部快速建议指南进行了更新,更新后的指南涵盖药物预防、诊断、治疗及出院管理等4个方面。
1 指南制定方法
本循证临床实践指南以2014年WHO发布的最新版本指南制定手册为指导,指南计划书于2020年6月在《医学新知》(http://www.jnewmed.com/)发表[4]。
1.1 目标用户 参与诊疗COVID-19患者的一线临床医师以及政策制定者。
1.2 目标人群 除孕妇外的任何临床类型的成人COVID-19患者(年龄≥18岁)。
1.3 指南制订组组成 指南专家组由指南指导委员会、指南制订工作组和证据综合小组组成,包括27名临床专家(呼吸医学、传染病、危重症医学、心脏病学、急诊医学、儿科学、肿瘤学、老年医学、检验医学、医学影像学、临床免疫学和临床药学)、6名方法学家及18名具有证据检索和评估能力的临床研究助理。此外,指南外部评审组由9名临床专家和1名方法学家组成。
1.4 利益冲突评估 所有指南制订组成员均签署保密协议,并公开所有潜在的利益冲突(利益冲突声明表见附件1)。
1.5 临床问题的生成 指南指导委员会初步拟定“COVID-19更新版指南研究问题调查表”,并经指南制订工作组详细讨论,最终经网络讨论后确定了29个临床问题。
1.6 证据综合和推荐意见的制订 采用主题词和自由词相结合的中英文检索策略检索PubMed、Embase、Cochrane Library、中国知网和万方数据库,以及部分感染或呼吸相关的重要医学期刊、预印本平台和临床试验注册中心(附件2和3)。检索时间为2019年12月1日-2020年7月8日。检索的文献类型限制为系统评价、Meta分析或原始研究,且限定为针对COVID-19的直接研究证据。在药物预防和治疗部分,排除单臂研究和病例报告。
纳入文献的偏倚风险或质量评价基于相应的国际评估标准,如随机对照试验(randomized controlled trial,RCT)使用ROB 2.0,诊断准确性研究使用QUADAS-2,非随机干预性研究(non-randomized studies of interventions,NRSI)使用ROBINS-I[5]。在文献检索前,指南制定组根据GRADE(Grading of Recommendations Assessment, Development and Evaluation)方法[6]对治疗的结局指标进行分类,根据其重要性分为关键、重要和次要等3类。
在治疗部分,优先考虑的关键结局指标为病死率(mortality)、危重症转化率(critical conversion rate)、重症监护病房的入住率或入住时间[incidence rate or time of Intensive Care Unit (ICU) admission]以及序贯器官衰竭估计评分(sequential organ failure assessment,SOFA);重要结局指标为氧合指数/氧合血红蛋白饱和度(oxygenation index/oxyhemoglobin saturation)、SARS-CoV-2 RT-PCR检测阳性转阴性时间/比率(time/rate positive-to-negative conversion of RT-PCR test for SARS-CoV-2)、胸部或肺部影像学改善或病变吸收时间/ 比率(chest or lung imaging improvement or lesion absorption time or ratio)、临床改善时间/比率(chest or lung imaging improvement or lesion absorption time or ratio)、临床治愈时间/比率(time to clinical improvement, clinical cure time or rate)、肺炎严重程度指数(pneumonia severity index,PSI)、体温/体温恢复正常时间(body temperature/time for body temperature to return to normal)、住院时间(duration of hospital stay)、机械通气发生率/时间(incidence rate or time of mechanical ventilation)以及病毒载量(viral load)。在诊断部分,诊断准确性结局指标如敏感度(sensitivity)、特异度(specificity)和曲线下面积(area under curve,AUC)被视为重要结局指标。依据GRADE原则,指南制定组将每个结局的证据确定性评定为“高”“中”“低”或“极低”,并根据GRADE方法对推荐意见进行分级(表1)[6]。
在制订推荐意见的过程中,除考虑证据质量外,须综合衡量干预的利弊,利益相关者对干预措施的可接受性以及实施的可行性等[7-8]。最终推荐意见通过在线讨论及投票表决达成共识。指南制定组认为要将一项推荐意见分级为强或弱,需要通过至少70%的参与者认可。
指南报告依据指南研究与评价工具(appraisal of guidelines for research and evaluation,AGREE)清单[9]和临床实践指南报告规范(reporting items for practice guidelines in healthcare,RIGHT)清单[10]。
2 证据及推荐意见
最终纳入75项原始研究(包括12篇RCTs)、33篇系统评价或Meta分析(文献检索流程图见附件4和5);最终形成34项推荐意见,其中6项为强推荐,14项为弱推荐,3项为弱不推荐,11项为基于共识的建议。
COVID-19患者的临床分级标准:①轻型。临床症状轻微,影像学未见肺炎表现。②普通型。患者有发热和呼吸道症状,影像学可见肺炎表现。③重型。符合下列任何一项的成人患者:呼吸频率≥30次/min; 静息状态下血氧饱和度≤93%;氧合指数(PaO2/FiO2)≤300 mmHg。肺部影像学检查显示24~48 h病灶进展>50%的患者应视为重型。④危重型。符合下列任何一项:发生需要机械通气的呼吸衰竭;出现休克;出现需要在ICU中进行监测和治疗的其他器官衰竭。

表1 证据和推荐意见分级标准及相关概念解释Tab.1 Classification of evidence and recommendation
由于疾病类型、干预措施、药物剂量和疗程以及结果的报告时间在相同的临床问题中有诸多不同,能够完成的数据合并比较有限。因此,本指南只对进行了证据合成的结局报告进行总结。除肺移植问题外,本指南排除了单臂研究和病例报告。按等级评估的证据质量结果见附件6,推荐意见列表见附件7,被列入研究的方法质量评价结果和外部评审报告可在必要时提供(附件事宜请见本文结尾说明)。
3 药物预防
3.1 问题1:哪些药物可以预防暴露前人群感染SARS-CoV-2?
推荐意见:没有足够的证据支持或反对在暴露前人群中使用任何药物预防SARS-CoV-2感染(Grade 2C)。
证据总结:一项回顾性队列研究[11](纳入106位医护人员)发现,与暴露前未服用羟氯喹(hydroxychloroquine,HCQ)的人群相比,在接触第1例COVID-19患者之前服用HCQ,可使感染SARS-CoV-2的风险降低80.7%[相对危险度(relative risk,RR)=0.193,95%可信区间(confidence interval,CI) 0.071~0.526,P=0.001];29.8%的服用HCQ的医护人员出现不良反应但症状较轻,其中胃肠道不适、皮疹、头痛的发生率分别为19.1%、6.4%、4.3%。由于缺乏与研究设计相关的详细信息,如参与者的随访开始时间和干预开始时间以及证据质量的不精确性,证据质量等级为极低。
推荐理由:基于极低质量的证据,指南专家组未建议或反对使用HCQ预防暴露前人群感染SARS-CoV-2。
3.2 问题2:哪些中药制剂可以预防暴露前人群感染SARS-CoV-2?
推荐意见:没有证据支持或反对在暴露前人群中使用任何中药制剂预防SARS-CoV-2感染(基于共识的建议)。
3.3 问题3:哪些药物可以预防暴露后人群(接触或照顾COVID-19患者)感染SARS-CoV-2?
推荐意见:没有足够的证据支持或反对在暴露后人群中使用任何药物预防SARS-CoV-2感染(Grade 2C)。
证据总结:一项RCT[12][纳入821位受试者,在家庭或职业场所与COVID-19确诊患者的接触距离<6 ft(1.83 m)]发现,不戴面罩和眼罩(高风险暴露)或戴面罩但不戴眼罩(中等风险暴露)持续10 min以上,暴露后4 d内服用HCQ与安慰剂人群的COVID-19发病率无显著差异[HCQ组:11.8%(49/414);安慰剂组:14.3%(58/407);百分比差值为-2.4%,95%CI -7.0~2.2,P=0.35]。与安慰剂相比,HCQ的不良反应(如恶心、胃部不适、腹泻、腹部不适或呕吐)较为常见(40.1%vs.16.8%),未报告严重不良反应。
此外,一项回顾性队列研究[13](纳入来自27个家庭的66名成员和124名医护人员,既往有接触COVID-19确诊患者史)发现,相较暴露于感染COVID-19的同事且无标准呼吸防护,服用阿比多尔是预防COVID-19的一个保护因素(家庭成员:RR=0.025,95%CI 0.003~0.209,P=0.0006;医护人员:HR=0.056,95%CI 0.005~0.662,P=0.0221)。然而,尽管存在较大的效应量,但研究存在明显的局限性,包括样本有限以及缺乏与研究设计相关的详细信息(如参与者的随访开始时间和干预开始时间),证据质量等级为低。
推荐理由:由于证据存在一定的方法学局限性及不精确性,证据质量处于低等水平。基于目前的证据,指南专家组没有提出任何支持或反对阿比多尔或HCQ预防暴露后人群感染SARS-CoV-2的建议。
3.4 问题4:哪些中药制剂可以预防暴露后人群(接触或照顾COVID-19患者)感染SARS-CoV-2?
推荐意见:没有证据支持或反对在暴露后人群中使用任何中药制剂预防SARS-CoV-2感染(基于共识的建议)。
4 诊 断
4.1 问题5:对于COVID-19疑似患者,哪些典型临床表现可帮助临床医师区分SARS-CoV-2与其他病毒感染?
推荐意见:普通型成人COVID-19患者最常见的首发症状为发热和咳嗽(以干咳为主),常伴有疲劳、肌肉酸痛、呼吸困难、咳痰和胸闷。此外,部分患者可能出现腹泻、恶心、呕吐等胃肠道症状,嗅觉和味觉障碍,眼部症状以及皮肤症状等。从中医证型特点来看,COVID-19患者最常见的舌质为红舌、舌苔为腻苔、脉型为深脉。若临床医师初诊时发现患者出现上述症状,则须进行进一步检查(如CT、核酸检测等)以明确诊断(Grade 1A)。
无症状患者一般入院后仍呈现无症状状态或出现轻微症状,临床医师应警惕此类患者症状加重。危重患者临床表现较严重且更容易出现发热、呼吸困难和腹痛,临床医师应尽早明确其具体表现(Grade 2C)。
证据总结:
(1)常见临床表现:10项系统评价/Meta分析(纳入来自中国、澳大利亚、意大利、日本、韩国、荷兰、新加坡、英国、美国、尼泊尔、韩国和越南的134 222例患者)发现,COVID-19患者最常见的症状为发热(78.0%~91.3%)[14-23]、咳嗽(52.0%~72.2%)[14-23]、肌痛或疲劳(16.7%~51.0%)[14-23]、呼吸困难(10.4%~45.6%)[17-18,20,22-23]、 咳痰(21.3%~41.8%)[14,18,22]和胸闷(31.2%)[20]。
(2)胃肠道症状:4项系统评价/Meta分析(纳入来自中国、美国、韩国、新加坡、英国、澳大利亚、比利时、柬埔寨、法国、德国、意大利、日本、马来西亚、尼泊尔、菲律宾、俄罗斯、泰国和越南的19 007例患者)发现,消化系统症状总发生率为9.8%~17.6%[24-26],其中腹泻(7.8%~10.4%)[24-25,27]、恶心或呕吐(5.5%~7.7%)[24-25,27]、腹部不适或疼痛(3.0%~6.9%)[24-25]以及食欲不振(11%)[25]最为常见。
(3)重症患者临床表现:两项系统评价/Meta分析(纳入7827例中国患者)发现,重症患者出现发热(OR=1.67,95%CI 1.15~2.42,P=0.007)[28]、呼吸困难(OR=4.17,95%CI 2.04~8.53,P<0.001;OR=5.50,95%CI 2.45~12.33,P<0.001)[28-29]和胃肠道症状(OR=1.86,95%CI 1.19~2.89,P=0.006)[29]的风险高于非重症患者。另一项系统评价/Meta分析(纳入来自中国、新加坡和澳大利亚的2477例患者)发现,重症患者与非重症患者的腹泻(OR=1.32,95%CI 0.8~2.18,P=0.28)、恶心呕吐(OR=0.96,95%CI 0.42~2.19,P=0.92)发生率无显著差异,但重症患者的腹痛发生率为非重症患者的7倍(OR=7.17,95%CI 1.95~26.34,P=0.003)[27]。
(4)中医临床症状:一项系统评价/Meta分析[30](纳入484例中国患者)发现,COVID-19患者最常见的症状为发热(74.0%)、食欲不振(61.3%)、疲劳(53.5%)和咳嗽(50.4%),最常见的舌质、舌苔和脉象分别为红舌(39.1%)、腻苔(65.3%)和深脉(44.4%)。
(5)无症状患者:一项系统评价/Meta分析[31](纳入来自中国、日本和美国的506例患者)发现,大多数无症状患者(92.6%)入院后仍呈无症状状态,仅5例出现轻度发热(<38 ℃)。其他症状如咳嗽、疲劳、关节痛、头晕和鼻塞等仅在个别病例中出现。
(6)嗅觉和味觉障碍:两项系统评价/Meta分析(纳入来自18个国家的26 602例患者)发现,COVID-19患者的嗅觉或味觉障碍发病率为47%~52%[32-33]。20%(95%CI 13%~29%)的患者嗅觉和味觉丧失先于其他症状出现;28%(95%CI 22%~36%)的患者与其他症状同时发生[32]。另一项系统评价/Meta分析[34](评估21 515例患者)发现,与未检测到病毒的急性呼吸道感染患者相比,COVID-19患者发生嗅觉和(或)味觉障碍、嗅觉障碍、味觉障碍的OR依次为11.26(95%CI 5.41~23.4)、11.67(95%CI 6.43~21.17)、12.70(95%CI 7.9~20.44),其他呼吸道病毒感染患者的OR则依次为6.46(95%CI 2.79~14.97)、4.17(95%CI 1.34~12.98)、4.94(95%CI 1.59~15.31)。有50%(95%CI 36.7%~63.3%)的COVID-19患者发生嗅觉和(或)味觉障碍。
(7)眼部症状:一项横断面研究[35](纳入535例中国患者)发现,结膜充血(5.0%)是与COVID-19相关的眼部症状之一,且可能为首发症状。结膜充血患者也可能出现其他眼部症状,如结膜分泌物增多(29.6%)、眼痛(18.5%)、畏光(11.1%)、眼干(37.0%)和流泪(22.2%)等。另一项横断面研究(纳入121例患者)发现,瘙痒、红肿、流泪、分泌物增多和异物感等眼部症状(5.0%)也与COVID-19相关[36]。第3项横断面研究(纳入56例患者)发现,眼部症状(27%)在COVID-19患者中相对常见,且可能在呼吸道症状发生之前即已出现[37]。 第4项横断面研究(纳入38例患者)发现,约1/3(31.6%)的COVID-19患者表现出眼部异常,且多为重症COVID-19患者(66.7%)[38]。
(8)皮肤症状:一项系统评价[39](纳入来自中国、西班牙、意大利、法国、美国、加拿大、比利时、泰国、印度尼西亚和日本的507例患者)发现,COVID-19患者的皮肤症状呈多样性,最常见的皮肤病变为红斑(44.2%,224/507),分布于躯干、四肢、弯曲部位、面部和黏膜上。此外,红斑病变也可能局限在特定部位,如没有暴露等其他诱因的脚后跟。有100例(19.7%)出现冻疮样病变;83例(16.4%)出现荨麻疹样病变,分布于躯干或广泛分布于全身;227例(44.8%)出现明显的皮肤病变处瘙痒。此外,该系统评价描述了其他皮肤病变,如水疱(13.0%,66/507)、青斑/坏死(6.1%,31/507)和瘀斑(1.6%,8/507)。值得注意的是,有13例(14.8%)以皮肤病变为首发症状。
推荐理由:每种临床表现的证据质量从非常低到高不等。临床表现对于COVID-19患者的初步诊断至关重要。综合考虑证据质量、患者偏好、健康公平性、可接受性、可行性后,指南专家组对一般临床表现的推荐较强,对无症状患者的临床表现推荐较弱。目前缺乏高质量的同期病例对照研究来确认某些典型症状是否能帮助临床医师区分疑似COVID-19患者的SARS-CoV-2感染,纳入的证据主要是针对横断面研究的系统评价/Meta分析。
4.2 问题6:疑似COVID-19患者行核酸RT-PCR检测时,下呼吸道标本的诊断准确性(敏感度、特异度、阳性预测值、阴性预测值或检出率)是否优于上呼吸道标本?
推荐意见:若条件允许(患者可自主排痰或正在接受机械通气),则首选下呼吸道标本进行检测(Grade 2C)。下呼吸道标本的阳性检出率高于上呼吸道标本(基于共识的建议)。
实施要点:①采集下呼吸道标本时,应采取空气隔离措施以防止患者及采集者受到感染;②对于没有痰液的患者,首选鼻拭子或咽拭子。
证据总结:一项系统评价/Meta分析[40](n=3442,其中757例为确诊病例)比较不同呼吸道标本SARSCoV-2核酸检测结果,发现口咽拭子、鼻咽拭子及痰液的检出率分别为43%(95%CI 34%~52%)、54%(95%CI 41%~67%)、71%(95%CI 61%~80%)。根据发病时间(0~7 d、8~14 d及超过14 d)进行亚组分析显示,痰液的检出率最高(依次为98%、69%、46%),口咽拭子最低(依次为75%、35%、12%)。该研究结果强调了早期检测的重要性并表明采用痰液样本进行核酸检测可作为COVID-19诊断和监测的主要方法。由于该研究未纳入无症状感染者及轻症患者,且用于RT-PCR检测的靶基因未统一,因此降低了其推广价值。
此外,两项横断面研究报告了RT-PCR检测呼吸道标本SARS-CoV-2的阳性率[41-42]。其中一项研究检测了4880例疑似患者的呼吸道标本,结果显示,肺泡灌洗液、痰液和鼻咽拭子的阳性率分别为80%(4/5)、49.12%(28/57)和38.25%(1843/4818),下呼吸道标本的阳性率高于上呼吸道标本(51.6%vs.38.25%)[42]。另一项研究检测了8274例疑似患者的呼吸道标本,结果显示,肺泡灌洗液、痰液、口咽拭子、鼻咽拭子以及口咽联合鼻咽拭子的阳性率分别为60%(3/5)、24.51%(25/102)、47.92%(23/48)、41.01%(2047/4992)和20.69%(647/3127),上呼吸道标本的阳性率高于下呼吸道标本(33.3%vs.26.2%)[41]。由于两项研究中下呼吸道标本量均较小,应谨慎解读其结果。
推荐理由:考虑到证据之间存在不一致性以及下呼吸道标本采集过程中的职业暴露风险,虽然专家共识认为下呼吸道标本具有较高的阳性率,指南专家组最终仍仅给予弱推荐。
4.3 问题7:对于疑似COVID-19患者,IgM和IgG抗体联合核酸RT-PCR检测的诊断准确性(敏感度、特异度、阳性预测值或阴性预测值)是否优于单独核酸RT-PCR检测?
推荐意见:临床诊断者应在发病后10~14 d接受IgM和IgG抗体检测。IgM和IgG抗体联合检测优于单独IgM或IgG抗体检测(Grade 1C)。
实施要点:临床诊断者是指具有流行病学史、典型COVID-19临床症状及影像学特征,但核酸RT-PCR 检测结果呈阴性的人群,当其SARS-CoV-2特异性IgG抗体由阴性转为阳性或恢复期较急性期升高4倍及以上时可确诊。
证据总结:一项系统评价/Meta分析[43](n=15 976)研究抗体检测的诊断准确性,以评估抗体检测能否判断当前或既往存在COVID-19感染。在纳入的诊断准确性试验中,抗体检测的金标准包括RT-PCR检测和临床诊断标准(根据指南或多个临床特征综合诊断)。汇总结果显示,发病后1~7 d,IgG、IgM以及IgG/IgM抗体检测的敏感度分别为29.7%(95%CI 22.1%~38.6%)、23.2%(95%CI 14.9%~34.2%)和30.1%(95%CI 21.4%~40.7%);发病后8~14 d分别为66.5%(95%CI 57.9%~74.2%)、58.4%(95%CI 45.5%~70.3%)和72.2%(95%CI 63.5%~79.5%);发病后15~21 d分别为88.2%(95%CI 83.5%~91.8%)、75.4%(95%CI 64.3%~83.8%)和91.4%(95%CI 87.0%~94.4%);发病后22~35 d分别为80.3%(95%CI 72.4%~86.4%)、68.1%(95%CI 55.0%~78.9%)和96.0%(95%CI 90.6%~98.3%);发病超过35 d后分别为86.7%(95%CI 79.6%~91.7%)、53.9%(95%CI 38.4%~68.6%)和77.7%(95%CI 66.0%~86.2%)。汇总的特异度(未依据发病时间分组)结果显示,IgG、IgM以及IgG/IgM抗体检测的特异度分别为99.1%(95%CI 98.3%~99.6%)、98.7%(95%CI 97.4%~99.3%)和98.7%(95%CI 97.2%~99.4%)。对于症状超过2周而未行RT-PCR检测或RT-PCR检测阴性的患者,进行抗体检测有助于识别是否存在COVID-19感染。
推荐理由:临床诊断者的确诊十分重要。几乎所有专家均认为,无论RT-PCR的检测结果如何,都应对临床诊断者进行IgM和IgG抗体检测。对于传染病的诊断,理想情况下可直接从样本中检测出病原体,但通常情况下很难直接检出,因为病原体的生长条件受各种因素影响且检测阳性率亦较低,而特异性抗体检测可在一定程度上弥补这些不足。基于当前证据以及考虑到适用性和可行性,指南专家组给予强推荐。
4.4 问题8:当疑似患者的核酸RT-PCR检测为阴性时,胸部CT或X线检查是否有助于COVID-19的诊断?如果是,哪一种检查更有效?
推荐意见:胸部CT和X线检查是RT-PCR检测的重要替代检查方法。具有典型胸部CT和X线表现的疑似患者应按照临床诊断者进行隔离及治疗(Grade 1C)。
实施要点:在发病率较低的地区,不建议将胸部CT和X线检查作为主要的筛查或诊断方法。
证据总结:一项Meta分析[44](n=6218)将初始或重复的RT-PCR检测结果作为金标准来评估胸部CT的诊断效能,结果显示,胸部CT的敏感度和特异度分别为94%(95%CI 91%~96%)和37%(95%CI 26%~50%)。敏感性分析(以重复的RT-PCR检测结果作为金标准)结果显示,胸部CT的敏感度和特异度分别为93%(95%CI 88%~96%)和35%(95%CI 23%~48%)。在就诊人群发病率为1%的地区,胸部CT的阳性预测值和阴性预测值分别为1.5%和99.8%;在就诊人群发病率为10%的地区分别为14.2%和98.2%;在就诊人群发病率为39%的地区分别为48.8%和90.6%。胸部CT的阳性预测值为1.5%~30.7%,阴性预测值为95.4%~99.8%。总之,由于胸部CT具有较高的假阳性率,因此在发病率较低的地区不宜作为COVID-19筛查和诊断的主要方法。由于该Meta分析存在较高的偏倚风险以及较差的一致性,指南专家组将该证据质量等级降为极低。
此外,两项诊断准确性试验[45-46]评估了胸部CT和X线检查的诊断效能:以RT-PCR检测结果作为金标准,胸部CT的敏感度、特异度、阳性预测值和阴性预测值分别为97.7%、53.9%、85.6%和89.2%,胸部X线则分别为89.0%(95%CI 85.5%~91.8%)、60.6%(95%CI 51.6%~69.2%)、87.9%(95%CI 84.4%~90.9%)和63.1%(95%CI 53.9%~71.7%);胸部CT的阳性似然比和阴性似然比分别为2.12和0.04。由于这两项研究未提供胸部CT、X线与RT-PCR检测的间隔时间,可能会降低证据质量。
推荐理由:目前的证据显示,胸部CT在COVID-19的诊断中具有较高的敏感度和较低的特异度,因此可能会产生过多的假阳性结果。由于纳入的研究多为病例回顾或横断面研究,并未聚焦于检查方法的诊断准确性,因此缺乏足够的信息以全面评估诊断部分的证据质量,故按照一般原则对证据质量进行降级。面对疫情的暴发,应尽早对具有典型胸部CT和X线表现的疑似患者进行诊断、隔离和治疗。虽然证据质量极低,但考虑到COVID-19的高度传染性和早期诊断的迫切性,指南专家组给予强推荐。
4.5 问题9:可以帮助临床医师鉴别COVID-19与其他病毒性肺炎的CT影像表现有哪些?
推荐意见:COVID-19的病变主要分布在单侧或双侧肺下叶,且以外周分布为主。COVID-19的常见影像学表现为毛玻璃混浊(ground-glass opacities,GGO)、小叶间隔增厚、血管扩张、铺路石征、胸膜下条索影、肺实变及空气支气管征等。以GGO为主的影像特征较其他病毒性肺炎更常见,而GGO与实变混合的影像特征较其他病毒性肺炎少见。与非COVID-19肺炎相比,COVID-19肺炎病灶的外周分布率更高,且主要为肺上叶和中叶受累。与普通型患者相比,重型和危重型患者的某些CT表现更为多见,如牵拉性支气管扩张、小叶间隔增厚、肺实变、铺路石征、小叶间隔增厚、散列铺展、网状、胸腔积液、淋巴结病变等(Grade 1A)。
证据总结:一项系统评价/Meta分析[47](纳入2451例中国患者)比较了普通型与重症COVID-19患者的胸部CT特征,结果显示,普通患者组(包括普通型患者)主要CT特征为肺血管扩张(0.79,95%CI 0.74~0.84),GGO(0.78,95%CI 0.64~0.89),胸膜下条索影(0.58,95%CI 0.12~0.97),以及小叶间隔增厚(0.51,95%CI 0.26~0.76);重症患者组(包括重型和危重型患者)主要CT特征为肺血管扩张(0.93,95%CI 0.75~1.00),GGO (0.82,95%CI 0.68~0.92),小叶间隔增厚(0.80,95%CI 0.64~0.93),空气支气管征(0.67,95%CI 0.57~0.78),实变(0.61,95%CI 0.42~0.78),胸膜下条索影(0.61,95%CI 0.10~1.00),铺路石征(0.59,95%CI 0.42~0.79),以及牵拉性支气管扩张(0.52,95%CI 0.30~0.73)。普通患者组1个肺叶、2个肺叶和2个以上肺叶的发生率分别为0.26(95%CI 0.07~0.52)、0.21(95%CI 0.01~0.54)和0.57(95%CI 0.23~0.87);重症患者组分别为(0.10,95%CI 0.00~0.05)、(0.40,95%CI 0.00~0.10)和(0.94,95%CI 0.88~0.99)。普通患者组单侧肺炎,病变累及右上叶、右中叶、右下叶、左上叶、左下叶,病变呈周围分布和中央分布的发生率分别为0.22(95%CI 0.12~0.33)、0.49(95%CI 0.16~0.83)、0.47(95%CI 0.23~0.72)、0.80(95%CI 0.74~0.86)、0.61(95%CI 0.22~0.93)、0.81(95%CI 0.53~0.98)、0.91(95%CI 0.87~0.94)、0.05(95%CI 0.00~0.24);重症患者组分别为0.05(95%CI 0.02~0.10)、0.89(95%CI 0.79~0.96)、0.86(95%CI 0.76~0.94)、0.98(95%CI 0.93~1.00)、0.92(95%CI 0.83~0.98)、0.99(95%CI 0.95~1.00)、0.88(95%CI 0.62~1.00)、0.17(95%CI 0.00~0.63)。与重症患者组相比,普通患者组较少出现以下特征:牵拉性支气管扩张(OR=0.40,95%CI 0.24~0.67,P=0.002),实变(OR=0.31,95%CI 0.15~0.64,P=0.001),小叶间隔增厚(OR=0.27,95%CI 0.14~0.51,P=0.000),铺路石征(OR=0.22,95%CI 0.11~0.44,P=0.000),网状影(OR=0.20,95%CI 0.05~0.80,P=0.023),胸腔积液(OR=0.19,95%CI 0.07~0.49,P=0.001),淋巴结肿大(OR=0.17,95%CI 0.07~0.41,P=0.008),2个以上肺叶受累(OR=0.07,95%CI 0.03~0.17,P=0.000);但普通患者组较常出现以下特征:1个肺叶受累(OR=13.84,95%CI 4.17~45.94,P=0.000),2个肺叶受累(OR=6.95,95%CI 2.41~20.02,P=0.004)。对于病变的位置和分布,普通患者组较少出现以下部位的异常:右上叶(OR=0.09,95%CI 0.04~0.21,P=0.000),右中叶(OR=0.14,95%CI 0.06~0.29,P=0.001),右下叶(OR=0.17,95%CI 0.05~0.56,P=0.005),左上叶(OR=0.10,95%CI 0.04~0.25,P=0.000),左下叶(OR=0.09,95%CI 0.02~0.38,P=0.002),中心分布(OR=0.18,95%CI 0.08~0.40,P=0.000);但普通患者组较常出现单侧肺炎(OR=4.65,95%CI 1.28~16.91,P=0.020)。其余以下特征与疾病的严重程度没有明显相关性:结节(OR=1.75,95%CI 0.47~6.56,P=0.093),胸膜下条索影(OR=0.99,95%CI 0.52~1.89,P=0.983),GGO(OR=0.75,95%CI 0.58~0.97,P=0.404),血管扩张(OR=0.51, 95%CI 0.24~1.10,P=0.207),空气支气管征(OR=0.16,95%CI 0.02~1.16,P=0.070),支气管壁增厚(OR=0.15,95%CI=0.02~1.12,P=0.064),外周分布(OR=1.17,95%CI 0.56~2.44,P=0.668)。
一项系统评价/Meta分析[48](纳入52 251例中国患者)显示,84%(95%CI 78%~85%)的COVID-19患者胸部X线和CT影像学表现异常,包括双肺受累(0.768,95%CI 0.63~0.87),实变(0.755,95%CI 0.51~0.91),GGO(0.710,95%CI 0.40~0.90),以及单侧肺受累(0.165,95%CI 0.85~0.30)。
一项系统评价/Meta分析[49](纳入来自中国、日本和意大利的934例COVID-19患者以及来自中国、日本、澳大利亚、意大利、巴西、韩国、德国、土耳其、朝鲜和美国的977例非COVID-19患者)比较COVID-19肺炎与非COVID-19肺炎患者的胸部CT影像学表现,结果显示,COVID-19肺炎与非COVID-19病毒性肺炎的常见CT特征为GGO合并实变[0.37(95%CI 0.17~0.56);0.46(95%CI 0.35~0.58)],以GGO为主[0.42(95%CI 0.28~0.55);0.25(95%CI 0.17~0.32)],双肺受累[0.81(95%CI 0.77~0.85);0.69(95%CI 0.54~0.84)],下叶受累[0.88(95%CI 0.80~0.95);0.61(95%CI 0.50~0.82)],上叶受累[0.77(95%CI 0.65~0.88);0.18(95%CI 0.10~0.27)],中叶受累[0.61(95%CI 0.47~0.76);0.24(95%CI 0.11~0.38)],以及外周分布[0.77(95%CI 0.67~0.87);0.34(95%CI 0.18~0.49)]。
推荐理由:基于以上证据及专家证据,指南专家组给予强推荐。
轻型、普通型、重型、危重型以及无症状感染者胸部CT图像如图1-5所示,资料来自武汉大学中南医院(经武汉大学中南医院伦理委员会批准)。
5 治 疗
5.1 问题10:洛匹那韦/利托那韦是否应该用于治疗COVID-19患者以改善临床结局?
推荐意见:不推荐洛匹那韦/利托那韦治疗任何类型的COVID-19患者[Grade 2(C-B)]。
证据总结:一项RCT[50](纳入199例重型患者)发现,洛匹那韦/利托那韦组与常规治疗组在临床改善时间(HR=1.31,95%CI 0.95~1.85,P=0.09)及疾病进展恶化(HR=1.01,95%CI 0.76~1.34)方面差异均无统计学意义。此外,服用洛匹那韦/利托那韦后胃肠道不良事件更为常见。
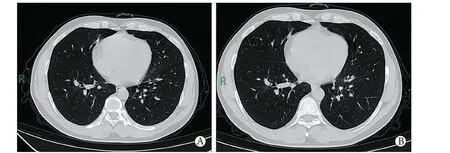
图1 轻型患者胸部CTFig.1 Chest CT of mild patient
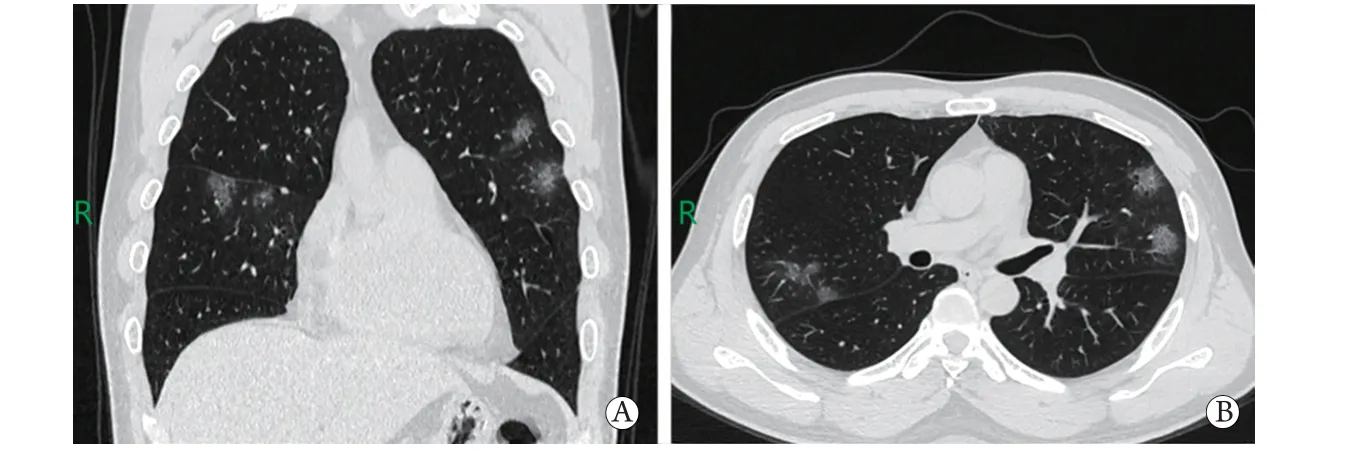
图2 普通型患者胸部CTFig.2 Chest CT of moderate patient
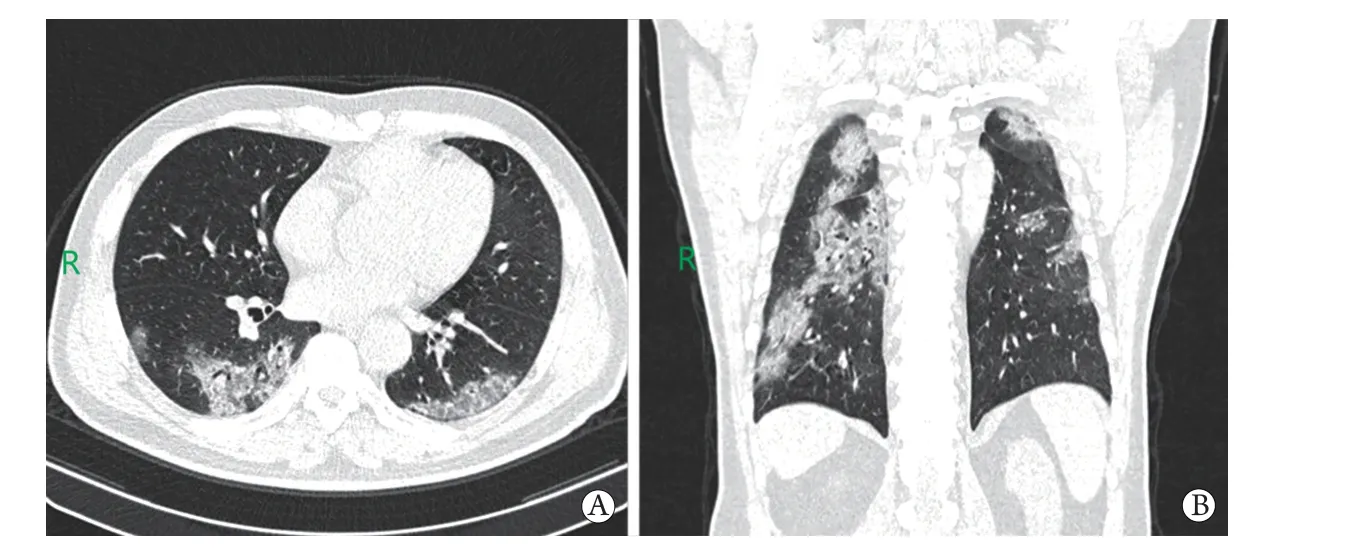
图3 重型患者胸部CTFig.3 Chest CT of severe patient

图4 危重型患者胸部CTFig.4 Chest CT of critical patient
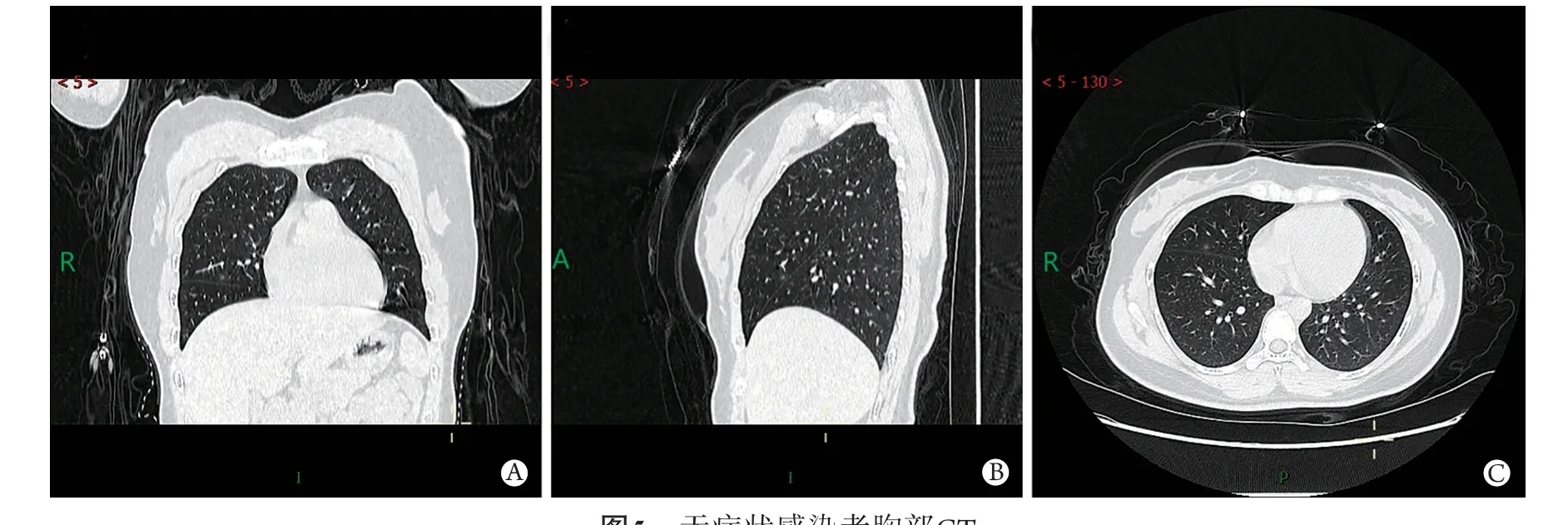
图5 无症状感染者胸部CTFig.5 Chest CT of asymptomatic patient
另一项RCT[51]中,随机分配21例轻型或普通型COVID-19患者接受洛匹那韦/利托那韦治疗,16例接受阿比多尔治疗,7例未接受抗病毒药物治疗(对照组)。洛匹那韦/利托那韦组病毒核酸转阴中位时间为8.5(3~13) d,阿比多尔组为7(3~10.5) d,对照组为4(3~10.5) d,3组比较差异无统计学意义(P=0.75)。在治疗过程中,洛匹那韦/利托那韦组有5例(23.8%)患者出现不良反应,主要表现为腹泻(14.3%)、食欲不振(9.5%)和谷丙转氨酶(alanine aminotransferase,ALT)升高(4.8%),而阿比多尔组和对照组未出现明显的不良反应。
一项非RCT[52]中,80例COVID-19患者均接受重组人干扰素α2b雾化吸入及对症支持治疗,其中45例口服洛匹那韦/利托那韦,35例口服法匹拉韦。洛匹那韦/利托那韦组病毒核酸转阴中位时间长于法匹拉韦组[11(8~13) dvs.4(2.5~9) d,P<0.001];法匹拉韦组肺部影像学改善较洛匹那韦/利托那韦组快,改善率分别为91.4%和62.2%(P=0.004);洛匹那韦/利托那韦组不良反应发生率高于法匹拉韦组(55.6%vs.11.4%,P<0.001),主要表现为恶心、呕吐、腹泻、皮疹、肝肾功能损伤等。
一项回顾性研究[53]中,纳入222例COVID-19患者,其中108例给予洛匹那韦/利托那韦治疗,114例未给予洛匹那韦/利托那韦治疗(对照组),结果显示,洛匹那韦/利托那韦组病毒核酸转阴时间[(7.13±3.36) dvs.(8.53±3.85) d,P=0.04]、肺部影像学改善时间[6(4~8.75) dvs.8(5~11) d,P=0.047]均短于对照组。两组临床症状改善方面差异无统计学意义(P>0.05)。洛匹那韦/利托那韦组不良反应发生率高于对照组(27.8%vs.13.2%,P=0.007),主要表现为转氨酶和胆红素升高、恶心、呕吐、腹泻、皮疹等。
另一项回顾性研究[54]中,纳入120例COVID-19患者,其中78例给予洛匹那韦/利托那韦治疗,42例未给予洛匹那韦/利托那韦治疗(对照组)。治疗10 d内,洛匹那韦/利托那韦组病毒核酸转阴中位时间短于对照组[22(18~29) dvs.28.5(19.5~38) d,P=0.02],而治疗超过10d后,两组病毒核酸转阴时间无显著差异(27.5dvs.28.5 d,P=0.86)。该研究未报告不良反应发生情况。
一项回顾性队列研究[55]招募了42例COVID-19患者口服洛匹那韦/利托那韦和5例未服用洛匹那韦/利托那韦的患者。所有患者均接受辅助治疗,包括干扰素雾化吸入和口服阿比多尔。尽管两组患者的体温在治疗超过10 d后没有显著差异(P>0.05),但洛匹那韦/利托那韦组体温复常时间、病毒核酸转阴时间短于对照组[(4.8±1.94) dvs.(7.3±1.53) d,P=0.04;(7.8±3.09) dvs.(12.0±0.82) d,P=0.02]。洛匹那韦/利托那韦组ALT、谷草转氨酶(aspartate aminotransferase,AST)异常发生率均低于对照组(9.5%vs.25%,19%vs.25%)。
另一项回顾性队列研究[56]纳入50例COVID-19患者,其中洛匹那韦/利托那韦组34例,阿比多尔组16例。阿比多尔组病毒核酸转阴时间短于洛匹那韦/利托那韦组[9.5(5.3~11.0) dvs.11.5(8.8~17.0) d,P<0.01]。治疗过程中两组均出现ALT升高(洛匹那韦/利托那韦组3例、阿比多尔组4例)。
最后一项回顾性队列研究[57]纳入134例COVID-19患者,均接受干扰素α2b雾化吸入治疗,其中52例给予洛匹那韦/利托那韦,34例给予阿比多尔,48例未给予任何抗病毒药物(对照组)。3组体温复常中位时间(P=0.31)和病毒核酸转阴时间(P=0.79)差异均无统计学意义。3组不良反应发生率差异亦无统计学意义,但洛匹那韦/利托那韦组、阿比多尔组和对照组常见的胃肠道不良反应发生率分别为17.3%、8.8%和8.3%。
推荐理由:两项RCTs未发现服用洛匹那韦/利托那韦的绝对优势。尽管一些队列研究显示服用洛匹那韦/利托那韦有益,但常规治疗中包括其他抗病毒药物,因此难以明确是洛匹那韦/利托那韦或其他抗抗毒药物起作用抑或是联合起作用。再者,鉴于回顾性研究验证干预有效性的效力不足以及研究结果存在争议,在平衡利弊后,超过70%的指南专家组成员对服用洛匹那韦/利托那韦给出弱推荐。相关临床试验仍在进行中。
5.2 问题11:阿比多尔是否应该用于治疗COVID-19患者以改善临床结局?
推荐意见:阿比多尔可考虑用于治疗COVID-19患者(基于共识的建议)。
实施要点:①阿比多尔每次200 mg,3次/d,服用不超过10 d;②部分服用阿比多尔的患者可能出现腹泻和血清转氨酶升高现象,偶见心动过缓。
证据总结:一项RCT[51]招募了44例轻型/普通型COVID-19患者,其中21例服用洛匹那韦/利托那韦,16例服用阿比多尔,7例未服用抗病毒药物(对照组)。3组病毒核酸转阴中位时间差异无统计学意义[8.5(3~13) dvs.7(3~10.5) dvs.4(3~10.5) d,P=0.75]。阿比多尔组及对照组均未出现明显的不良反应。
一项队列研究[57]纳入134例COVID-19患者(其中96%为普通型),所有患者均接受干扰素α2b雾化吸入治疗,其中52例接受洛匹那韦/利托那韦治疗,34例接受阿比多尔治疗,48例未接受抗病毒药物治疗(对照组)。3组体温复常中位时间(P=0.31)和病毒核酸转阴中位时间(P=0.79)差异无统计学意义。此外,阿比多尔组有3例(8.8%)出现腹泻、2例出现轻度肝功能损害,但3组不良反应发生率差异无统计学意义,且停药后不良反应均有所缓解。
一项队列研究[58]招募111例COVID-19患者,根据是否给予阿比多尔治疗分为阿比多尔组(n=49)与对照组(n=62),所有患者均给予常规治疗(根据临床医师的经验和判断进行治疗)。结果显示,服用阿比多尔可提高病毒核酸转阴发生率(59.2%vs.40.3%,P=0.048),改善肺部病变的局部吸收率(55.1%vs.32.2%,P=0.02),减少高流量鼻导管吸氧的需求(P=0.002)。该研究观察到1例心动过缓,停药后有所缓解。
另一项回顾性队列研究[56]纳入50例COVID-19患者,其中34例给予洛匹那韦/利托那韦治疗,16例给予阿比多尔治疗。阿比多尔组病毒核酸转阴时间短于洛匹那韦/利托那韦组[9.5(5.3~11.0) dvs.11.5(8.8~17.0) d,P<0.01]。在不良反应方面,两组均出现ALT升高(洛匹那韦/利托那韦组3例、阿比多尔组4例)。
另一项队列研究[59]招募62例COVID-19患者,均接受常规治疗(包括雾化吸入干扰素),根据是否服用阿比多尔分为阿比多尔组(n=42)与对照组(n=20)。结果发现,阿比多尔组体温复常时间[(4.98±1.79) dvs.(6.01±1.80) d,P=0.02]与病毒核酸转阴时间均短于对照组。虽然阿比多尔组住院时间较对照组短,但差异无统计学意义[(16.5±7.14) dvs.(18.55±7.52) d,P>0.05]。在治疗过程中,阿比多尔组有7例(16.7%)出现恶心,2例(4.8%)出现腹泻和头晕,但两组差异无统计学意义(P>0.05)。
最后一项回顾性队列研究[60]纳入81例普通型和重型COVID-19患者,其中45例给予阿比多尔治疗,36例未给予阿比多尔治疗(对照组)。结果显示,阿比多尔组中位住院时间[13(9~17) dvs.11 (9~14) d,P=0.04]、病毒核酸转阴时间[6(4~8) dvs.3(1~7) d,P<0.05]均长于对照组。至于安全性,两组均出现消化道症状[阿比多尔组5例(11%)、对照组3例(8%)],主要表现为腹泻和恶心,但两组差异无统计学意义(P>0.05)。
推荐理由:目前证据基于1项RCT和5项队列研究,但研究结论不一致,其中RCT显示服用阿比多尔对COVID-19患者没有益处,但其样本量非常有限,证据质量低。多数队列研究支持使用阿比多尔。超过70%的指南专家组成员结合其临床治疗经验认为,阿比多尔是一种潜在有效的药物,但需要正在进行的临床试验进一步证实。
5.3 问题12:法匹拉韦是否应该用于治疗COVID-19患者以改善临床结局?
推荐意见:建议法匹拉韦可用于治疗COVID-19患者(Grade 2B)。
实施要点:①法匹拉韦首日剂量1600 mg,2次/d,口服;随后600 mg,2次/d,口服,连续用药不应超过14 d;②常见不良反应为消化系统反应(恶心、反酸和胀气),以及血尿酸、ALT和(或)AST升高。
证据总结:一项RCT[61]招募236例合并高血压或糖尿病的普通型或重型COVID-19患者。在普通型COVID-19患者中,治疗7 d,法匹拉韦组临床恢复率高于阿比多尔组(71.4%vs.55.9%,P=0.02),且咳嗽缓解时间及退热时间短于阿比多尔组(P<0.0001);而在重型COVID-19患者中差异均无统计学意义(P=0.47)。法匹拉韦组与对照组最常见的不良事件为血尿酸升高(13.8%vs.2.5%,P<0.01)。此外,两组均出现肝功能异常[ALT和(或)AST升高]、精神症状以及消化道不良反应(恶心、反酸、胀气)。
一项非RCT研究[52]纳入80例COVID-19患者,均接受干扰素α2b雾化吸入治疗,其中35例给予法匹拉韦治疗,45例给予洛匹那韦/利托那韦治疗。法匹拉韦组病毒核酸转阴时间短于洛匹那韦/利托那韦组[4(2.5~9) dvs.11(8~13) d,P<0.001],肺部影像学改善率高于洛匹那韦/利托那韦组(91.4%vs.62.2%,P=0.004),不良反应发生率低于洛匹那韦/利托那韦组(11.4%vs.55.6%,P<0.001)。主要不良反应有恶心、呕吐、腹泻、皮疹、肝肾损伤等。
推荐理由:证据来自1项RCT和1项非RCT研究,由于缺乏分配隐藏和盲法的信息以及未校正混杂偏倚等因素,证据质量等级为中。此外,所纳入的研究样本均来自中国,导致外推性可能受到限制。基于偏倚风险、不精确性及间接性,对证据质量进行降级。在权衡利弊后,超过70%的指南专家组成员认为法匹拉韦可能对患者有利,并对服用法匹拉韦治疗COVID-19患者给出弱推荐。相关临床试验仍在进行中。
5.4 问题13:干扰素是否应该用于治疗COVID-19患者以改善临床结局?
推荐意见:干扰素可考虑用于治疗COVID-19患者(基于共识的建议)。
实施要点:干扰素500万U,2次/d,加入灭菌注射用水2 ml,雾化吸入,疗程不超过14 d。此外,不同国家可根据相应的药品说明书使用干扰素。
证据总结:一项RCT[62]招募81例COVID-19患者,其中42例接受干扰素β1a(1200万U/ml干扰素β1a每周皮下注射3次,连续2周),39例仅接受常规治疗(包括其他抗病毒药物)。与对照组相比,干扰素组第14天出院率显著增高(66.7%vs.43.6%,OR=2.5,95%CI 1.05~6.37),28 d病死率显著降低(19.0%vs.43.6%,P=0.015)。两组临床改善时间[(9.7±5.8) dvs.(8.3±4.9) d,P=0.95)和机械通气持续时间[(10.86±5.38) dvs.(7.82±7.84) d,P=0.47)差异均无统计学意义。在治疗过程中发现,尽管两组不良反应发生率差异无统计学意义,但干扰素组有8例(19%)出现注射相关不良反应。
一项队列研究[63]纳入256例COVID-19患者,其中106例给予干扰素β1b,隔日皮下注射,剂量250 μg,注射3~5剂,另150例作为对照。所有患者均接受常规治疗(包括其他抗病毒药物)。结果表明,注射干扰素β1b与住院病死率降低无关(20.8%vs.27.3%,P=0.229)。该研究未报告任何不良反应。
一项前瞻性队列研究[64]招募814例COVID-19患者,其中761例接受干扰素α2b(肌内注射,每周3次,每次300万U,持续2周),另53例作为对照,所有患者均接受常规治疗(包括洛匹那韦/利托那韦和氯喹)。结果表明,接受干扰素治疗的患者出院率高于对照组(95.4%vs.26.1%,P<0.01),且病死率明显低于对照组患者(0.9%vs.32.1%,P<0.01)。该研究未报告任何不良反应。
一项回顾性队列研究[65]纳入77例普通型COVID-19患者,其中7例接受干扰素α2b雾化治疗,24例接受阿比多尔治疗,46例接受干扰素α2b联合阿比多尔治疗。结果表明,接受干扰素α2b治疗的患者病毒核酸转阴时间短于服用阿比多尔的患者(P=0.003)。该研究未报告任何不良反应。
推荐理由:目前的证据来自1项RCT和3项队列研究,且研究结论不一致,仅一项队列研究表明干扰素β1b对COVID-19患者没有益处。由于各项研究的研究设计不同,患者的严重程度及给药方案不同,因此未进行数据合并,而且研究质量存在一定程度的缺陷,不能完全排除选择偏倚和未测量的混杂偏倚的可能性。此外,常规治疗中包括其他抗病毒药物,会影响干扰素治疗有效的确定性。超过70%的指南专家组成员认为使用干扰素的益处大于风险,因此给出“基于未分级共识的建议”。
5.5 问题14:瑞德西韦是否应该用于治疗COVID-19患者以改善临床结局?
推荐意见:建议瑞德西韦可用于治疗COVID-19患者[Grade 2(C-B)]。
实施要点:①瑞德西韦首次负荷剂量200 mg,随后每天静脉注射100 mg,持续不超过10 d;②瑞德西韦最常见的不良反应为贫血或血红蛋白减少。
证据总结:一项系统评价/Meta分析[66]纳入5项有关瑞德西韦治疗COVID-19的研究(3项RCTs和2项病例系列研究)。两项RCTs评估了瑞德西韦与安慰剂治疗10 d的疗效,其中一项RCT还比较了瑞德西韦治疗5 d和10 d的疗效。Meta分析结果显示,瑞德西韦治疗10 d的临床改善时间短于治疗5 d且短于安慰剂组(MD=-3.02,95%CI 4.98~1.07,P=0.002)。两组在降低病死率方面无显著差异(OR=0.72,95%CI 0.39~1.36,P=0.32)。尽管两组不良反应发生率无显著差异,但瑞德西韦组严重不良反应发生率低于安慰剂组(OR=0.71,95%CI 0.55~0.92,P=0.009)。瑞德西韦治疗10 d的不良反应发生率高于治疗5 d(OR=1.98,95%CI 1.27~3.11,P=0.003)。一项病例系列研究纳入53例患者,其中34例在基线时需要机械通气,另19例不需要机械通气。结果显示,需要机械通气的患者病死率、不良反应发生率均较高(18%vs.5%;65%vs.53%)。另一项病例系列研究纳入35例患者(ICU患者18例,普通型患者17例),其中9例ICU患者和13例普通型患者完成了为期10 d的瑞德西韦治疗。随访28 d发现,ICU患者的临床改善率(38.9%)低于普通型患者(88.2%)。治疗过程中最常见的严重不良反应为肝酶升高(42.8%)和急性肾损伤(22.8%)。
推荐理由:系统评价/Meta分析纳入的研究中,仅2项比较了瑞德西韦和安慰剂治疗COVID-19患者的疗效,且研究结果存在争议。一项来自中国的RCT表明,使用瑞德西韦治疗重型COVID-19患者对临床结局没有益处;然而,由于该RCT无法招募预期的研究人数,导致研究的把握度从80%降至58%。另一项RCT纳入1059例COVID-19患者(88.7%为重型),结果显示,瑞德西韦治疗在恢复时间方面有益,但在死亡发生率方面差异无统计学意义。由于研究结果的不一致性和局限性,本团队对证据质量进行降级。该系统评价/Meta分析纳入了病例系列研究,本团队认为这些病例系列研究对增加瑞德西韦治疗有效的证据没有益处。尽管瑞德西韦对COVID-19患者生存率的影响尚不清楚,但超过70%的指南专家组成员认为瑞德西韦在某些方面可能有效,使用其益处大于风险。一些正在进行的RCTs的结果可能为这种治疗选择提供强有力的证据。
5.6 问题15:抗病毒药物联合是否应该用于治疗COVID-19患者以改善临床结局?
推荐意见:没有足够的证据支持或反对使用抗病毒药物联合治疗COVID-19患者(Grade 2C)。需要注意的是,不应同时使用3种及以上的抗病毒药物(基于共识的建议)。
证据总结:一项开放性、随机、Ⅱ期试验[67]招募127例COVID-19患者,随机分为联合治疗组(n=86,给予洛匹那韦/利托那韦、利巴韦林和干扰素β1b)与对照组(n=41,给予洛匹那韦/利托那韦),所有患者均接受常规治疗。结果显示,联合治疗组非危重型COVID-19患者病毒核酸转阴时间[6.5(4~8) dvs.12.5(8~14.8) d,P<0.0010]、临床改善时间[4(3~5) dvs.8(6.5~9) d,P<0.0010]及住院时间[8(6.0~12.5) dvs.15(9~16.0) d,P=0.003]均短于对照组。两组不良反应发生率无显著差异(48%vs.49%)。联合治疗组未报告任何严重不良反应,治疗过程中无患者死亡。
一项非RCT[68]纳入237例COVID-19患者,其中196例口服阿比多尔、洛匹那韦/利托那韦并给予干扰素α2b雾化吸入治疗(联合治疗组),41例口服洛匹那韦/利托那韦并给予干扰素α2b雾化吸入治疗(对照组),所有患者均接受常规治疗。结果显示,联合治疗组病毒核酸转阴时间、住院中位时间均短于对照组[(12.2±4.7) dvs.(15.0±5.0) d,P<0.01;12 dvs.15 d,P<0.05]。治疗过程中,两组急性呼吸窘迫综合征发生率差异无统计学意义(11.7%vs.19.5%,P<0.05)。
一项队列研究[69]纳入73例COVID-19患者,其中39例给予洛匹那韦/利托那韦联合阿比多尔治疗,34例给予洛匹那韦/利托那韦治疗,所有患者均接受常规治疗。结果显示,普通型和重型COVID-19患者单独服用洛匹那韦/利托那韦与联合阿比多尔治疗的病毒核酸转阴率(92.3%vs.97.1%,P=0.618)、病毒核酸转阴时间[(11.5±9.0) dvs.(9.9±7.5) d,P=0.585]、疾病进展发生率(5.1%vs.0%,P=0.495)、胸部CT影像改善率(84.6%vs.91.1%,P=0.489)、住院时间[(14.4±7.9) dvs.(16.0±9.0) d,P=0.431]以及病死率(2.6%vs.2.9%,P>0.99)差异均无统计学意义。该研究未报告不良反应。
另一项队列研究[70]纳入33例COVID-19患者,其中16例口服阿比多尔和洛匹那韦/利托那韦治疗(联合治疗组),17例口服洛匹那韦/利托那韦治疗(对照组),所有患者均接受常规治疗。研究发现,联合治疗组第7天病毒核酸转阴率显著高于对照组(75%vs.35%,P<0.05),且7 d后胸部CT影像改善率亦高于对照组(69%vs.29%,P<0.05)。该研究未报告不良反应发生。
第3项队列研究[71]纳入141例COVID-19患者,其中71例给予阿比多尔和干扰素α2b治疗(联合治疗组),70例给予干扰素α2b治疗(单药治疗组),所有患者均接受常规治疗。研究发现,联合治疗组胸部CT影像改善时间短于对照组(16.7 dvs.19.8 d,P=0.037),但两组病毒核酸转阴时间、住院时间差异无统计学意义(27.4 dvs.23.8 d,P=0.057;24.2 dvs.27.1 d,P=0.056)。治疗过程中,两组AST、ALT或肌酐水平差异亦无统计学意义。联合治疗组13例(18.8%)出现轻度恶心、胃痛,但患者均可耐受而未放弃原治疗方案。
第4项队列研究[72]纳入109例非危重型COVID-19患者,其中51例接受α干扰素联合洛匹那韦/利托那韦治疗,58例接受α干扰素治疗,所有患者均接受常规治疗。联合治疗组第7天临床改善率高于对照组(70.6%vs.48.3%,P<0.05)。尽管联合治疗组病毒核酸转阴中位时间短于对照组,但差异无统计学意义(6.43 dvs.21.79 d,P>0.05)。治疗过程中,联合治疗组不良反应发生率高于对照组(80.4%vs.27.4%,P<0.05)。针对所有不良反应均采用对症治疗或停药,停药后症状可缓解。
推荐理由:当前的证据基于一项RCT、一项非RCT研究和4项队列研究。多数研究证据质量为中等,由于混杂偏倚和样本量不足,研究结论存在争议。由于各研究的研究设计、病情严重程度及联合治疗方案不同,本团队未进行数据合并;此外,由于缺乏空白对照组,研究结果仅能表明联合治疗组优于单一治疗组,不能外推至联合治疗组优于非治疗组。基于纳入研究风险偏倚和结论的不一致性以及任何单独抗病毒药物治疗效果的不确定性,指南专家组无法给出任何抗病毒药物联合治疗的建议,但所有专家均认为不应同时使用3种及以上的抗病毒药物。
5.7 问题16:是否应使用羟氯喹/氯喹(chloroquine,CQ)治疗COVID-19患者以改善临床疗效?
推荐意见:没有证据支持或反对使用HCQ/CQ治疗COVID-19患者(Grade 2C),不建议同时使用HCQ和阿奇霉素(azithromycin,AZ)(Grade 2C)。
证据总结:一项系统评价/Meta分析[73](n=10 659)显示,HCQ不能有效降低病死率(8项观察性研究:RR=0.98,95%CI 0.66~1.46)或减轻急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)的恶化(6项观察性研究:RR=0.90,95%CI 0.47~1.71)。HCQ治疗组与安慰剂组病毒清除率(2项RCTs和3项观察性研究:RR=1.03,95%CI 0.83~1.28)和发热时间(2项RCTs和1项观察性研究:WMD=-0.54 d,95%CI -1.19~0.11)差异无统计学意义。与标准治疗(standard-of-care,SOC)相比,在联合或不联合阿奇霉素的情况下,HCQ可增加心电图异常/心律失常的风险(2项观察性研究:RR=1.46,95%CI 1.04~2.06)。与病毒清除率相关的2项RCTs均为开放性设计。多数研究有对照组,但由于为NRSI设计并缺乏安慰剂对照,存在较高的偏倚风险。
一项系统评价结果显示,使用HCQ或CQ的利弊证据非常弱且相互矛盾。纳入的4项RCTs中,有2项在选择报告结果方面有较高的偏倚风险,另外2项在随机化过程或选择报告结果方面存在问题[74]。
一项开放性设计的多中心、随机平行试验[75]评估150例(轻度/中度或重度)COVID-19患者,其中75例接受HCQ联合SOC治疗(前3 d负荷剂量为1200 mg/d,然后维持剂量为800 mg/d),另75例仅接受SOC。结果显示,两组第28天核酸转阴率相似[85.4%(95%CI 73.8%~93.8%)vs.81.3%(95%CI 71.2%~89.6%)]。HCQ组和SOC组核酸中位转阴时间分别为8 d(95%CI 5~10 d)和7 d(95%CI 5~8 d),差异无统计学意义(HR=0.85,95%CI 0.58~1.23,P=0.34)。此外,两组临床症状缓解中位时间相似(19 dvs.21 d;HR=1.01,95%CI 0.59~1.74,P=0.97)。HCQ组报告了21例不良事件,其中1例疾病进展和1例上呼吸道感染,其他为非严重不良事件,如腹泻和呕吐。
巴西的一项RCT[76]评估了两种剂量CQ的安全性和有效性。高剂量组(n=41):剂量600 mg,每天2次,持续10 d,或总剂量12 g;低剂量组(n=40):第1天负荷剂量900 mg,然后维持剂量450 mg,每天1次,持续4 d,总剂量2.7 g。81例患者中,61例经核酸RT-PCR检测确诊,19例未确诊但有临床和流行病学表现;所有患者均接受AZ治疗。1例患者因出现由CQ引发的横纹肌溶解症而停药。与低剂量组相比,高剂量组出现QTc间隔(QTcF)≥500 ms的比例更高(18.9%vs.11.1%)。高剂量组中,2例(2.7%,2/37)患者在死亡前经历了室性心动过速,无尖端扭转型室速。两组均观察到血红蛋白减少(分别下降19.2%、22.2%)及肌酐升高(分别增高39.1%、46.7%)。两组在血液学或肾脏毒性方面无明显差异。高剂量组致死率为39.0%(16/41),低剂量组为15.0%(6/40)。
美国的一项队列研究[77]评估807例COVID-19患者,其中HCQ组198例,中位年龄71(62~76.8)岁;HCQ+AZ组214例,中位年龄68(59~74)岁;无HCQ组395例,中位年龄70(59~77)岁。3组机械通气率分别为19.0%、20.5%和19.9%(P=0.94)。HCQ组全因死亡风险高于无HCQ组(校正后HR=1.83,95%CI 1.16~2.89,P=0.009),但HCQ+AZ组与无HCQ组差异无统计学意义(校正后HR=1.31,95%CI 0.80~2.15,P=0.28)。经倾向评分调整后,HCQ组(校正后HR=1.19,95%CI 0.78~1.82,P=0.42)、HCQ+AZ组(校正后HR=1.09,95%CI 0.72~1.66,P=0.69)与无HCQ组的机械通气风险相似。
推荐理由:超过70%的指南专家组成员认为,基于以上证据及其质量和临床医师的经验,没有一致的数据支持使用或不使用HCQ。目前也没有足够的证据支持HCQ联合AZ比单独使用HCQ能够获得更好的临床结局,这两种药物都可能导致Q-T延长,因此,本团队目前不推荐这种组合,但对同时发生细菌感染的患者应行抗生素治疗。迄今为止,至少有71项针对COVID-19的HCQ/CQ临床试验已经注册;当有可能改变当前建议的新证据出现时,本团队将更新建议。
5.8 问题17:白介素-6抑制剂是否应该用于治疗COVID-19患者以改善临床结局?
推荐意见:没有足够的证据支持或反对使用白介素-6抑制剂治疗COVID-19患者(Grade 2C)。
证据总结:一项包括16项研究(13项回顾性队列研究和3项前瞻性队列研究)3641例患者的Meta分析[78]显示,在标准治疗的基础上使用托珠单抗(tocilizumab,TCZ)可降低重型COVID-19患者的病死率(OR=0.57,95%CI 0.36~0.92,P=0.02)。该研究未报告任何不良反应。然而,该证据为低质量证据,有降级的因素:纳入的研究中包含重要的混杂因素(年龄、合并症的差异,以及随访时间不一致)和显著的异质性(I2=80%)。
以下研究未包括在上述Meta分析中:
一项NRSI[79](n=29vs. n=24)显示,在校正年龄和机械通气后,使用TCZ(400 mg,静脉给药,2次)与ICU中COVID-19患者的病死率无关(OR=3.97,95%CI 0.28~57.2,P=0.3)。该研究未报告与TCZ直接相关的不良反应。
一项倾向性评分配对队列研究[80](n=74vs. n=148,重型/危重型患者)发现,使用TCZ与总体生存率增高相关(HR=0.499,95%CI 0.262~0.952,P=0.035),但使用TCZ的患者住院时间较长(剂量8 mg/kg;HR=1.658,95%CI 1.088~2.524,P=0.019)。此外,使用TCZ的患者中32.4%出现感染性并发症,14.9%伴有严重不良反应(脓毒症、念珠菌血症、肺脓肿或硬膜外脓肿)。
另一项倾向性评分配对队列研究(n=84vs. n=84,重型患者,单剂量400 mg)发现,使用TCZ在改善总体生存率方面有优势(校正后HR=0.26,95%CI 0.135~0.51,P=0.0001),且未报告任何不良反应[81]。一项队列研究发现,采用TCZ治疗(剂量8 mg/kg),降低合并高血糖的COVID-19患者(n=31)发生严重后果风险的效果不如血糖正常患者(n=47)(P<0.009),且未报告任何不良反应[82]。
一项小样本的开放性队列研究[83](n=28vs. n=28)随访8d发现,SOC组与沙利鲁单抗(sarilumab)组重型COVID-19患者的总体临床改善率、病死率和不良反应(感染、中性粒细胞减少、肝酶升高和血栓栓塞)发生率无显著差异(均P>0.05)。此外,沙利鲁单抗组(400 mg,静脉给药)中出现轻微肺实变的患者恢复较快(P=0.002)。
另一项倾向性评分配对队列研究(n=30vs. n=30)显示,司妥昔单抗(siltuximab,11 mg/kg,静脉给药)治疗COVID-19呼吸衰竭患者的30 d病死率显著低于标准治疗组(HR=0.462,95%CI 0.221~0.965,P=0.0399),且未报告与研究药物相关的不良反应[84]。
上述证据多为回顾性研究,样本量较小,且包含较多的混杂因素,如年龄、性别、疾病严重程度和合并症等。虽然多数研究使用了适当的方法/模型来控制可测量的混杂因素,但混杂因素仍然存在。证据总体质量处于中等或较低水平,未发现升级因素。
推荐理由:虽然Meta分析作为高质量证据已经表明使用TCZ可以降低COVID-19患者的病死率,但其方法学质量不高,证据质量会降级。TCZ是白介素-6抑制剂的代表之一,越来越多的证据表明其可降低COVID-19患者的病死率,但由于研究类型(主要为观察性研究)和小样本量的限制,仍需要高质量的研究进一步验证TCZ的有效性。
5.9 问题18:白介素-1抑制剂是否应该用于治疗COVID-19患者以改善临床结局?
推荐意见:没有足够的证据支持或反对使用白介素-1抑制剂治疗COVID-19患者(Grade 2C)。
证据总结:一项队列研究[85](n=52vs. n=44)通过多变量分析发现,接受阿那白滞素(anakinra)治疗(皮下注射100 mg,2次/d,持续3 d;然后100 mg/d,持续7 d)的重型COVID-19患者,需要有创机械通气支持或发生死亡的人数较标准治疗组明显减少(HR=0.22,95%CI 0.10~0.49,P=0.0002)。此外,两组肝酶升高、凝血障碍发生率相似,这不可能是由阿那白滞素引起的。
一项队列研究[86](n=29vs. n=16)显示,接受阿那白滞素治疗的普通型或重型COVID-19患者(5 mg/kg,皮下注射,2次/d)的存活率较SOC组高(90%vs.56%,P=0.009)。此外,两组脓毒症、肝酶升高和血栓栓塞发生率相似。
由于所列证据均为回顾性队列研究,样本量较小,虽然多数研究使用了适当的方法/模型来控制可测量的混杂因素,但混杂因素仍然存在。证据总体质量处于中等或较低水平,且未发现升级因素。
推荐理由:到目前为止,尚未有足够的证据支持或反对在COVID-19患者中使用白介素-1抑制剂。同时,指南专家组成员亦无使用白介素-1抑制剂的临床经验。
5.10 问题19:是否应该使用糖皮质激素治疗COVID-19患者以改善临床结局?
推荐意见:不建议对普通型COVID-19患者使用糖皮质激素治疗(Grade 2B)。重型或危重型COVID-19患者若病情急剧恶化,可考虑使用小剂量、短疗程的糖皮质激素治疗(Grade 2B)。
实施要点:①甲泼尼龙(methylprednisolone,MP)可考虑以小剂量、短疗程使用[1~2 mg/(kg.d),约3 d];②地塞米松可考虑联合使用,单日剂量6 mg,1次/d(口服或静脉注射),最多使用10 d。
证据总结:一项系统评价[87](包括11项回顾性研究,n=4168;1项RCT,n=6425)表明,与使用高剂量类固醇相比,使用低剂量类固醇的益处更大。此外,明智地使用皮质类固醇可改善重型和危重型COVID-19患者的一些指标,包括缩短住院时间,防止呼吸机参数恶化、进展为ARDS甚至死亡,加快体温正常化和改善氧合状态,减少插管和随后使用机械通气的发生率,但这些回顾性研究的结果不一致,很难推断皮质类固醇的确切保护作用。其中,RECOVERY试验(在176家NHS医院的多中心RCT,包含6425例COVID-19患者,其中2104例每天服用6 mg地塞米松,持续10 d,其余4321例接受常规治疗)发现,在应用有创机械通气的COVID-19患者中,使用地塞米松可使28 d病死率降低35%(29.0%vs.40.7%;RR=0.65,95%CI 0.51~0.82,P<0.001);在仅应用氧气治疗(用/不用无创机械通气)的患者中,使用地塞米松可使28 d病死率降低20%(21.5%vs.25.0%;RR=0.80,95%CI 0.70~0.92,P=0.002);而在轻型患者中,使用地塞米松未观察到任何益处(17.0%vs.13.2%;RR=1.22,95%CI 0.93~1.61,P=0.14),且未报告任何不良反应。在该系统评价中,纳入的大多数队列研究的样本量较小,在类固醇的种类选择、使用剂量、使用时间以及联合使用广谱抗生素和抗病毒药物方面具有高度异质性。但这项多中心、大样本的RCT仍然清楚地证实糖皮质激素治疗在降低病死率方面的有效性,尤其对于重型患者。
以下研究不包括在上述系统评价中:
一项回顾性队列研究[纳入115例COVID-19患者,其中糖皮质激素组73例,1~3 mg/(kg.d),使用3~10 d;对照组42例],经过多因素分析(校正疾病严重程度)发现,与常规治疗相比,糖皮质激素组的病死率或进入ICU的风险增高了2.155倍,虽无统计学意义,但糖皮质激素组发生更多不良反应(32.9%vs.11.9%,P=0.013)[88]。
另一项回顾性队列研究[纳入72例COVID-19患者,其中糖皮质激素组51例,0.75~1.50 mg/(kg.d);对照组21例]发现,两组从发病到痰液核酸转阴的中位时间无显著性差异(P>0.05),且会引起不良反应,如短暂性血糖增高、低钾血症、痤疮样皮疹和高血压[89]。
一项基于倾向性评分分析的回顾性队列研究(132例非重型COVID-19患者,匹配皮质类固醇组35例,初始MP剂量40 mg/d,持续8~12 d,匹配对照组35例)发现,皮质类固醇组住院时间和病毒排出时间延长、发热时间缩短,但无显著差异,且未报告任何不良反应[90]。
一项多中心、部分随机、偏好、开放性试验[91](85例COVID-19患者,其中MP组56例,对照组29例)表明,短疗程的MP治疗对改善重型COVID-19的临床结局有利,可降低进入ICU、使用无创通气或死亡的复合终点的风险(RR=0.55,95%CI 0.33~0.91,P=0.024)。试验虽未观察到严重的不良反应,但MP组发生高血糖现象较常见。
一项回顾性队列研究(205例非ICU患者,其中皮质类固醇组60例,对照组145例)发现,与未接受皮质类固醇的患者相比,接受皮质类固醇治疗的患者出现主要结局(包括转入ICU、插管或死亡)的可能性较小(校正后HR=0.15,95%CI 0.07~0.33,P<0.001),且未报告任何不良反应[92]。
一项回顾性队列研究[93](463例COVID-19患者,其中糖皮质激素组396例,对照组67例)显示,糖皮质激素组患者的生存率高于对照组(HR=0.51,95%CI 0.27~0.96,P=0.044),尤其是普通型或重型ARDS患者(OR=0.23,95%CI 0.08~0.71,P=0.014)。初始方案1 mg/(kg.d)的MP治疗与类固醇脉冲治疗患者的住院病死率无明显差异(OR=0.88,95%CI 0.449~1.726,P=0.71),且未报告任何不良反应。一项多中心、观察性、纵向研究[94](173例重型COVID-19患者,其中MP组83例,对照组90例)显示,早期给予延长MP治疗与显著降低病死率(校正HR=0.29,95%CI 0.12~0.73,P=0.005)及降低对呼吸机的依赖性[(24.0±9.0) dvs.(17.5±12.8) d,P=0.001]有关,且两组并发症发生率相似(P=0.84)。
一项回顾性队列研究(72例患者,其中TCZ+MP组56例,TCZ组16例)发现,在接受TCZ治疗的患者中使用MP可降低死亡风险(RR=0.20,95%CI 0.08~0.47,P<0.01),且未报告任何不良反应[95]。
上述证据多为回顾性队列研究,样本量较小,包含较多混杂因素,如年龄、性别、疾病严重程度和合并症等。尽管多数研究使用了适当的方法/模型以控制可测量的混杂因素,但混杂因素仍然存在。证据总体质量处于中等或较低水平,未发现升级因素。
推荐理由:尽管回顾性研究的结果不一致,且很难推断皮质类固醇的确切保护作用;但作为世界上最大的研究COVID-19的RCT之一,RECOVERY试验发现地塞米松治疗可明显改善临床结局,尤其是对于重型患者。MP容易获得,价格低廉,同时短期使用激素时,发生与药物相关的不良反应较少。70%以上的指南专家组成员在综合考虑其效果,权衡利弊后,根据临床证据认为当重型或危重型患者病情急剧恶化时,可考虑使用小剂量糖皮质激素。
5.11 问题20:清肺排毒汤是否可用来治疗COVID-19患者以改善临床结局?
推荐意见:轻型、普通型COVID-19患者可考虑使用清肺排毒汤治疗(基于共识的建议)。
实施要点:①组成部分:麻黄9 g,炙甘草6 g,苦杏仁9 g,生石膏15~30 g(先煎),桂枝9 g,泽泻9 g,猪苓9 g,白术9 g,茯苓15 g,柴胡16 g,黄芩6 g,姜半夏9 g,生姜9 g,紫菀9 g,款冬花9 g,射干9 g,细辛6 g,山药12 g,枳实6 g,陈皮6 g,藿香9 g;②水煎服,每日1剂,服2次,每次200 ml,饭后40 min温服,3 d为1个疗程,根据患者临床表现可服用4个疗程。
证据总结:一项队列研究[96]显示,与常规抗病毒治疗(奥司他韦、阿比多尔、洛比那韦/利托那韦)(n=30)相比,清肺排毒汤联合常规抗病毒药物治疗(n=30)患者的住院时间[(13.633±0.398) dvs.(16.433±0.295) d,P<0.05]、退热时间[(2.346±0.852) dvs.(3.852±0.774) d,P<0.05]、肺部CT好转所需时间[(6.571±0.497) dvs.(8.800±0.395) d,P<0.05]均显著缩短,病情加重情况(20.0%vs.40.0%,P>0.05)和治愈率(90.0%vs.83.3%,P>0.05)无显著差异。联合用药组出现的不良反应较少[1例(恶心)vs.3例(恶心2例、腹泻1例)]。
推荐理由:已有的证据非常薄弱,但考虑到患者的偏好、可接受性、可行性,经过利弊权衡,70%以上的指南专家组成员认为清肺排毒汤可能是COVID-19患者的一种治疗选择,给予基于共识的推荐意见。 3个正在进行的临床试验的结果将为这种治疗方案提供证据。但考虑到一些国家中医药治疗缺乏可推广性,缺乏可信的证据,本团队最终将其确定为“基于共识的建议”。
5.12 问题21:连花清瘟颗粒/胶囊是否可用来治疗COVID-19患者以改善临床结局?
推荐意见:推荐连花清瘟联合常规疗法(包括营养支持治疗、对症治疗、抗病毒和抗菌治疗)治疗轻型、普通型COVID-19患者(Grade 2C)。
实施要点:连花清瘟颗粒/胶囊,口服6 g/1.4 g,3次/d,疗程14 d。
证据总结:一项RCT[97]显示,与阿比多尔治疗组(148例轻型患者)相比,连花清瘟颗粒联合阿比多尔(147例轻型患者)治疗7 d后,中医证候积分(基于中医证候评定量表)明显降低(P<0.05),治疗总有效率(显效率+有效率)显著提高(81.0%vs.64.9%,P<0.05),肺部CT改善率差异无统计学意义(69.4%vs.62.8%,P>0.05);两组均未出现严重不良反应。
另一项RCT[98]显示,与常规治疗(氧疗、抗病毒治疗和对症治疗)(n=142)相比,连花清瘟胶囊联合常规疗法(n=142)治疗14 d后,恢复率、肺部CT改善率、临床治愈率显著提高(91.5%vs.82.4%,P<0.05;83.8%vs.64.1%,P<0.001;78.9%vs.66.2%,P<0.05),中位症状恢复时间、退热时间显著缩短(7 dvs.10 d,P<0.001;2 dvs.3 d,P<0.001);然而,两组转为严重患者的比例及病毒检测结果无显著差异(P>0.05),且均未出现严重不良反应。
一项NRSI[99]表明,与常规疗法(营养支持治疗、对症治疗、抗病毒治疗和抗菌治疗)(51例普通型患者)相比,连花清瘟颗粒联合常规疗法(51例普通型患者)治疗7 d后,退热率显著提高(83.7%vs.61.0%,P<0.05),COVID-19重症转化率显著降低(7.84%vs.21.57%,P<0.05),肺部CT改善率无显著差异(54.9%vs.45.1%,P>0.05)。
另一项NRSI[100]显示,与常规疗法(营养支持治疗、对症治疗、抗病毒治疗和抗菌治疗)(21例普通型患者)相比,连花清瘟颗粒联合常规疗法(21例普通型患者)治疗后,退热率显著提高(85.7%vs.57.1%,P<0.05),发热持续时间缩短但差异无统计学意义[(4.6±3.2) dvs.(6.1±3.1) d,P>0.05)。
第3项NRSI[101]表明,与常规疗法(营养支持治疗、对症治疗、抗病毒治疗和抗菌治疗)(38例疑似病例)相比,连花清瘟颗粒联合常规疗法(63例疑似病例)治疗10 d后,退热率显著提高(86.7%vs.67.7%,P<0.05),病情加重情况无显著差异(6.4%vs.15.8%,P>0.05),且未见不良反应发生。
推荐理由:在权衡利弊后,考虑到证据的质量、患者的偏好、可接受性和可行性,指南专家组对连花清瘟颗粒/胶囊联合常规疗法治疗COVID-19给出弱推荐。
5.13 问题22:是否应该使用恢复期血浆治疗COVID-19患者以改善临床结局?
推荐意见:没有足够的证据支持或反对使用恢复期血浆治疗重型和危重型COVID-19患者(Grade 2B)。
证据总结:一项Cochrane系统评价[102]探讨了恢复期血浆对COVID-19患者的有效性,对照组接受SOC(检索至2020年6月4日)。其中一项NRSI(21例受试者,其中6例接受了恢复期血浆)结果表明,恢复期血浆对出院时的全因病死率没有影响(RR=0.89,95%CI 0.61~1.31,P=0.56)。一项RCT(103例受试者,其中52例接受了恢复期血浆)和一项NRSI(195例受试者,其中39例接受了恢复期血浆)结果表明,恢复期血浆可能不会延长死亡时间(RCT:HR=0.74,95%CI 0.30~1.82;NRSI:HR=0.46,95%CI 0.22~0.96),且不能改善第7天(RCT:RR=0.98,95%CI:0.30~3.19)、第14天(RCT:RR=1.85,95%CI 0.91~3.77;NRSI:RR=1.08,95%CI 0.91~1.29)和第28天(RCT:RR=1.20,95%CI 0.80~1.81)的临床症状。该系统评价纳入了一项RCT、3项NRSI和10项无对照组的NRSI评估恢复期血浆的安全性,其中13项(201例受试者)报告了3级或4级不良反应,多为过敏或呼吸道反应;一项非对照的NRSI(5000例参与者)仅报告了恢复期血浆输注后4 h内发生的严重不良反应。该系统评价报告了15例死亡,其中4例归类为潜在,可能或绝对与输血有关。由于研究设计、受试者类型以及其他先前或同时进行的治疗,几乎所有纳入研究均显示出明显的偏倚风险,如纳入的RCT对参与者和研究人员未施盲,选择性报告偏倚以及数据不完整。
荷兰的一项RCT[103]在招募了86例患者入组后被提前终止。采用基于网络的随机分组系统将患者分为恢复期血浆组(n=43)和SOC组(n=43)。结果表明,恢复期血浆对总体病死率没有影响(OR=0.95,95%CI 0.20~4.67,P=0.95),且不会缩短出院时间(HR=0.88,95%CI 0.49~1.60,P=0.68)。该研究未观察到血浆相关的严重不良反应。
另一项RCT[104](49例参与者,其中21例接受了恢复期血浆)显示,恢复期血浆可缩短感染持续时间约4 d[(19.3±6.9) dvs.(23.42±6.4) d,P<0.05]以及降低病死率(1/21vs.8/28,P<0.05)。
推荐理由:没有足够的证据支持或反对使用恢复期血浆。大多数研究没有显示出任何益处,证据质量很低。中国已对重型和危重型患者使用恢复期血浆制定专家共识。在不同情况下,不同国家可以发表自己的共识声明。由于血浆成分复杂,可能存在输血相关的风险,如过敏和传染病的传播。因此,康复过程、血浆收集、制备、储存、检查和应用的整个过程必须符合质量保证体系以及药品生产质量管理规范。但是没有足够的数据支持或反对使用恢复期血浆。关于COVID-19恢复期血浆的临床试验正在进行中。
5.14 问题23:肺移植是否可以用于治疗COVID-19患者以改善临床结局?
推荐意见:肺移植可能是COVID-19终末期患者的一种治疗选择(基于共识的建议)。
实施要点:
首先,需对以下3点进行评估以确定是否可成为肺移植候选人:①尽管有医疗支持,但已证实为难治性不可逆性呼吸衰竭;②对多个部位的样本进行连续病毒核酸检测,结果为阳性转阴性;③不存在其他可能是肺移植禁忌证的器官系统功能障碍。
其次,对医疗团队进行保护:①外科医师、护士、麻醉师和心肺内科医师必需穿戴正压头罩;②穿戴头罩利于外科医师保持视野清晰;③充分考虑外科医师的身体需求和防护服的合理使用,术中轮换计划是保证手术期间最佳性能的必要条件。
第三,多学科团队协作(重症监护室、呼吸科、感染科和放射科)十分必要,以尽量减少对COVID-19患者肺损伤不可逆转的误判。
证据总结:两项病例系列研究报告了5例COVID-19患者接受抗病毒、激素、恢复期血浆和体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)支持治疗后,病情仍继续恶化[105-106]。接受肺移植手术后,4例终末期COVID-19患者生命体征稳定,胸片显示移植肺清晰,ECMO移除成功[105-106]。然而,另1例右肺移植正常,但在左肺移植过程中,突然出现心室颤动,心脏停止跳动,立即心脏复苏,经上、下腔静脉和升主动脉插管建立体外循环,后续进行紧急心脏移植,心脏恢复到正常节律,但胸腔出血和吻合口无法在后续5 h内通过缝合和凝血来处理,移植心脏再次停止跳动,患者被宣布死亡[105]。
此外,另一病例报告[107]描述,1例COVID-19患者在接受高流量鼻氧、甲泼尼龙、阿比多尔、哌拉西林和他唑巴坦治疗后,尽管痰液和支气管肺泡灌洗液多次核酸检测均为阴性,但由于肺实变合并嗜麦芽窄食单胞菌感染,病情继续恶化。然后接受ECMO治疗和双侧肺移植。术后移除ECMO,患者的一般情况稳定,但在肺移植术后发生ST段抬高性心肌梗死,经皮冠状动脉介入治疗后心电图ST段恢复,心肌肌钙蛋白Ⅰ逐渐下降。
推荐理由:通常针对干预性临床问题,指南专家组不考虑病例报告或病例系列研究作为证据来源。但肺移植是一个复杂的治疗过程,不可能期望通过一个RCT来研究其是否有效。故基于目前证据,指南专家组认为,肺移植可能是在无其他治疗方法时的终末期COVID-19患者的一种治疗选择。
5.15 问题24:有创或无创通气的适应证有哪些?
推荐意见:对于高流量吸氧(high-flow nasal oxygen,HFNO)或无创通气(non-invasive ventilation,NIV)的患者,在短时间内(1~2 h)其病情没有改善甚至恶化或氧合指数≤150 mmHg时,应及时进行气管插管和有创机械通气(Grade 1C)。
实施要点:
(1)密切监测患者的一般状况、生命体征、呼吸状况,尤其是氧合指数的变化。
(2)当鼻导管或面罩氧气治疗无效或患者出现低氧性呼吸衰竭时,应选择HFNO或NIV。
(3)对于有创机械通气,应采用ARDS肺保护通气策略:低潮气量(4~6 ml/kg)和低平台压(<30 cmH2O),适当的呼气末正压(positive end expiratory pressure,PEEP)。对于中度至重度ARDS患者(氧合指数<150 mmHg),应使用较高的PEEP,在机械通气的前48 h,每天进行俯卧位通气超过12 h,同时进行深度镇静镇痛。对于严重急性缺氧性呼吸衰竭的患者,应注意预防机械通气后呼吸机相关肺损伤。
证据总结:专家证据表明,当给予标准氧气治疗无法缓解呼吸窘迫和(或)低氧血症时,可考虑采用HFNO或NIV。如果病情在短时间内(1~2 h)没有改善甚至恶化,则应尽快进行气管插管和有创机械通气。对于合并急性低氧性呼吸衰竭的成人COVID-19患者,建议SpO2维持≤96%。对于合并急性低氧血症性呼吸衰竭的成人COVID-19患者,建议使用HFNO代替常规氧气疗法或NIV,并密切监测呼吸状况,若病情恶化应尽早插管。
推荐依据:几乎所有指南专家组成员均认为,在权衡利弊后,对于HFNO和NIV没有改善甚至恶化的重型和危重型COVID-19患者,建议采用机械通气作为抢救方法。但不同国家使用有创或无创通气的适应证可能略有不同。
5.16 问题25:使用体外膜肺氧合(ECMO)的适应证是什么?
推荐意见:建议使用ECMO治疗危重型COVID-19患者,使用过程中必须密切监测患者的生命体征。ECMO应在以下情况下使用:①早期可逆的病情危重患者(如病程短于7 d的重型患者);②严重低氧血症:采用优化的PEEP时,使用神经肌肉阻滞剂和俯卧位通气后氧合指数<100 mmHg;③使用优化的机械通气时发生过度代偿性呼吸性酸中毒(pH<7.15);④使用肺保护性通气时吸入压力过大(平台压力>30 cmH2O); ⑤采用优化的机械通气设置,机械功率≥27 J/min;⑥使用优化的机械通气设置,由于急性肺源性心脏病存在右心功能不全(Grade 1C)。
实施要点:①当患者处于危重COVID-19的早期阶段时,使用ECMO至关重要;②应采用多团队协作以提供对COVID-19患者的精细管理。
证据总结:专家证据表明,严重ARDS和俯卧位通气不良的患者应尽快考虑使用ECMO。指征为:①当吸入氧浓度>90%时,氧合指数<80 mmHg持续3~4 h以上;②呼吸道平台压力≥35 cmH2O。
推荐依据:在权衡利弊之后,几乎所有指南专家组成员同意在上述指征出现时使用ECMO。
6 出院管理
6.1 问题26:COVID-19患者的出院标准是什么?
推荐意见:患者符合以下标准后方可出院:①体温恢复正常3 d以上;②呼吸道症状明显好转;③肺部影像学检查显示病变明显吸收;④连续两次痰液、鼻咽拭子等呼吸道标本核酸检测阴性(两次采样时间至少间隔24 h)(基于共识的建议)。
实施要点:应同时考虑患者的年龄、并发症、临床分型以及其他因素(如医院能力)等来决定是否需要增加粪便核酸检测和(或)血清学检测作为出院标准的一部分。
推荐理由:虽然没有研究证据,但指南专家组成员认为来自专家意见的出院标准是合理的,且该标准在中国已取得了良好的效果。但仍不清楚是否需要增加粪便核酸检测和(或)血清学检测作为出院标准的一部分。不同国家可能会根据其国情制定略有不同的出院标准。
6.2 问题27:核酸检测复阳的COVID-19出院患者的胸部影像学检查有何表现?
推荐意见:大多数核酸检测复阳的COVID-19出院患者的胸部CT无进展性影像学表现(Grade 2C)。
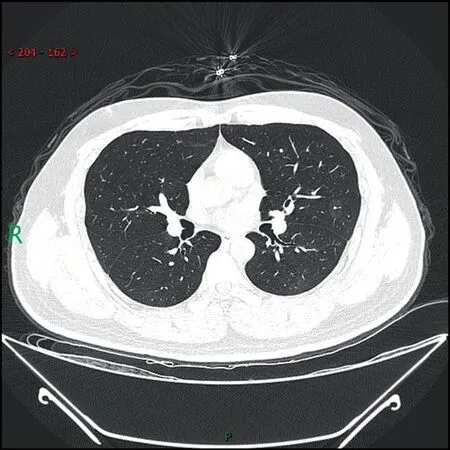
图6 核酸检测COVID-19复阳患者胸部CTFig.6 Chest CT of SARS-CoV-2 reactivation patient
实施要点:核酸检测复阳的COVID-19出院患者应进行胸部CT检查。
证据总结:有7篇文献共纳入279例核酸检测复阳的COVID-19出院患者。所有患者均接受了胸部CT检查,其中29.4%~90.2%的患者胸部CT显示病灶较前吸收,8%~32%的患者未出现活动性进展。其中1例患者症状复发,复查胸部CT表现为双肺上叶模糊影,在病情恢复期左肺病灶更加显著,但在住院后期病灶较前好转[108-114]。
推荐理由:根据上述低质量的证据,大多数患者未发现进展性影像学改变。指南专家组成员认为后续仍需要大样本研究加以证实。
武汉大学中南医院1例COVID-19复阳患者的胸部CT图像如图6所示(经该医院伦理委员会批准)。
6.3 问题28:出院后RT-PCR检测显示再次阳性的患者的管理措施?
推荐意见:第一次出院后,如果患者的RT-PCR检测结果由阴性转为阳性,患者应重新隔离并根据其临床表现决定是否再次入院。医师需根据患者病情给予其出院前有效的抗病毒治疗。如果患者的肺部影像与出院时相比无明显恶化,且3次痰液和粪便标本的核酸检测为阴性(检测间隔时间≥24 h),则可居家隔离并再次按照要求对其随访(基于共识的建议)。
实施要点:复阳患者应联合使用痰液和粪便标本进行核酸检测(至少有1项核酸检测结果来自粪便标本)。
证据总结:一项横断面研究[115]发现,即使鼻咽拭子检测阴性,仍有部分患者出院后6~11 d在其粪便中检测出病毒RNA。因此,对于出院患者,粪便标本的检测可能比鼻咽拭子检测更有效。
一项队列研究[116]显示,3%(23/651)的出院患者在随访期间RT-PCR检测再次阳性,从出院到复阳的时间为15 d。在这些复阳患者中,12例(52%)在第1次住院时为普通型,9例(39%)为重型,2例(9%)为危重型。50%的患者有IgG抗体,30%的患者有IgM抗体。对于复阳患者,应在RT-PCR检测的基础上增加抗体检测。
一项横断面研究[117]发现,15.9%(11/69)的出院患者RT-PCR检测再次呈阳性,从出院到再次检测阳性的中位时间为14 d。11例复阳患者中有10例为轻型或普通型,1例为危重型,表明出院患者可能需要严格的自我隔离方案和更长的随访时间。
另一项来自中国的横断面研究显示,14.5%(25/172)的患者在出院后5~13 d RT-PCR检测再次呈阳性,因此应重新评估或制定出院标准[114]。
一个来自中国的病例报告发现,部分出院患者在停用抗病毒药物后病情再次加重,这可能是康复期患者复阳的原因之一。建议结合患者的病毒核酸检测结果和肺部CT表现来确定患者是否可以停止服用抗病毒药物[118]。
推荐理由:为了加强疫情防控,基于有限的证据和临床经验,超过70%的指南专家组成员建议复阳患者在出院时RT-PCR检测次数从2次增加到3次。因为所有出院患者都遵循了严格的自我隔离方案,所以认为复阳原因不太可能是由于再感染。不同国家对于出院后RT-PCR检测阳性的复阳患者可能制定了不同的管理措施。本团队未发现任何试验来支持出院后复阳患者的管理措施,因此给出了“基于共识的建议”。
6.4 问题29:出院后是否需要进行RT-PCR复检以监测COVID-19患者?
推荐意见:出院患者可继续隔离2周,并进行随访。RT-PCR检测可以在出院后2周和4周进行(基于共识的建议)。
实施要点:一般情况下,出院患者会选择居家隔离。若政府或社区设立指定集中隔离区,则患者可在该区域接受治愈后的继续医学观察。
证据总结:同问题28。
推荐理由:患者出院后可能有复阳的风险,增加了病毒继续传播的潜在可能性。因此,需要对出院患者继续进行监测,超过70%的指南专家组成员达成了共识意见,但是出院后隔离方式以及检测频次和时间,不同国家可能会根据各国的情况制定不同的计划。
7 指南实施工具
本团队制作了两张指南实施路径图,分别为药物预防和治疗部分推荐意见路径图(图7)、诊断和出院管理部分推荐意见路径图(图8),希望可帮助临床医师快速获得和使用本指南的推荐意见。
8 讨 论
本更新版指南的推荐意见基于现有的最佳证据,为全球临床医师提供了有关COVID-19预防性药物使用、诊断、治疗和出院管理的参考。
胸部CT或X线是RT-PCR检测的重要替代检查方法,具有典型胸部CT或X线表现的疑似COVID-19患者建议予以隔离,并作为临床诊断者进行治疗。目前,在世界范围内核酸检测已成为确诊的金标准,此外,影像学检查和流行病学史通常被视为辅助诊断方法。虽然使用影像学证据确诊病毒性肺炎可能是诊断和监测COVID-19的重要替代方法,但也带来了一些问题,如依据影像学纳入标准可能对部分普通肺炎患者造成误诊。因此,临床诊断标准还需要包括后期的核酸检测结果[119-120]。
疫情暴发以来,研究者及临床实践者致力于评估或研发用于治疗COVID-19的药物,全世界已有超过1000项试验正在进行。多数COVID-19相关临床试验的药物都是针对流感、HIV、埃博拉或SARS/MERS研发的“旧药新用”的抗病毒药物。尽管本指南对使用瑞德西韦给予弱推荐,但瑞德西韦对生存的影响仍然未知。目前尚无可用于预防SARS-CoV-2感染的人类疫苗,但近120种候选疫苗正在研发中(截至2020年7月31日)。最近,一项随机、双盲、安慰剂对照的Ⅱ期临床试验和一项1/2期单盲RCT发布的初步报告让人们看到了希望[121-122]。
本指南遵循GRADE基本方法来评估证据质量及制订推荐意见,使用过程中可根据实际情况进行调整。部分推荐意见依据样本量有限的临床试验而制定,通常当公开的证据仅限于少量的小型试验时,应怀疑有无发表偏倚的可能性。由于本指南制订时采用了严格全面的检索策略,单个研究结局下纳入的研究数量常少于10项,考虑到几乎每天都有新的研究持续发布,故未再进行发表偏倚的漏斗图评估或其他定量评估,但本团队综合考虑认为发表偏倚的可能性相对较小。由于证据的研究样本量有限,且研究间有一定的异质性,故证据的合成较困难。对于诊断问题,纳入研究大部分为诊断测试准确性的研究,无法衡量诊断策略对患者或人群最终结局的影响。
本指南存在一定局限性。首先,专家组不包括患者代表,因此,不能直接获取患者价值观相关的信息。其次,由于一些国家的政府负担了COVID-19患者的全部费用,因此未考虑将成本效益作为研究问题。由于人力资源、资金或医疗资源分布不同,对低收入和中等收入国家的个人和社区的推荐强度可能与高收入国家有所不同[123],但考虑到目前证据有限,本团队无法给出更为具体的推荐意见,不同国家可能会根据自己的情况制定不同的推荐意见。在中低收入国家,结构性不平等和资源有限为指南的使用增加了障碍[124], 本团队未提出更具体的实施策略。第三,由于资源和时间的限制,本指南只涵盖了29个研究问题,可能遗漏其他更有意义的内容。
在有限及紧急的时间内,如何尽量减少指南制订中的偏倚,保证严谨性,从而制定高质量和有影响力的指南[125]是本指南专家组成员努力思考的重要问题。相信这一综合的循证指南将有助于全球临床医师更好地诊疗COVD-19患者。最后,本指南的实施应基于资源的可用性及患者意愿等因素。当有新的证据出现并可改变当前的推荐意见时,本团队会及时予以更新。
致谢:感谢28位临床一线医师完成在线调查并提供宝贵的建议和意见。
关于本指南附件的说明:因附件不影响本指南的阅读与使用,加之受中文印刷版的空间限制,未提供翻译版,所有附件均可从英文原版官网下载https://mmrjournal.biomedcentral.com/articles/10.1186/s40779-020-00270-8;中文版检索策略和利益冲突声明表也可从本指南计划书中(http://www.jnewmed.com/content/6154)获取。
利益冲突声明报告:程真顺报告称参加或主持了瑞德西韦的COVID-19研究。高亚东报告参与或主持了两项肠甘草胶囊与甘草酸二铵联合维生素C和羟氯喹治疗COVID-19的研究。夏剑报告称参加或主持了两项针对重症患者的ECOM治疗研究和COVID-19预后预测模型。杨启文报告参与或主持了快速核酸检测试剂盒临床评估的研究。张笑春报告称参与或主持了COVID-19技术研究和集成应用项目的研究。袁玉峰报告称参加或主持了3项有关COVID-19的临床诊治和预后,中医治疗和医疗物品快速消毒的研究。尹训涛报告称参与或主持了COVID-19的CT成像诊断研究。余追报告称参与或主持了COVID-19危重患者的治疗研究。李宏军报告称参与或主持了COVID-19放射学机器学习的研究。王行环主持了法匹拉韦随机对照试验,并得到了国家重点研究发展计划(2020YFC0844400)的支持。王行环、曾宪涛和靳英辉报告称参与或主持了医护人员感染的研究项目,该项目得到了湖北省应急突发事件专项资金(2020FCA008)的支持。所有参与人均报告未拥有相关利益公司股票,作为其顾问或获得其研究资金。
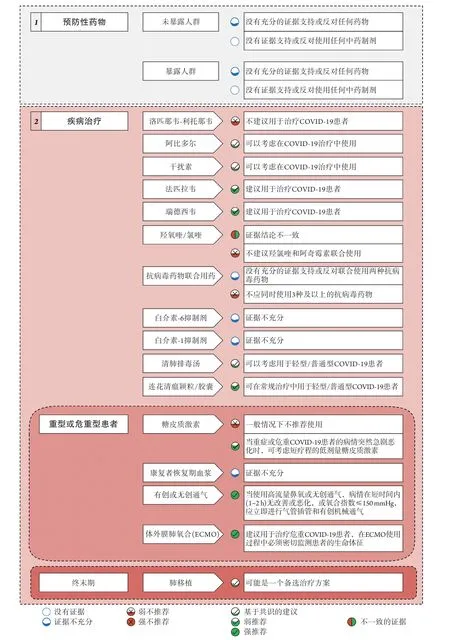
图7 COVID-19药物预防和治疗部分推荐意见路径图Fig.7 Implementation tool for diagnosis section and discharge management section
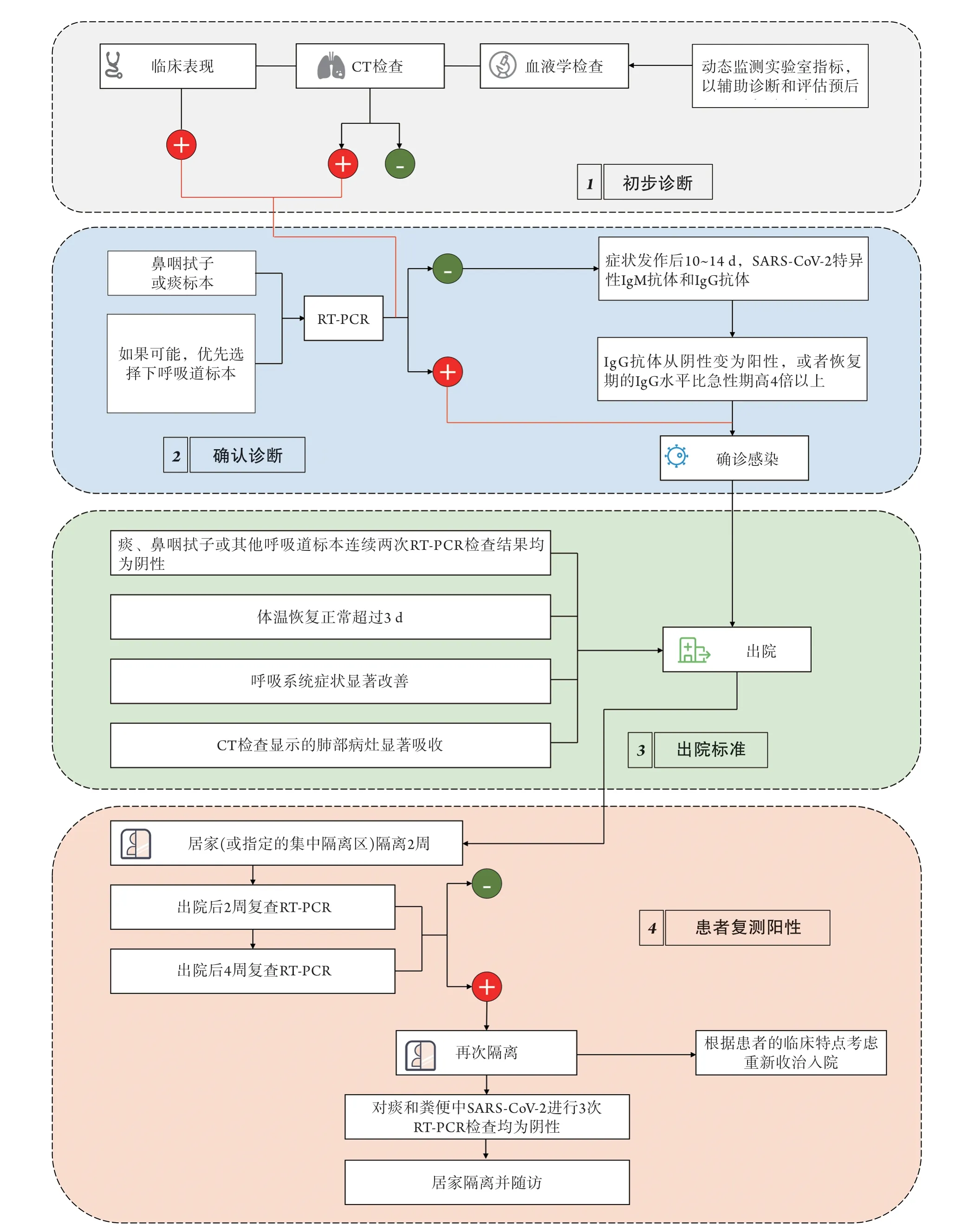
图8 COVID-19诊断和出院管理部分推荐意见路径图Fig.8 Implementation tool for chemoprophylaxis and treatments section
指南制订团队独立透明地开展了本次研究工作,提供研究资金的机构未干涉本次指南的制订过程。
