MER型沸石吸附分离CO2/CH4的分子模拟
2020-11-26石勤席静张富民
石勤,席静,张富民
(兰州石化职业技术学院应用化学工程学院,甘肃兰州730060)
二氧化碳/甲烷(CO2/CH4)混合体系的分离在天然气、生物质沼气和填埋气的净化处理以及CO2捕获等工业方面具有重要应用[1-2]。目前常用的分离方法有物理与化学吸收法、膜分离法、吸附法等[3-5]。其中吸附法具有操作流程简单、能耗低、操作弹性大等优点,所以在工业生产中具有良好的应用前景。在吸附法中,吸附剂是气体混合物吸附分离技术的关键,所以研发性能优良的吸附剂对气体吸附工艺的重要意义不言而喻。在目前研发的吸附剂中,无机碳材料、金属有机骨架、沸石分子筛等因具有吸附容量大、选择性高、稳定性好、寿命长等优点,受到越来越多的关注[6-8]。
其中,沸石分子筛作为气体吸附分离材料已被大量研究报道。用于CO2/CH4混合体系分离的沸石,报道主要集中在阳离子交换的LTA 型、RHO型、CHA型、FAU型以及钛硅酸盐(EST-4)等沸石中,研究发现沸石孔道的结构、孔径以及孔道中的阳离子类型、位置及数目等对气体吸附分离均具有很大影响[9-13]。MER 型沸石是一种罕见的三维八元环微孔沸石,目前研究主要用于海水卤水提钾、废水处理和工业催化等领域[14-18],由于其独特的孔道结构,在CO2/CH4吸附分离方面也表现出了其优越性。Yeo等[19]采用水热晶种法制备了MER型沸石膜用于CO2/CH4气体分离,发现其对CO2表现出很高的选择性;Mirfenderesk 等[20]考察了MER 型沸石膜的水热合成条件对分离CO2/CH4的影响,并指出其对CO2具有良好的渗透性和选择性;Georgieva等[21]研究了不同阳离子交换的MER 型沸石的晶胞结构和对CO2的吸附性能,表明MER 型沸石是一种柔性结构的沸石,K+交换的MER型沸石对CO2具有较高的吸附量和选择性以及快速吸附和脱附的动力学性质。从上述可知,MER 型沸石在吸附分离CO2/CH4方面展现出了良好的潜在工业应用前景。目前,CO2/CH4在MER型沸石中吸附分离的相关机理研究尚未见报道,缺乏理论基础数据。在分子水平上认识吸附机理对筛选、优化制备高性能的吸附剂以及解释吸附现象等具有重要意义,所以有必要在吸附机理方面进一步深入研究。
本工作采用巨正则蒙特卡洛(GCMC)模拟方法,以全硅MER 型沸石作为对照,系统地探究不同阳离子交换的MER型沸石中CO2/CH4的吸附分离行为,得到CO2和CH4在MER型沸石中的吸附等温线、吸附热、吸附质分布及竞争吸附选择性。模拟结果为MER型沸石用于吸附分离CO2/CH4提供理论依据和实验指导。
1 计算模型和方法
1.1 计算模型
MER型沸石模型取自Material Studios软件自带数据库,其空间群是Immm,晶胞常数a=1.4116nm,b=1.4229nm,c=0.9946nm,α=β=γ=90°。MER 型沸石结构[22-23]如图1 所示,沿着[001]方向有两种八元环通道交替排列,一种八元环通道由pau 笼与d8R笼共享一个八角平面组成[图1(b)],另一种八元环通道由ste 笼连接组成[图1(c)],两种八元环通道的窗口直径分别为0.33nm×0.33nm和0.34nm×0.51nm,沿着[100]和[010]方向,ste 笼与pau 笼共享弯曲八元环各自组成八元环通道[图1(a)],窗口直径分别为0.31nm×0.35nm和0.27nm×0.36nm。
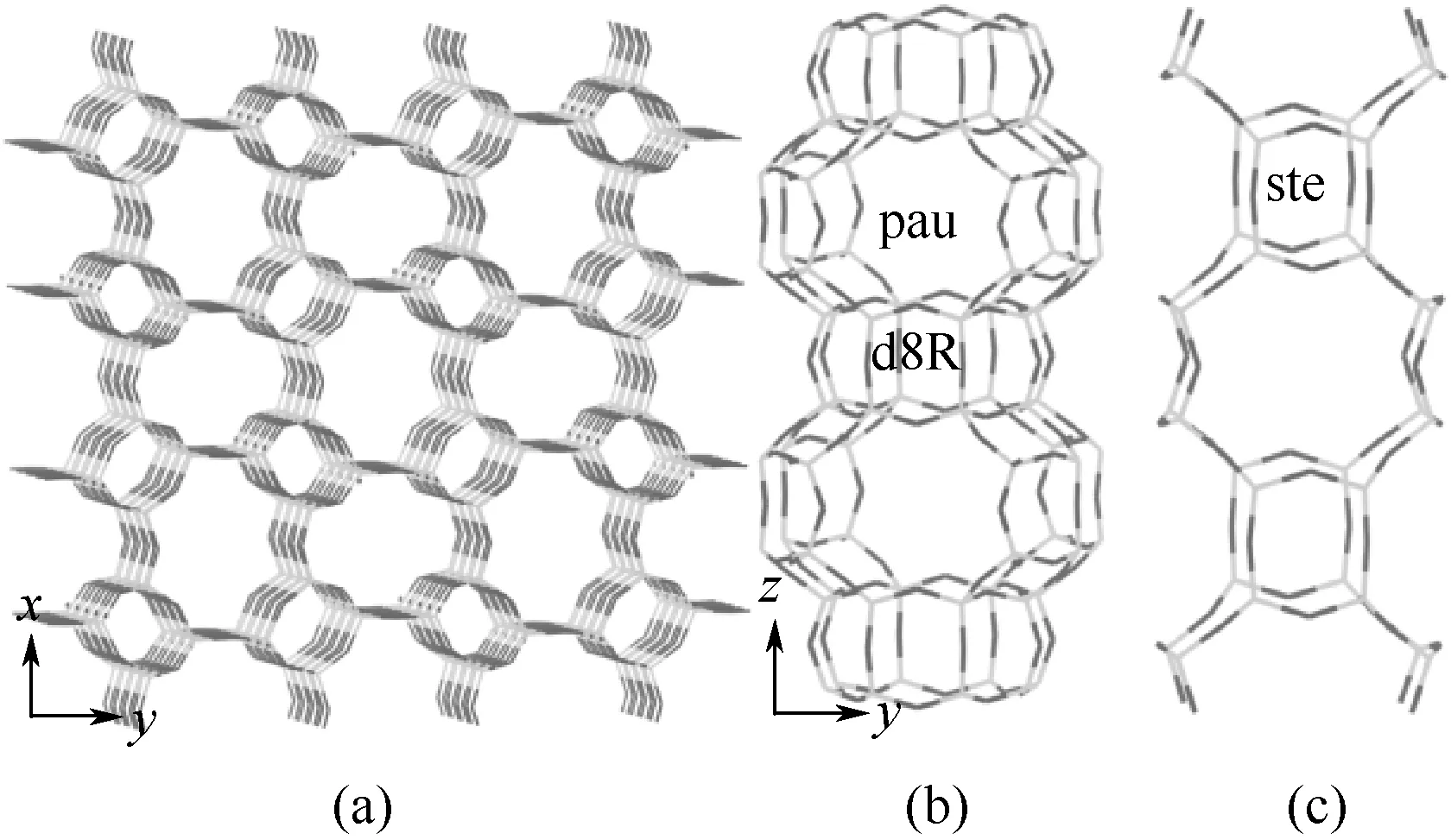
图1 MER型沸石结构
本文作者前期对MER 型沸石骨架Al 的分布和骨架外阳离子的位置进行了计算研究[24],本文在其基础上进行计算。为便于和文献[21]实验值(Si/Al=3.8)对比,沸石骨架Si/Al 取为3.57(单位晶胞共含32个Si,其中7个Si被Al取代)。沸石骨架的优化结构和骨架原子电荷由密度泛函理论(DFT)计算得到,骨架电负性由阳离子平衡。目前报道的MER 型沸石骨架外阳离子有钠、钾、铯和钙离子[25-27],故建立了上述4 种阳离子的沸石模型,金属离子钠、钾和铯的电荷均取+1 价,钙的电荷取为+2价,分别用符号Na-MER、K-MER、Cs-MER、Ca-MER 表示,全硅MER 型沸石在实验中未见报道,在本文模拟中用来和阳离子沸石对比,用符号MER表示。模拟中使用2×2×2的超晶胞。
气体吸附质分子采用刚性模型,即计算过程中吸附质分子的键长和键角均不发生变化。CO2的C—O的键长为0.118nm,O—C—O的键角为180°,C与O的原子电荷分别为0.576e和-0.288e;CH4简化为一个伪原子[28]。吸附质力场参数采用Compass力场[29]。
为消除模型对吸附性能产生的误差,考察了沸石骨架原子Al 取代Si 的位置对吸附的影响。首先建立了骨架Si/Al=3.57 的3 种沸石模型,如图2 所示,模型一中的沸石骨架原子Al 的位置是通过Al替代能最小搜索得到[24],模型二和模型三中,沸石骨架原子Al的分布在满足Lowenstein规则的前提下随机取代得到。然后以K+为骨架外阳离子为例,在298K下模拟了CO2和CH4的吸附性能,如图3所示。由图3 可知,MER 型沸石骨架原子Al 取代Si的位置对吸附的影响很小,可以忽略。但就沸石骨架结构的稳定性而言,模型一中的沸石骨架结构更稳定,因为其具有最低的能量,模型一、二、三的能量分别为-13758.2879910Ha、-13758.2726469Ha和-13758.2692889Ha(1Ha=2625.5kJ/mol),故本文采用模型一进行模拟。
1.2 计算方法
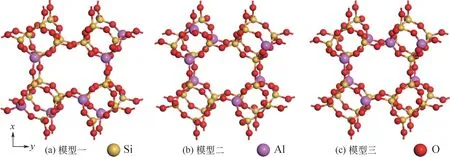
图2 MER型沸石骨架原子Al 的分布模型
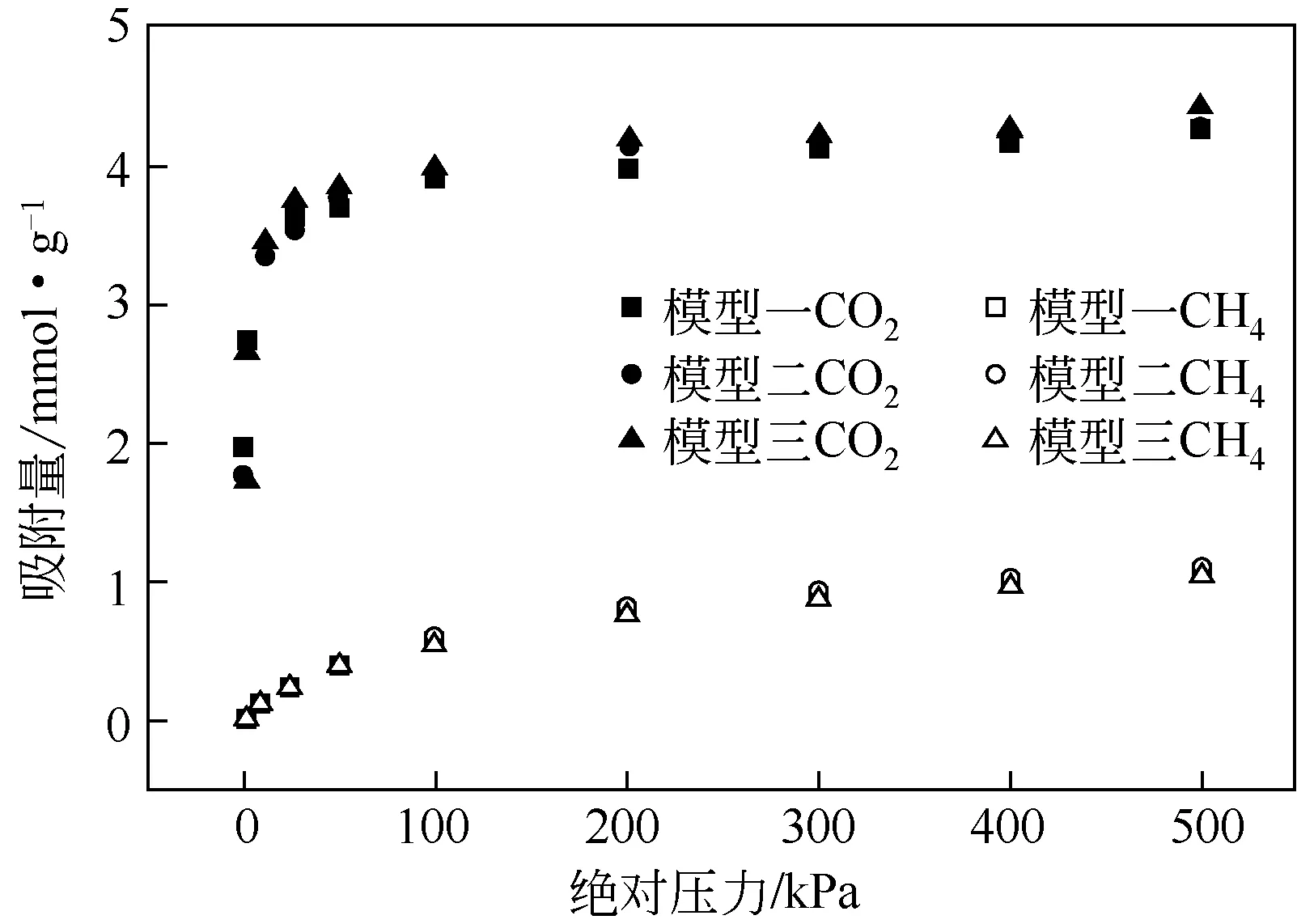
图3 沸石骨架Al取代Si的位置对吸附的影响
巨正则蒙特卡洛(GCMC)方法被广泛用来研究吸附质在多孔材料中的吸附问题。本文采用Materials Studio 软件包中Sorption 模块计算吸附量和吸附热。计算任务选择Fixed pressure,计算方法为Metropolis,客体分子和吸附材料的相互作用包括静电作用和范德华作用,静电作用采用Ewald加和方法,范德华作用采用Atom based方法,非键截断距离设置为0.995nm,正好小于模拟晶胞最小边长的一半,计算平衡步数为5×106,生产步数为5×106, 模 拟 采 用COMPASS (condensed-phase optimized molecular potentials for atomistic simulation studies)力场。COMPASS 力场是一个基于从头计算,已被证实能够准确预测孤立态和凝聚态分子的分子结构、振动、构象和热力学性质的分子力场,被广泛用于模拟多种无机和有机分子在各类材料中的吸附性质[30-31]。
1.3 自由体积和比表面积
自由体积和比表面积的大小是理解纳米孔材料中渗透分子吸附和传输行为的重要参数[32]。自由体积(V)定义为将探针分子放入材料的整个晶胞中,计算不占据骨架空间的体积;比表面积(S)定义为用一个探针分子作为小球,以小球质心在吸附剂的表面滚动时产生的表面。本文借助于Materials Studio 软件中的工具Connolly Surface 计算了全硅及不同阳离子交换的MER 型沸石的自由体积和比表面积,探针分子的直径取吸附质的分子动力学直径,CO2和CH4的分子动力学直径分别取为0.33nm和0.38nm[19],计算结果如表1所示。
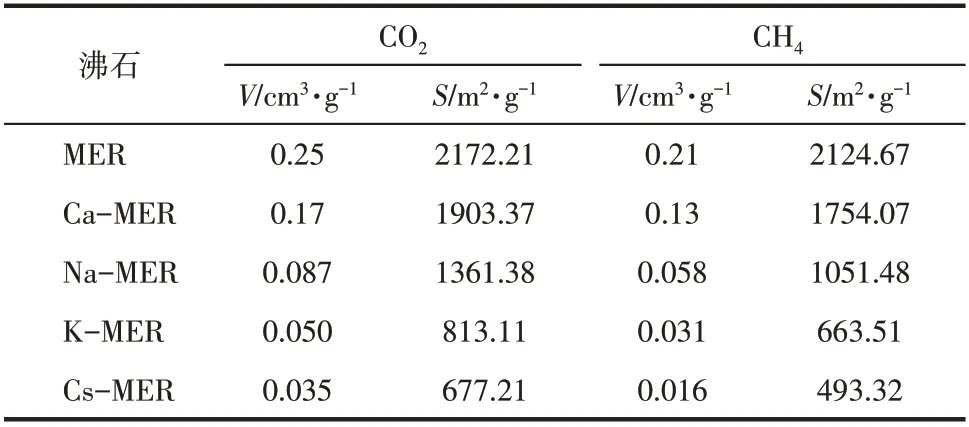
表1 MER型沸石的自由体积和比表面积
2 结果与讨论
2.1 模型和力场参数的验证
为验证所建模型和选用力场的可靠性,需要与实验数据进行对比。图4 是不同温度下K-MER 型沸石对CO2吸附量的模拟值与文献[21]实验值的对比。由图4可知,本文的模拟结果虽然稍大于文献实验结果,但CO2吸附量随着压力的变化趋势是一致的,说明所选模型和力场可靠。本文作者分析模拟吸附量高于实验吸附量的原因是模拟采用的是完美晶体,而实验得到的晶体往往具有缺陷,故吸附分子数减少。另外,在298K、100kPa 下,本文模拟的CO2在全硅MER 型沸石的吸附热为33.91kJ/mol,与文献[33]的模拟值31.3kJ/mol 比较接近,也说明了模型和力场的可靠性。
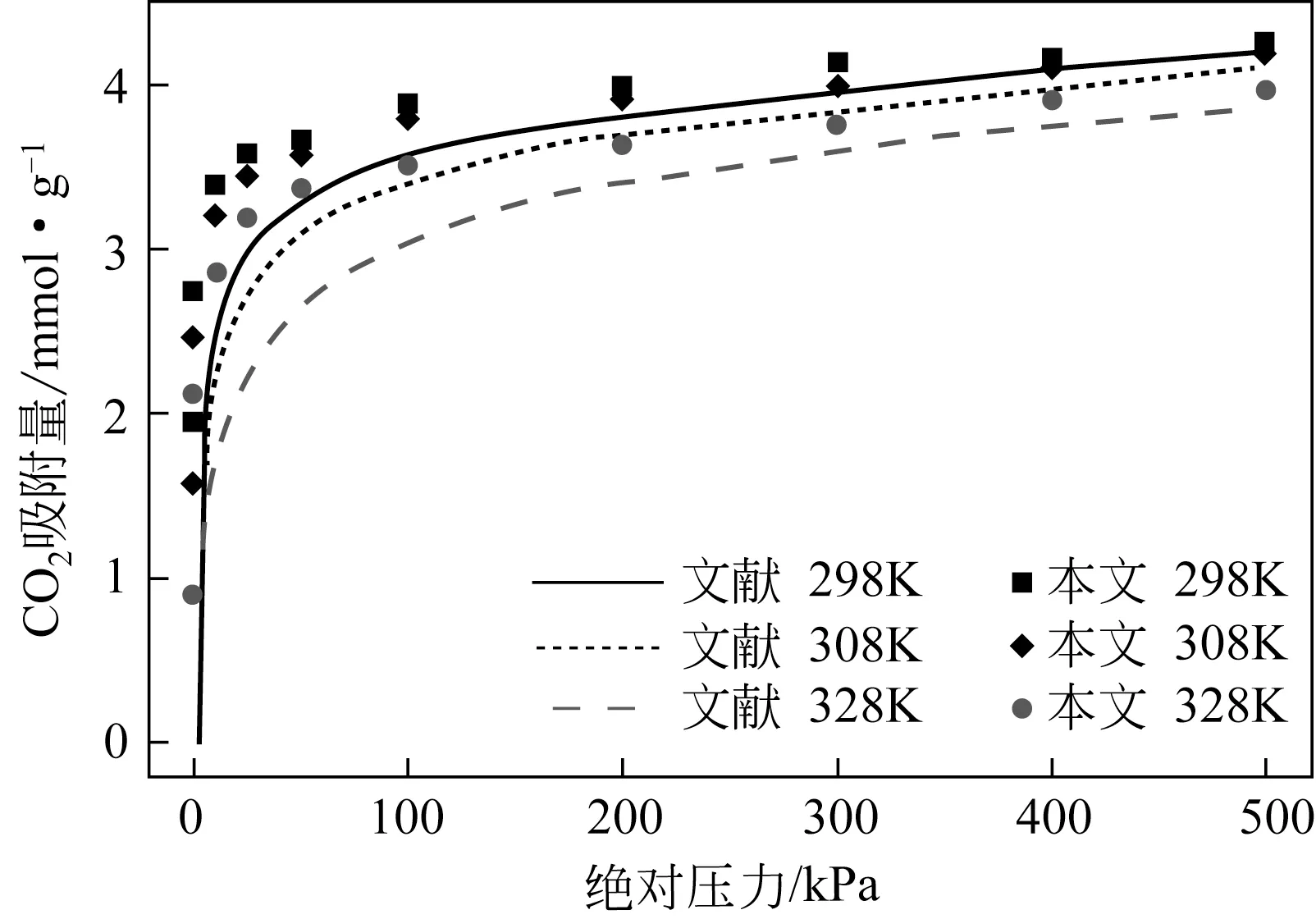
图4 不同温度下K-MER型沸石对CO2吸附量的模拟值与文献的比较
2.2 单组分吸附
2.2.1 吸附等温线
图5为298K下,CO2和CH4单组分在MER型沸石中的吸附等温线。从图5(a)可以看到,CO2在不同阳离子交换的MER 型沸石中的吸附量随吸附压力的增大,在低压下(低于25kPa)急剧增加,随后缓慢增加并逐渐趋于饱和;而CO2在全硅MER型沸石中的吸附量随吸附压力的变化较为平缓。这一现象说明MER 型沸石骨架外阳离子对CO2的吸附产生很大影响,不仅影响吸附量的大小,而且影响平衡吸附压力的大小,CO2在100kPa时就基本达到平衡。从图5(b)可以看到,CH4在全硅和不同阳离子交换的MER 型沸石中的吸附规律一致,吸附量随着吸附压力的增大均缓慢增加,说明MER 型沸石骨架外阳离子只对CH4的吸附量产生影响,对平衡吸附压力影响不大。
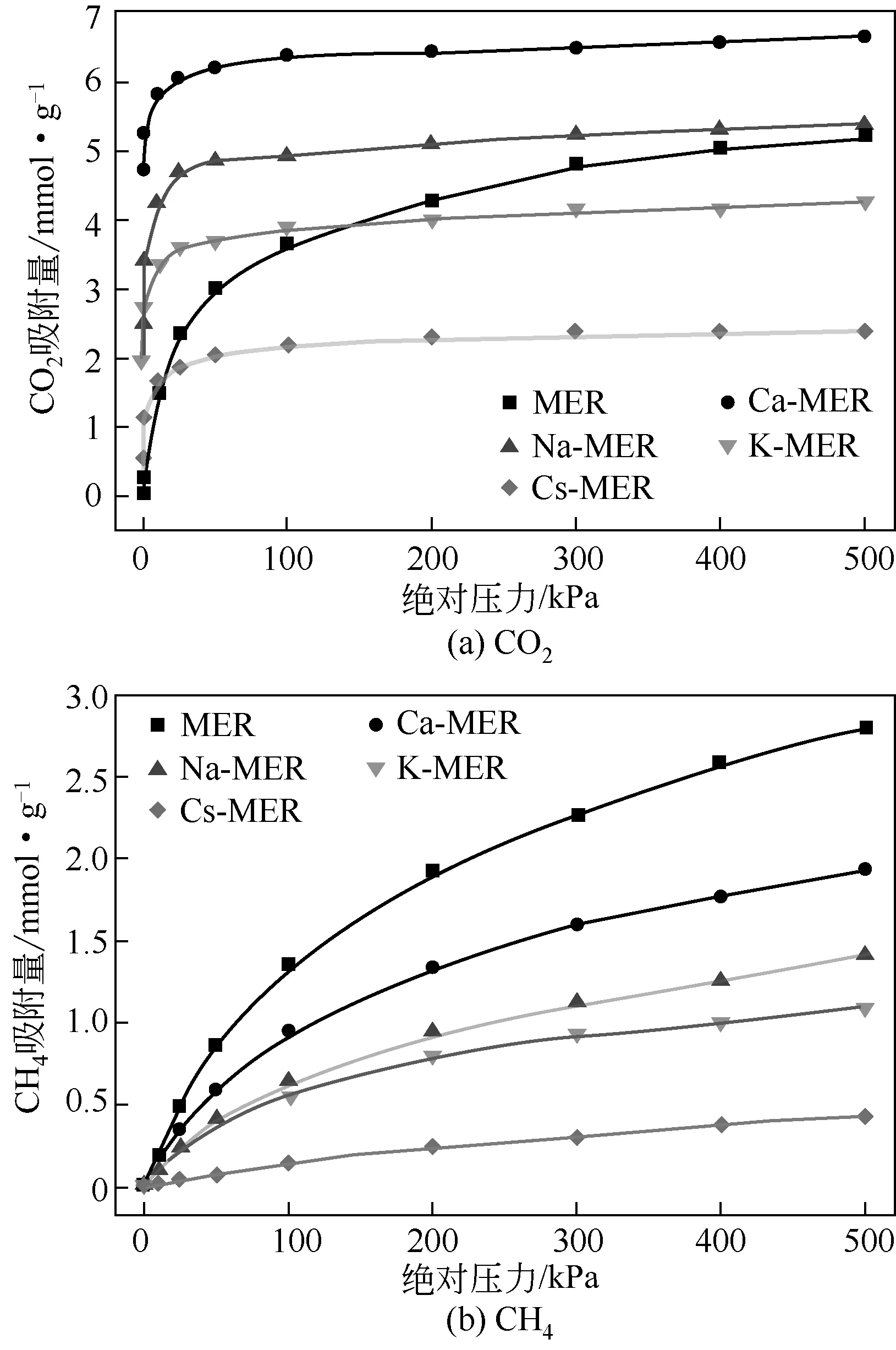
图5 298K下,CO2和CH4单组分在MER型沸石中的吸附等温线
采用Langmuir-Freundlich 吸附等温线模型[34]拟合CO2和CH4在沸石中的吸附数据,见式(1)。

式中,q为一定温度和压力下的吸附量,mmol/g;qs为饱和吸附量,mmol/g;b为吸附平衡常数,kPa-1,数值越大,平衡吸附压力越小;p为吸附压力,kPa;n为界面非均匀性系数,用来描述界面能量非均匀的程度,当n=1 时,Langmuir-Freundlich 模型即为Langmuir 模型的表达式,n偏离1 的程度越大,说明吸附剂界面的非均匀性越强。
2.3.1理论产量理论产量是处理6最高为287.55公斤/亩,依次是处理5为265.75公斤/亩,处理4为234.66公斤/亩,处理3为224.39公斤/亩,处理2为215.02公斤/亩,处理1为208.72公斤/亩。
拟合参数如表2 所示,CO2和CH4在沸石中的吸附数据能够很好地拟合Langmuir-Freundlich吸附等温线模型,拟合相关性R2均在0.995以上。

表2 CO2和CH4在MER型沸石中吸附的Langmuir-Freundlich模型拟合参数
比较表2 中平衡吸附量可知,CO2在沸石中的平衡吸附量大于CH4的平衡吸附量,这是因为CO2的动力学直径(0.33nm)小于CH4(0.38nm)[19],故导致CO2在沸石中具有较大的吸附表面积和空腔体积。CO2和CH4单组分在不同阳离子交换的MER型沸石中的平衡吸附量大小顺序均为Ca-MER>Na-MER>K-MER>Cs-MER 型沸石。主要原因在于:对于固定的Si/Al 沸石骨架,价态高的离子晶胞材料中所包含的离子数目少,吸附表面积和空腔体积大;对于同一主族的阳离子,随着原子序数的增加,离子半径增大,吸附表面积和空腔体积减小。上述分析与表1中的计算结果一致。为进一步分析吸附与沸石结构数据之间的关系,将CO2和CH4的平衡吸附量与沸石的自由体积和比表面积数据进行关联,结果如图6所示。从图6可知,平衡吸附量与沸石的自由体积和比表面积均近似成线性关系,平衡吸附量与比表面积的线性相关性高于其与自由体积的线性相关性,这表明MER 型沸石的比表面积和自由体积是影响CO2和CH4平衡吸附量大小的关键因素。由此可知,不同阳离子交换的MER型沸石对CO2和CH4的平衡吸附量由吸附质本身的结构性质和沸石骨架外阳离子的类型、大小和数目共同决定,高价阳离子交换的MER 型沸石具有较大的气体平衡吸附量。
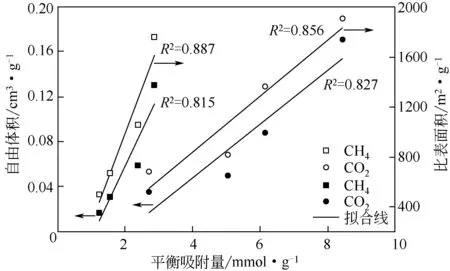
图6 平衡吸附量与沸石自由体积和比表面积的关系
由表2 中的吸附平衡常数b和界面能量非均匀系数n可知,在不同阳离子交换的MER型沸石中,CO2的吸附平衡常数b明显大于CH4的,CO2的能量非均匀系数n偏离1 的程度也大于CH4。这一结果说明沸石骨架外阳离子对CO2的平衡吸附压力的影响是由能量效应引起的,CO2在低压下就可以达到吸附平衡。
在298K、100kPa 的吸附条件下,Ca-MER、Na-MER、K-MER 和Cs-MER 型沸石对CO2的吸附量分别是6.40mmol/g、4.92mmol/g、3.89mmol/g 和2.19mmol/g,与相同或相近吸附条件下的其他沸石[Ca-LTA (5mmol/g)[9]、 H-RHO (3.3mmol/g)[10]、Na-CHA(4.4mmol/g)与Li-CHA(4.5mmol/g)[11]、Ca-ETS-4(2.2mmol/g)[13]、SAPO-34(3.5mmol/g)[35]、H-SSZ-13(3.98mmol/g)与Cu-SSZ-13(3.75mmol/g)[36]、NaKA(3.5mmol/g)[37]、NaA(3.67mmol/g)][38]进行比较可知,Ca-MER、Na-MER、K-MER 型沸石具有相当或更大的CO2吸附量,均是良好的CO2吸附剂。
2.2.2 吸附热
吸附热是吸附过程中的一个重要参数,吸附热的大小反映了吸附质与吸附材料之间作用力的强弱,对认识吸附过程具有重要意义。图7 为298K下,CO2和CH4单组分在MER型沸石中的等量吸附热。由图7可知,CO2的吸附热大于CH4的吸附热,CO2在不同阳离子交换的MER型沸石中的吸附热显著大于其在全硅MER 型沸石中的吸附热,说明沸石与CO2的作用力强于其与CH4的作用力,也进一步说明骨架外阳离子对CO2吸附产生很大影响。CO2在不同阳离子交换的MER型沸石中的吸附热均随吸附压力的增大先急剧减小,后缓慢减小,这是由于CO2具有较大的四极矩,其氧原子的孤对电子和碳氧键的极性使其与沸石骨架外的阳离子发生强的静电作用[39],导致CO2与阳离子的结合能高于其与沸石骨架的结合能。故而在低压下,CO2优先占据阳离子产生的活性位,CO2吸附量快速增大,吸附过程放出较大热量;当活性吸附位被占据后,CO2的吸附转向其他普通吸附位,吸附量缓慢增大,吸附热下降。而CO2在全硅MER 型沸石中的吸附热与CH4的吸附热具有相同的变化规律,即吸附热随着吸附压力的增大而缓慢增大,其原因是在低吸附量时,吸附质与沸石骨架之间的相互作用占主导地位,随着吸附量增加,气体分子之间的相互作用增强,吸附热增大。
由图7(a)可知,CO2在不同阳离子交换的MER型沸石中的吸附热的大小规律为Ca-MER>Na-MER>K-MER>Cs-MER 型沸石,原因在于阳离子电荷越大,其与CO2的作用力越强;对于相同电荷的阳离子,随着原子序数增加,离子半径增大,阳离子电荷密度减弱,其与CO2的作用力也相应变弱。在吸附压力范围内,Ca-MER 型沸石中CO2的吸附热为67.09~72.79kJ/mol,考虑到CO2与Ca2+的作用力较强,脱附困难;Na-MER 和K-MER 型沸石中CO2的吸附热分别为53.85~59.98kJ/mol 和51.87~57.71kJ/mol,与CO2在Na-X (49.1kJ/mol)和Na-ZSM-5(50kJ/mol)沸石[40]中的吸附热相当,能够可逆,在Georgieva等[21]实验中也得到证实。由图7(b)可知,CH4在不同阳离子交换的MER型沸石中的吸附热(22.89~24.38kJ/mol)近似相等,这一结论与CH4在碱金属阳离子交换的X型沸石中的吸附热(21~24kJ/mol)一致[41]。
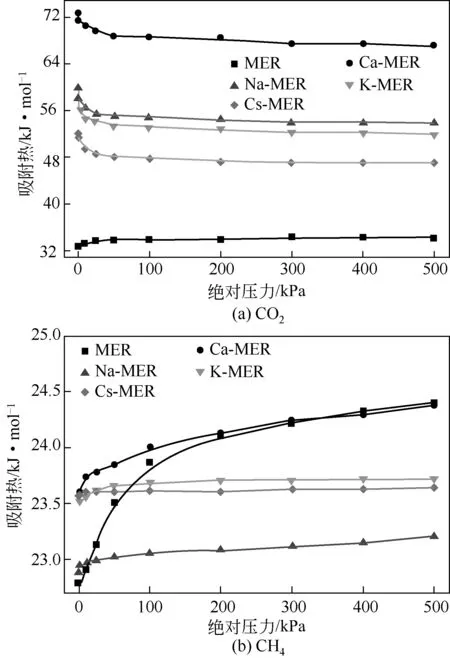
图7 298K下,CO2和CH4单组分在MER型沸石中的等量吸附热
为了进一步理解吸附质分子在MER 型沸石中的吸附,结合吸附能分布曲线分析了吸附质在沸石孔道中的吸附位点和概率密度。在298K、100kPa下CO2和CH4在MER型沸石中概率密度分布和吸附能分布分别如图8和图9所示。由图8可知,CO2在MER 型沸石中沿着z轴的两个通道均有分布。CH4在全硅MER、Ca-MER 和Na-MER 型沸石中沿着z轴的两个通道中也均有分布,但CH4在K-MER 和Cs-MER型沸石中只分布在pau笼和d8R笼连接的z轴通道中。在图8 中还可以看出,CO2和CH4主要分布在pau 笼中,在d8R 笼和ste 笼中也有少量分布。CO2与CH4相比,CO2的吸附位点更加分散,CH4主要分布在pau笼的中心。
吸附能分布曲线能够很好地补充解释吸附质在沸石孔道中的概率密度分布。由图9(a)可知,CO2在全硅MER 型沸石中只有一个单峰,表明只有一种吸附位,事实是CO2在沸石中不同的吸附位具有相同的吸附能,这一结果与CO2在全硅MER 型沸石中的概率密度分布一致;CO2在不同阳离子交换的MER 型沸石中呈现双峰,能量分布范围较大,表明有两种吸附位:图9(a)中左侧峰表示CO2与阳离子作用产生的吸附位,右侧峰表示CO2与沸石骨架作用产生的吸附位。由图9(b)可知,CH4在MER型沸石中能量分布范围基本相同,表明吸附位都是CH4与沸石骨架作用产生的;CH4在全硅MER、Ca-MER 和Na-MER 型沸石中呈现双峰,说明CH4在沸石中的不同吸附位具有不同的吸附能,图9(b)中右侧峰代表pau 笼中的吸附位,左侧峰代表d8R笼和ste笼中的吸附位;而在K-MER和Cs-MER型沸石中呈现单峰,说明CH4只在pau 笼中分布,上述分析与CH4在MER 型沸石中的概率密度分布一致。
2.3 双组分吸附分离
吸附选择性是指吸附剂因其组分、结构不同所展现出来的对某些吸附质优先吸附的能力,是评价吸附材料的重要指标。吸附选择性定义为式(2)。


图8 298K、100kPa下CO2和CH4在MER型沸石中的概率密度分布
式中,x1、x2分别为混合物中组分CO2和CH4在吸附相中的摩尔分数;y1、y2分别为混合物中组分CO2和CH4在气相中的摩尔分数。工业体系中CO2/CH4的摩尔组成为10∶90,本文以此组成考察了CO2/CH4在MER型沸石中的吸附选择性,结果如图10所示。
由图10 可知,CO2/CH4在全硅MER 型沸石中的吸附选择性在12.2~13.7之间(图中右纵坐标),其在不同阳离子交换的MER 型沸石中的吸附选择性高达1000 以上(图中左纵坐标),几乎对CH4不吸附。二者对比可知,骨架外阳离子是MER 型沸石对CO2/CH4混合组分表现出超高吸附选择性的原因。不同阳离子交换的MER型沸石对CO2/CH4的吸附选择性随吸附压力的增加,在低压下先急剧减小,后缓慢减小,与CO2单组分在不同阳离子交换的MER 型沸石中的吸附热随吸附压力的变化规律相同,这也说明低压下的超高吸附选择性是骨架外阳离子与CO2的强作用力产生的,随着活性位被快速占据,吸附选择性急剧下降。 阳离子交换的MER型沸石对CO2表现出超高吸附选择性的另一原因是其独特的八元环窗口孔径,阳离子主要位于八元环中[24],阳离子与沸石骨架原子之间的距离决定了吸附质分子的扩散通道,沿着[001]方向形成的八元环窗口直径分别为0.33nm×0.33nm 和0.34nm×0.51nm,沿着[100]和[010]方向形成的弯曲八元环窗口直径分别为0.31nm×0.35nm和0.27nm×0.36nm,这些孔道直径接近于CO2的动力学直径,使CO2(0.33nm) 容易进入,而阻碍CH4(0.38nm) 扩散[19]。值得注意的是,随着压力升高,K-MER 型沸石对CO2/CH4表现出了较高的吸附选择性,与文献[21]在298K、50kPa、CO2/CH4的 摩 尔 组 成 为20∶80的条件下得到的实验结果一致。
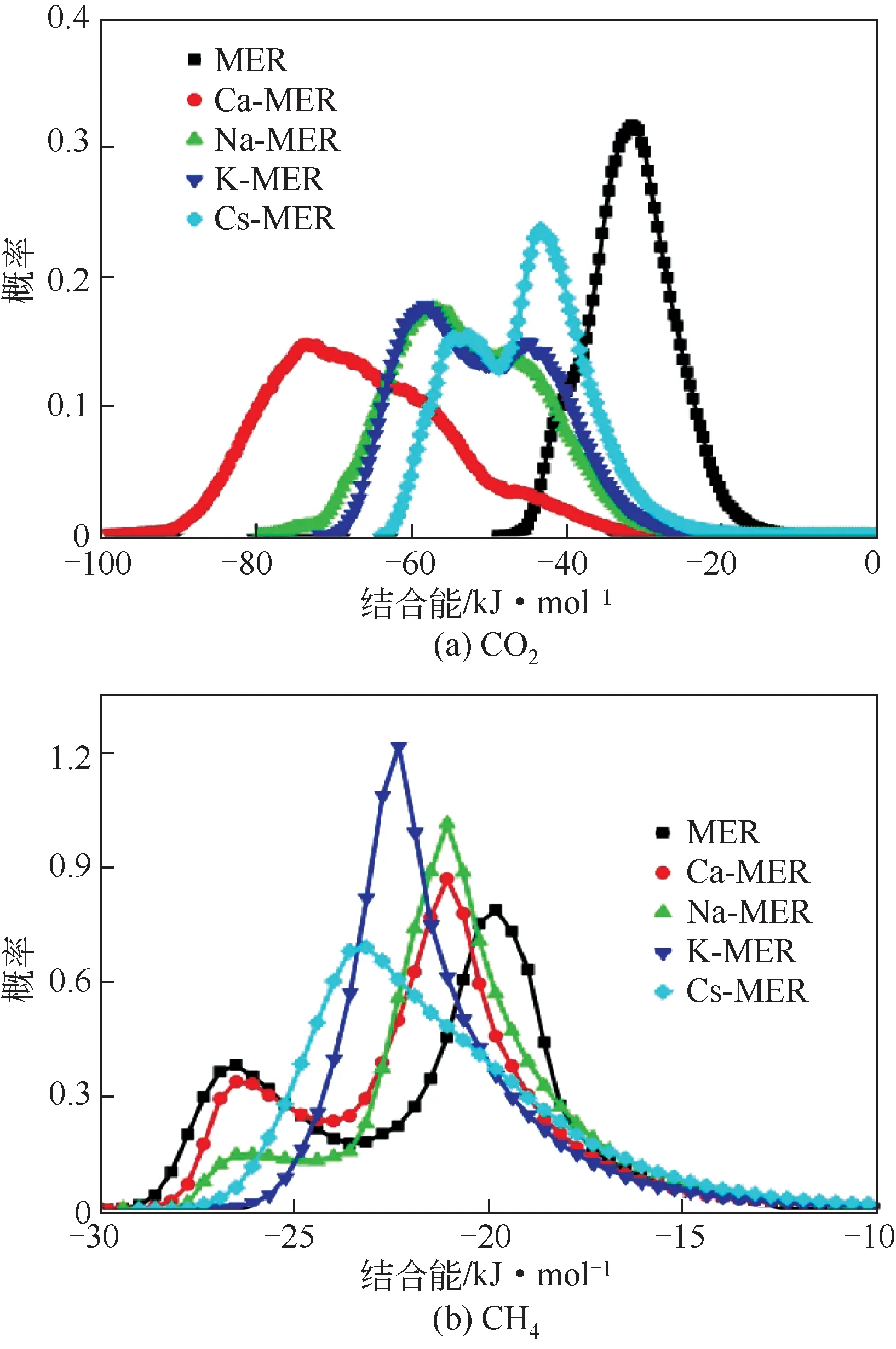
图9 298K,100kPa下CO2和CH4在MER型沸石中的吸附能分布

图10 298K下CO2/CH4在MER型沸石中的吸附选择性
3 结论
本文采用巨正则蒙特卡洛(GCMC)模拟方法,以全硅MER型沸石作为对照,模拟了CO2/CH4在Na-MER、K-MER、Cs-MER 和Ca-MER 型沸石中的吸附分离行为,从分子水平上分析解释了不同阳离子交换的MER 型沸石吸附分离CO2/CH4的机理,结论如下。
(1)不同阳离子交换的MER 型沸石对CO2和CH4的吸附符合Langmuir-Freundlich 吸附等温线模型,平衡吸附量大小顺序为Ca-MER>Na-MER>K-MER>Cs-MER,与沸石的自由体积和比表面积大小顺序一致,且近似成线性关系,选用高价阳离子沸石可以提高吸附量,与其他沸石相比,Ca-MER、Na-MER、K-MER 型沸石具有相当或更大的CO2吸附量,均是良好的CO2吸附剂。
(2)MER型沸石骨架外阳离子与CO2的作用力很强,Ca-MER 型沸石中CO2的吸附热较大,脱附困难;Na-MER 和K-MER 型沸石对CO2的吸附能够可逆。
(3)CO2和CH4主要分布在MER 型沸石的pau笼中,在d8R笼和ste笼中也有少量分布。
(4)骨架外阳离子与CO2的强吸附作用和独特的八元环窗口孔径是MER型沸石对CO2/CH4混合组分表现出超高吸附选择性的原因,吸附选择性高达1000 以上,在高压下K-MER 沸石的吸附选择性最高。
综合吸附量、吸附热和吸附选择性分析指出,Na-MER 和K-MER 型沸石是优良的CO2吸附剂,是今后实验过程中的重点研发方向。
