非洲哈茨木霉产抑菌挥发性有机物碳源代谢机制
2020-11-26陈敬师黄玉洋向杰郭清华李世贵顾金刚
陈敬师,黄玉洋,向杰,郭清华,李世贵,顾金刚
(中国农业科学院农业资源与农业区划研究所农业农村部农业微生物资源收集保藏重点实验室,北京100081)
0 引言
【研究意义】木霉具有生长快、适应性强和抑菌谱广等特点,对辣椒炭疽病菌(Colletotrichum capsici)、灰霉菌(Botrytis cinerea)、镰孢菌(Fusariumspp.)、疫霉(Phytophthoraspp.)和葡萄钩丝壳菌(Uncinula necator)等病菌引起的病害均具有很好的防治效果[1-4]。木霉的生防机制包括营养和生态位竞争、重寄生、拮抗、促生、诱导植物产生系统抗性和产生抑菌性次级代谢产物等。木霉产生的抑菌性次级代谢产物主要分为 3类:一是挥发性有机物(volatile organic compounds,VOCs),二是水溶性化合物(water-soluble compounds),三是哌珀霉素类(peptaibols)。挥发性有机化合物在水、空气和土壤中传播,并且传播距离较远,因此较其他次级代谢产物在防治土传病害方面有更大的优势[5-7]。碳源和氮源是微生物生长的必需物质,不同碳源和氮源对其生长、产孢和抑菌性次级代谢物质的产生影响较大[8-9],YONG等[10]研究了碳源对绿色木霉(Trichodermaviride)产抑菌性气体 6-戊基-吡喃-2酮的影响,发现甘油和葡萄糖均能促进绿色木霉产生 6-戊基-吡喃-2酮,而山梨醇和酸类物质不利于绿色木霉产生 6-戊基-吡喃-2酮。因此,研究木霉对碳源的代谢机制,对提高木霉生物防治的应用潜力具有重要意义。【前人研究进展】目前,已被鉴定的具有生物活性的挥发性有机化合物有1 006种[11],其中约390种由木霉产生[12];具有广谱抑菌性的哌珀霉素类物质有220种[13-15],至少12种来自木霉,这些物质在诱导植物抗性和抑制土壤和根际微生物生长方面具有重要作用[16-18]。不同木霉菌株产生的挥发性有机物组分存在明显差异,如木霉T36和T50菌株产生的挥发性有机物均可抑制禾谷镰孢(Fusarium graminearum)、立枯丝核菌(Rhizoctonia solani)和终极腐霉(Pythium ultimum)的生长,但T36菌株对3种病原菌的抑制率均高于 T50[19]。BELÉN 等[20]研究发现,Thmbf 1与哈茨木霉(Trichoderma harzianum)抑菌挥发性有机物的产生密切相关,过表达Thmbf 1会降低哈茨木霉挥发性有机物对尖镰孢和灰霉菌的抑制率;PACHAURI等[21]研究发现,木霉挥发性有机物中包含大量的萜类物质,其形成与 3-磷酸甘油醛脱氢酶息息相关。【本研究切入点】针对非洲哈茨木霉(Trichoderma afroharzianum)ACCC 33109及其突变株产生的挥发性有机物对多种病原菌具有抑制作用,且不同碳源条件下菌株抑菌率存在差异的现象,采用Omnilog表型芯片技术分析菌株高产抑菌挥发性有机物与碳源代谢种类之间的关系。【拟解决的关键问题】通过原生质体紫外诱变获得高产抑菌挥发性有机物的突变株,明确与抑菌挥发性有机物产生相关碳源种类,为促进木霉菌株高产挥发性代谢物并高效应用于生物防治提供理论依据。
1 材料与方法
试验于2018年9月至2019年12月在中国农业科学院农业资源与农业区划研究所完成。
1.1 材料
1.1.1 菌种 非洲哈茨木霉 ACCC 33109和尖镰孢(黄瓜枯萎病菌,Fusarium oxysporumsp.cucumebrium)ACCC 37438,均保藏于中国农业微生物菌种保藏管理中心(ACCC)。
1.1.2 培养基 PDA、CMA和SNA培养基配方详见文献[22]。原生质体再生培养基:葡萄糖 20 g,琼脂20 g,酵母膏 1 g,(NH4)2SO41.4 g,KH2PO42 g,MgSO4·7H2O 0.3 g,FeSO4·7H2O 0.05 g,MnSO40.01 g,ZnSO4·7H2O 0.01 g,以 0.6 mol·L-1的 NaCl渗透压稳定剂定容至1 L。合成培养基:果糖20 g,琼脂20 g,酵母膏 3 g,苏氨酸 3 g,K2HPO41 g,MgSO4·4H2O 0.5 g,KCl 0.5 g,ZnSO4·7H2O 0.1 g,FeSO40.01 g,以蒸馏水定容至1 L。
1.1.3 主要试剂与仪器 蜗牛酶、纤维素酶、培养基(CMA、PDA、PDB和 SNA)均购自北京百乐欣生物科技有限公司。紫外光催化/反应箱(CBIO21)购自北京赛百奥科技有限公司。Omnilog微生物表型分析系统(71000)购自美国Biolog有限公司。
1.2 方法
1.2.1 原生质体制备 ACCC 33109的新鲜菌丝转接入含50 mL PDB培养基的三角瓶中,在28℃、200 r/min条件下培养36 h。菌丝经8层无菌纱布过滤,以0.6 mol·L-1NaCl冲洗至显微镜下观察无孢子。称取0.5 g菌丝放入已灭菌的50 mL离心管中,加入10 mL酶解液(蜗牛酶﹕纤维素酶=1﹕1)37℃酶解2 h。以布氏漏斗和6层擦镜纸过滤,并以0.6 mol·L-1NaCl冲洗,离心(4℃、5 000 r/min、10 min)去除酶解液,0.6 mol·L-1NaCl洗涤2次后悬浮原生质体于5 mL的0.6 mol·L-1NaCl中。在显微镜下以血球计数板计数,调整原生质体浓度至 1.0×106个/mL,4℃冰箱保存待用[23]。
1.2.2 原生质体紫外诱变 将浓度为1.0×106个/mL的原生质体在距离紫外灯20 cm处分别照射0、0.5、1.0、1.5、2.0、2.5、3.0 和 3.5 min,分别取 50 μL 涂布于原生质体再生培养基,28℃避光培养至长出单菌落。计算诱变致死率,致死率= [1-(诱变后原生质体再生菌落数/未诱变原生质体再生菌落数)]×100%。选取合适的剂量进行诱变处理,并在红光下涂布于原生质体再生培养基,28℃黑暗培养,挑取单菌落纯化待用。
1.2.3 对扣试验 将ACCC 33109、ACCC 37438和突变株分别在PDA上活化,7 d后以打孔器(Φ=6 mm)分别在菌落边缘打取菌饼并接种到PDA中央,二者对扣,中间以无菌玻璃纸隔开,用两层封口膜密封,28℃恒温培养。对扣无ACCC 33109野生株和突变株菌饼的ACCC 37438为对照,每个处理设置3个重复,连续5 d测量菌落半径,并计算抑菌率。抑菌率=(对照菌落直径-处理菌落直径)/对照菌落直径×100%。
1.2.4 ACCC 33109和 MU153对黄瓜促生防病效果以打孔器(Φ=6 mm)获得活化好的 ACCC 33109、MU153和ACCC 37438菌饼,接种到PDA培养基,7 d后分别用无菌水洗下孢子,用6层纱布和2层擦镜纸过滤至显微镜下观察无菌丝,调整孢子浓度为1.0×107conidia/mL备用。盆栽试验共设置2个对照和4个处理(表1),每个处理10个重复。移栽黄瓜幼苗后观察记录黄瓜发病死亡情况,6周后统计黄瓜枯萎病发病级数,并计算病情指数、发病率和相对防治效果。黄瓜枯萎病发病级数:0级:黄瓜不发病;1级:叶片轻微黄化萎蔫;2级:叶片轻度黄化萎蔫,植株矮化;3级:叶片重度黄化萎蔫,植株明显矮化;4级:植株死亡。病情指数=100×∑(病情级值×该级病情株数)/(病情最高级值×总株数);发病率=发病植株数/调查总株数×100%;相对防治效果=(对照区病情指数-处理区病情指数)/对照区病情指数×100%[24]。
1.2.5 菌落形态和分生孢子梗结构比较 将 ACCC 33109和突变株MU153、MU792在PDA上活化7 d,以打孔器(Φ=6 mm)获得菌饼,分别接种到CMA、PDA和SNA培养基中央,28℃黑暗培养,每天在体式显微镜下观察记录各菌株生长和形态变化。
采用插片法,将ACCC 33109和突变株MU153、MU792的菌饼分别接种到PDA培养基中央,同时将无菌盖玻片斜插到PDA培养基中,28℃黑暗培养3 d,光学显微镜下观察菌丝、分生孢子和分生孢子梗的形态特征。
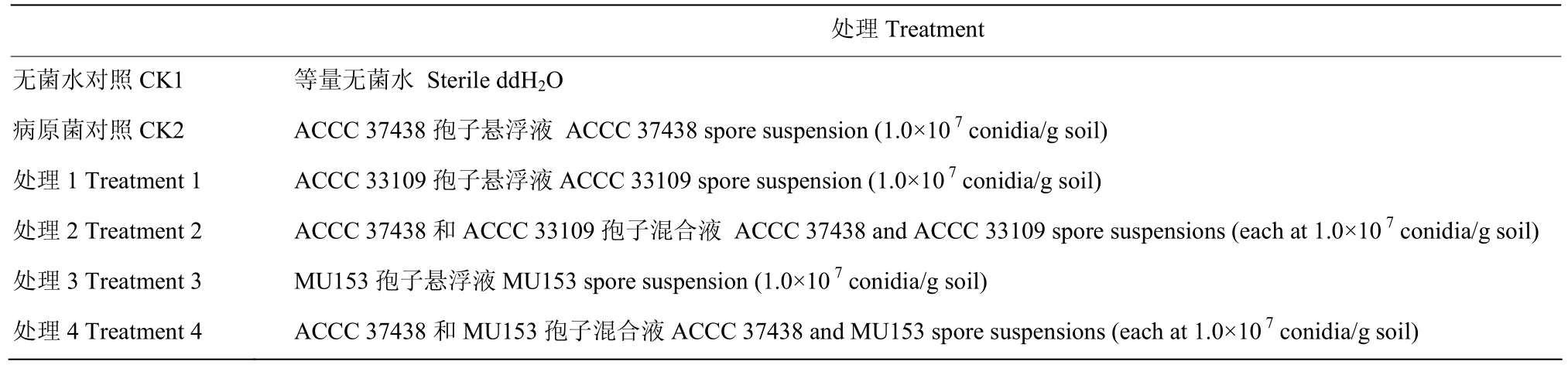
表1 盆栽试验设计Table 1 Design of the pot experiment
1.2.6 营养利用比较 Omnilog表型分析:将ACCC 33109和突变株MU153、MU792在PDA上活化7 d,用无菌棉签沾取孢子并转入FF-IF接种液,调节菌悬液浊度至75% T,然后将100 μL接种液加入到FF板微孔中,在Omnilog培养箱26℃条件下培养7 d。利用Data File Converter、OL_FM_12和OL_PR_12软件以Area为参数进行数据分析,Area值越大表明菌株对该底物利用率越高。
优化培养基的抑菌效率:依据Omnilog表型分析结果,分别将合成培养基中的碳源果糖换为α-D-半乳糖、糊精、麦芽糖、α-D-葡萄糖和吐温-80进行ACCC 33109和突变株MU153、MU792与ACCC 37438的对扣试验。每个处理设置3个重复,连续5 d计算抑菌率。
1.3 数据处理与分析
采用Microsoft Excel 2003和SPSS v. 24软件进行数据整理、统计分析与图表制作。
2 结果
2.1 紫外诱变时间及诱变菌株获得
当紫外诱变微生物的致死率为75%—80%时,正突变率较高[25]。非洲哈茨木霉ACCC 33109的原生质体经紫外灯(25 W)照射1.0—1.5 min后致死率上升最快。紫外诱变2.0 min时的致死率为76.63%,是紫外诱变的最佳时间(图 1)。经多批次原生质体紫外诱变,优先挑取生长较快、菌落直径较大且菌丝较密的菌落,涂布于原生质体再生培养基,最终获得 828个突变株,分别记为MU1—MU828。
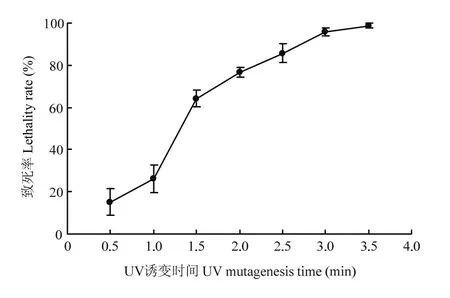
图1 紫外诱变时间对非洲哈茨木霉ACCC 33109原生质体致死率的影响Fig. 1 Effects of UV mutagenesis duration on the protoplast lethality rate of T. afroharzianum ACCC 33109
基于平板对扣试验,非洲哈茨木霉ACCC 33109及其突变株均能不同程度地抑制尖镰孢ACCC 37438的菌丝生长,且抑制效果随时间的延长而增强,表现为病原菌菌丝生长缓慢,色素减少,菌落边缘菌丝稀疏且不规则生长(图 2)。突变株均能产生具有抑菌作用的挥发性有机物,抑制效果差异较大。其中抑菌率<10%的有146株,10%—20%有270株,20%—30%有315株,30%—40%有70株,40%—50%有25株,>50%有 2株,30个突变株的抑菌率高于野生株ACCC 33109(37.18%)。其中,突变株 MU153和MU792经过多次传代培养性状稳定,抑菌率分别为53.86%和15.83%,且菌落形态与野生株有明显差异。
2.2 ACCC 33109和MU153对黄瓜促生和防病效果
盆栽试验中,CK2(病原菌对照)、处理2和处理4均在第2周开始发病,表现为黄瓜根部开始变为褐色等,CK1(清水对照)、处理1和处理3生长正常。第3周处理2和处理4发病情况减轻,CK2发病情况变重,表现为植株矮小、根部和茎基部褐色加深和叶片开始黄化等,CK1、处理1和处理3生长正常。第4周CK2黄瓜开始出现整株枯萎死亡现象,CK1、处理1、处理2、处理3和处理4生长正常。
6周后,处理2和处理4的发病率较CK2分别下降了55.56%和66.67%,病情指数分别下降了38.89和47.23。突变株MU153对黄瓜枯萎病的相对防治效果为89.69%,相对野生株ACCC 33109提高了15.88%(表2)。ACCC 33109和MU153不仅可以防治黄瓜枯萎病,而且可以促进黄瓜生长,表现为植株株高增大、叶片增多和须根发达等(图3)。
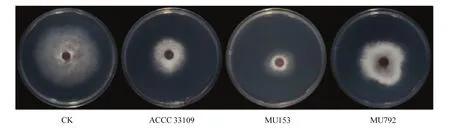
图2 非洲哈茨木霉挥发性有机物对尖镰孢的抑菌活性(28℃, 5 d)Fig. 2 Inhibitory activities of the VOCs produced by T. afroharzianum against F. oxysporum (28℃, 5 d)

图3 非洲哈茨木霉防治黄瓜枯萎病盆栽试验Fig. 3 A pot experiment of T. afroharzianum against cucumber fusarium wilt
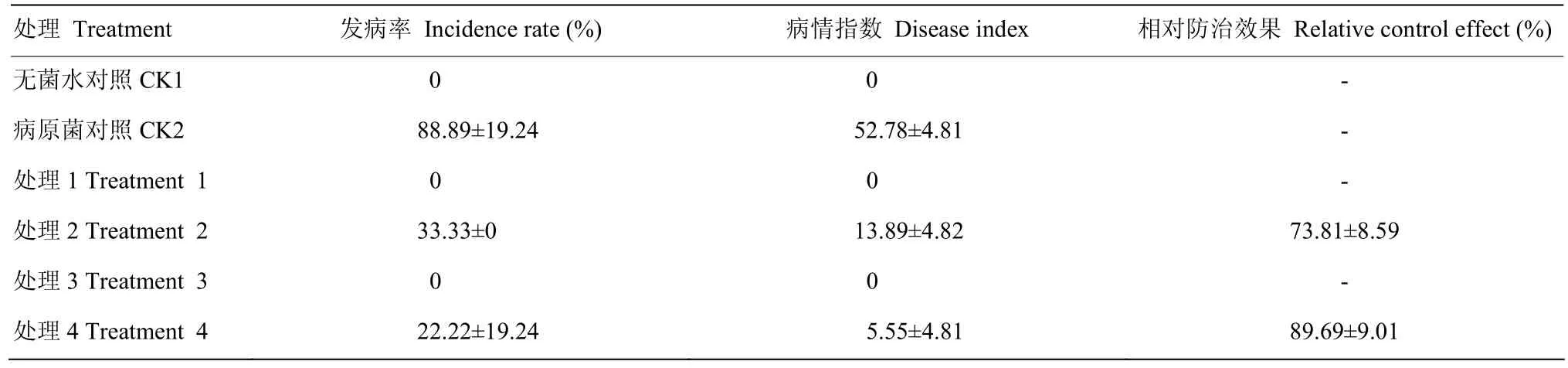
表2 黄瓜枯萎病发病率、病情指数和相对防治效果Table 2 Incidence rate, disease index and relative control effect of cucumber fusarium wilt
2.3 野生菌株和突变菌株形态特征比较
非洲哈茨木霉 ACCC 33109和突变株 MU153、MU792在CMA、PDA和SNA培养基28℃培养3 d后除SNA上生长的MU792外均长满平板,但菌落形态有较大差异(图4)。在CMA培养基上,ACCC 33109菌落白色,产生不明显轮纹,菌落圆形,气生菌丝丰富,为绒毛状,不产生色素;MU153菌落初为白色,第3天变为浅绿色,菌落圆形,气生菌丝丰富,菌落背面颜色由无色变为浅黄色;MU792菌落始终为白色,呈放射状,形成明显的同心轮纹,气生菌丝较少,不产生色素。在PDA培养基上,ACCC 33109菌落白色、圆形,气生菌丝丰富,为絮状,不产生色素;MU153菌落初为白色,后变为绿色,菌落圆形,气生菌丝丰富,菌落背面颜色由无色变为浅绿色;MU792菌落始终为白色,气生菌丝丰富,为絮状,不产生色素。在SNA培养基上,ACCC 33109菌落由白色变为浅绿色,呈放射状,菌落边缘不规则,气生菌丝稀疏,不产生色素;MU153菌落由白色变为浅绿色,呈放射状,气生菌丝稀疏,呈绒毛状,菌落背面颜色由白色变为浅绿色;MU792生长较慢,培养3 d后菌落半径3.8—4.0 cm,菌落始终为白色,气生菌丝丰富,呈绒毛状,不产生色素。
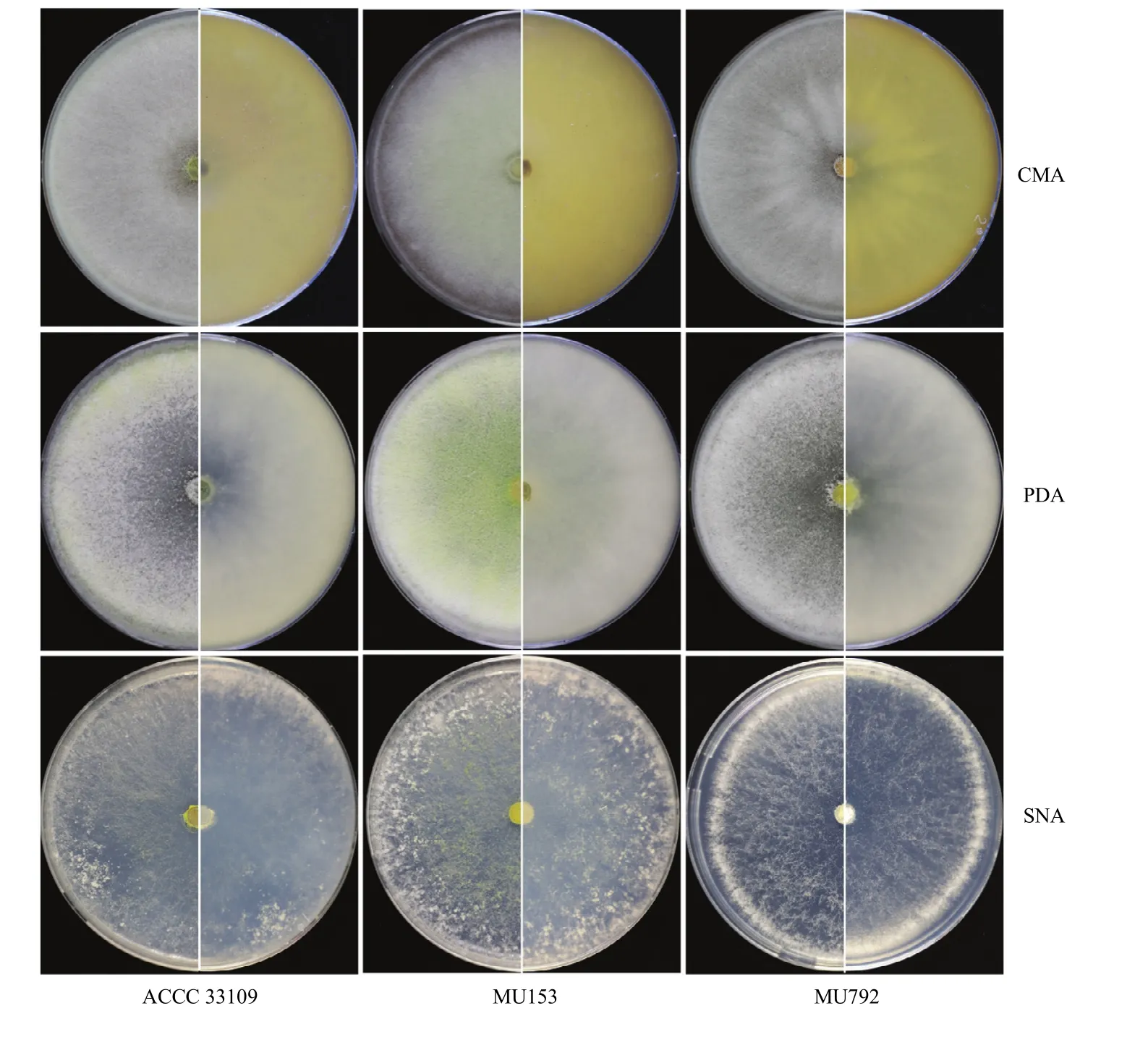
图4 非洲哈茨木霉ACCC 33109、MU153和MU792在不同培养基上的菌落形态Fig. 4 Colony morphology of T. afroharzianum ACCC 33109, MU153 and MU792 on CMA, PDA, and SNA plates
非洲哈茨木霉ACCC 33109、MU153和MU792在PDA平板28℃培养3 d后均产生分生孢子梗和分生孢子(图 5)。原生质体紫外诱变提高了 MU153的瓶梗长度、瓶梗长/宽、支持细胞宽度、支持细胞长度、孢子长、宽和孢子长/宽,降低了MU153分生孢子梗最宽处和基部宽;提高了 MU792的瓶梗长/宽、支持细胞长度、孢子长和宽,降低了MU792分生孢子梗最宽处、基部宽、支持细胞宽度和孢子长/宽(表3)。
2.4 野生菌株和突变菌株对碳源代谢表型分析
图6结果表明ACCC 33109、MU153和MU792均可代谢 FF板中所有物质,利用率有显著差别,MU153对FF板中46种物质的代谢能力高于ACCC 33109,达到显著水平的有2种,分别为甘油和麦芽糖。MU792对FF板中69种物质的代谢能力低于ACCC 33109,达到显著水平的物质有 8种,分别为β-环糊精、D-半乳糖醛酸、D-蜜二糖、水苏糖、木糖醇、D-糖质酸、琥珀酰胺酸和琥珀酸,达到极显著水平的物质有4种,分别为D-棉子糖、γ-羟基丁酸、对羟基苯乙酸和葵二酸。ACCC 33109利用率低于MU153且高于MU792的物质有29种,达到显著水平的物质有2种,分别为α-D-半乳糖和吐温-80,达到极显著水平的物质有1种,为D-葡萄糖醛酸(表4)。
2.5 非洲哈茨木霉代谢底物种类对其抑菌活性影响
MU153基于α-D-半乳糖、糊精、麦芽糖、α-D-葡萄糖和吐温-80 5种底物产生的挥发性有机物对尖镰孢的抑菌率均明显高于野生株,MU792产生挥发性有机物对尖镰孢的抑菌率均低于野生株。以α-D-葡萄糖为底物时,ACCC 33109、MU153和MU792产生的挥发性有机物对尖镰孢的抑菌率均高于其他 4种碳源,并且MU153抑菌率达到了最高为56.17%(图7)。
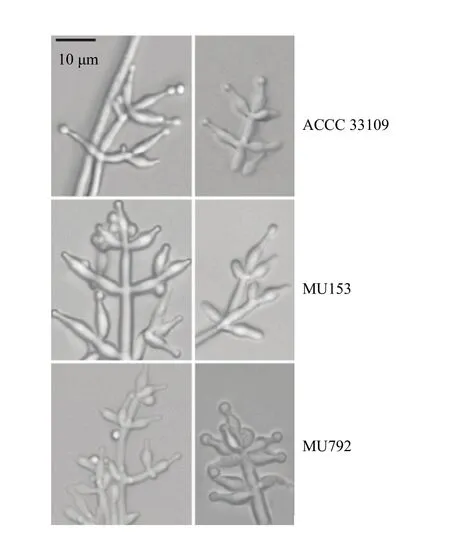
图5 非洲哈茨木霉ACCC 33109、MU153和MU792的分生孢子梗结构Fig. 5 Conidiogenous structures of T. afroharzianum ACCC 33109, MU153 and MU792
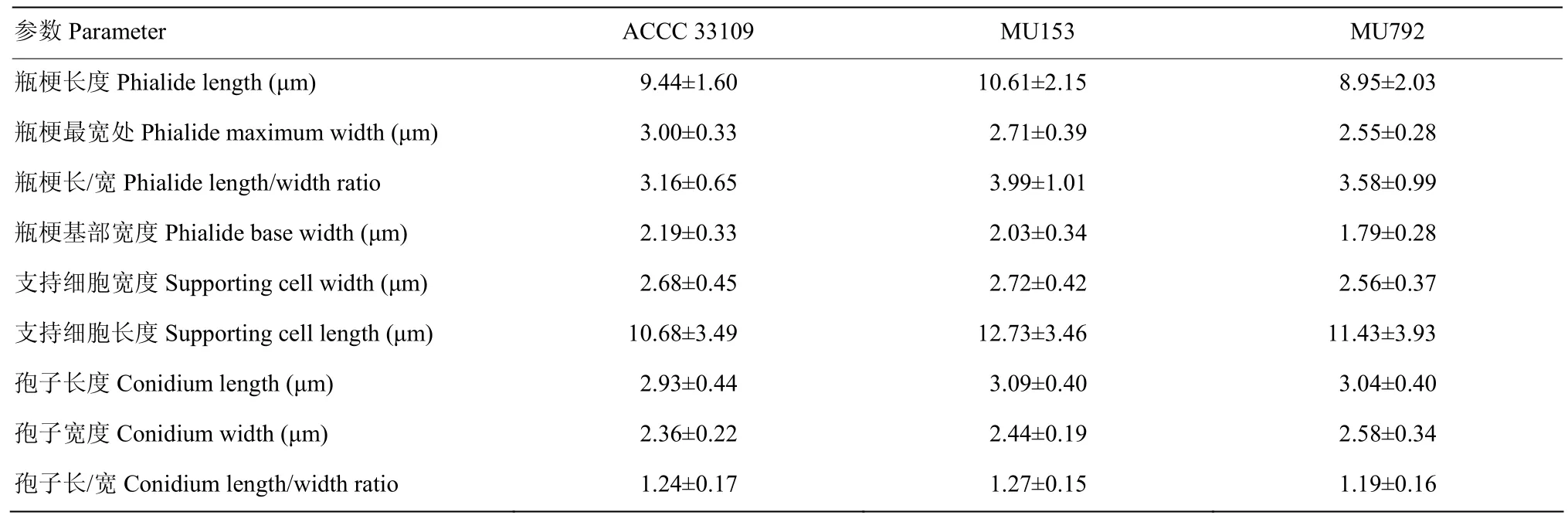
表3 非洲哈茨木霉ACCC 33109、MU153和MU792的分生孢子梗相关数据Table 3 Conidiogenous data of T. afroharzianum ACCC 33109, MU153 and MU792
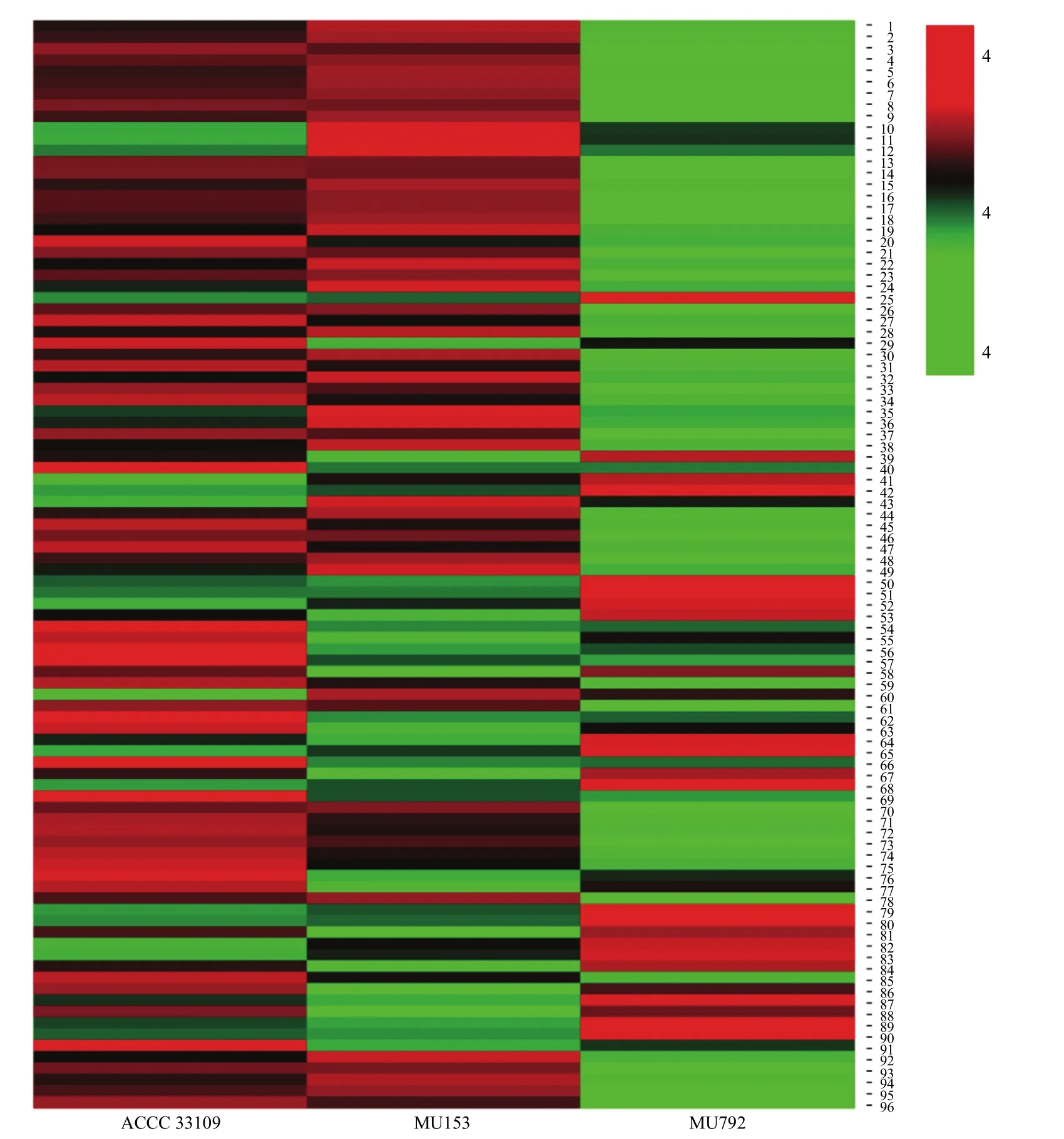
图6 非洲哈茨木霉碳源代谢热图(26℃, 7 d)Fig. 6 Heatmap of carbon utilization of T. afroharzianum (26℃, 7 d)
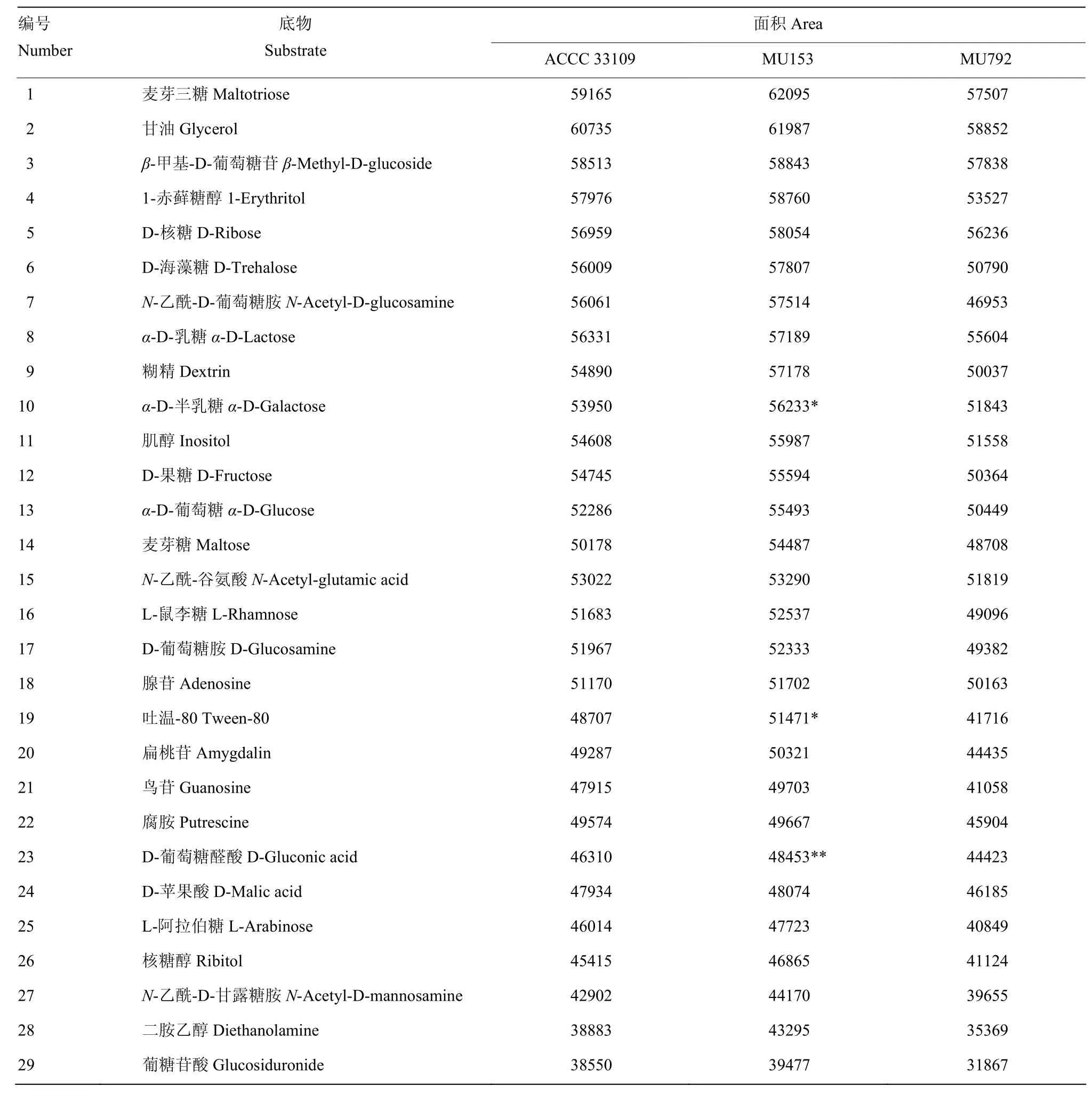
表4 非洲哈茨木霉ACCC 33109代谢能力高于MU792低于MU153的物质Table 4 Substances utilized by T. afroharzianum ACCC 33109 at higher rate than MU792 but lower than MU153
3 讨论
木霉抑菌性挥发性有机物种类鉴别和产生机制是近年来的研究热点和难点。CHEN等[26]研究发现,盖姆斯木霉(Trichoderma gamsii)YIM PH30019可产生二甲基二硫醚、二苯并吡喃、甲硫醇和酮类等挥发性物质抑制三七根腐病;张雯雯等[27]研究表明,11株木霉菌产生的挥发性有机物均可抑制尖镰孢的生长,经GC-MS检测共发现257种挥发性有机物;LI等[28]研究发现,哈茨木霉和深绿木霉(Trichoderma atroviride)产生的28种挥发性有机物可抑制尖镰孢的生长,对扣试验表明尖镰孢还可诱导木霉挥发性有机物的产生。
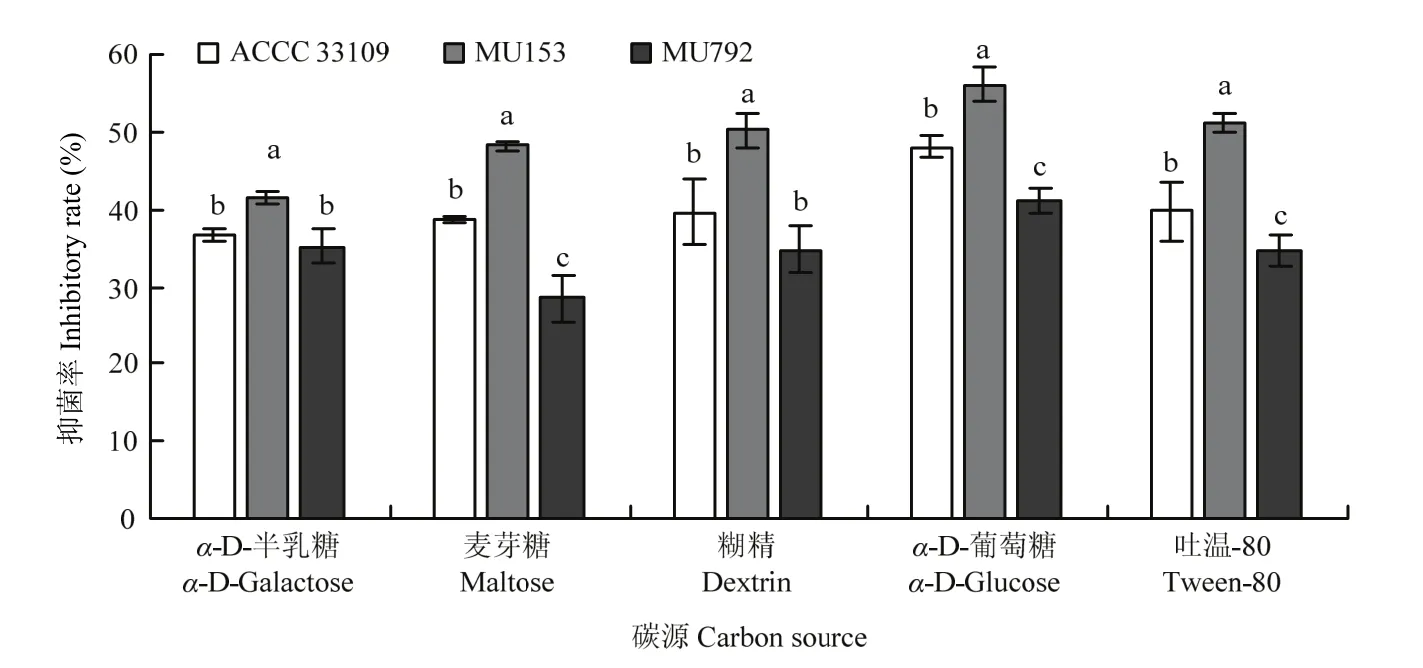
图7 不同碳源条件下非洲哈茨木霉ACCC 33109、MU153和MU792抑菌作用(28℃, 5 d)Fig. 7 Effects of different carbon sources on the inhibitory activities of the VOCs produced by T. afroharzianum ACCC 33109,MU153 and MU792 (28℃, 5 d)
本研究中,分别以α-D-半乳糖、糊精、麦芽糖、α-D-葡萄糖和吐温-80为碳源时,非洲哈茨木霉突变株MU153抑菌率均高于野生株 ACCC 33109,MU792抑菌率均低于ACCC 33109,其抑菌活性与碳源利用效率呈正相关。以α-D-葡萄糖为底物时,ACCC 33109、MU153和MU792抑菌率最高,分别为48.08%、56.17%和40.94%。分析原因可能是葡萄糖作为单糖最易被菌株吸收利用,从而菌株生长变快,菌丝量增多,产生大量的抑菌挥发性物质,这与文献报道一致。如詹艺舒等[29]研究发现,甲基营养型芽孢杆菌(Bacillus methylotrophicus)以α-D-葡萄糖为碳源时,菌体量高达 8.35 g·mL-1,对康氏木霉(Trichoderma koningii)抑菌率最高,为58.56%,显著高于乳糖、蔗糖和可溶性淀粉等碳源;蔡邵宁[30]研究表明,蛹虫草(Cordyceps militaris)以α-D-葡萄糖为单一碳源培养16 d时,菌丝干重超过7 g·L-1,对大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)和枯草芽孢杆菌(Bacillus subtilis)的抑制效果最好,抑菌率高于蔗糖和淀粉;吴惠贞等[31]研究表明,罗伊氏乳杆菌(Lactobacillus reuteri)分别以葡萄糖、蔗糖和麦芽糖为碳源时,活菌数均在109CFU/mL以上,对大肠杆菌的抑菌圈均在7.65 mm以上,抑菌率高于甘油和果糖等碳源。紫外诱变不仅改变了菌株对碳源的利用率,可能还改变了菌株对碳源的利用方式,使诱变菌株产生了不同的抑菌挥发性物质。MUKHERJEE等[32]研究表明,绿色木霉的诱变突变株G2以葡萄糖为碳源时,其代谢产物是野生株的2—3倍,包含绿胶霉素类物质和一些尚未鉴定的物质。
4 结论
通过原生质体紫外诱变和对扣法获得一株高产抑菌挥发性有机物的非洲哈茨木霉突变株MU153。与野生株ACCC 33109相比,该菌株抑菌率提高了16.68%,且菌落形态、菌落颜色以及分生孢子梗均有显著变化;以最适底物α-D-葡萄糖为碳源时,MU153抑菌率高达56.17%;盆栽试验中 MU153具有抑菌、促生的双重效果,是一株具有重要应用潜力的生防菌。
