不同栽培模式对夏玉米冠层结构及光合性能的影响
2020-11-26李静王洪章许佳诣刘鹏张吉旺赵斌任佰朝
李静,王洪章,许佳诣,刘鹏,张吉旺,赵斌,任佰朝
(山东农业大学农学院/作物生物学国家重点实验室,山东泰安 271018)
0 引言
【研究意义】玉米作为我国第一大粮食作物,在维护国家粮食安全中发挥重要作用,高产栽培模式探究对进一步提高玉米单产保证增产至关重要[1],合理增大种植密度是玉米高产的有效途径[2]。光照是影响作物生长发育的关键环境因子,它通过影响叶片发育、激活光合作用关键酶、增强生理反应需要的能量供应等过程调节作物光合作用[3]。密植群体易造成叶片间相互遮荫[4],导致群体内光分布不合理,影响叶片结构发育,直接影响叶片光合性能及群体光能利用效率,形成不合理的群体冠层结构[5]。叶绿体是作物进行光合作用的场所,群体内光照条件会对叶绿体结构产生影响,进而影响叶片光合性能[6]、同化物的积累及产量形成[7]。探究不同栽培模式群体内夏玉米冠层结构特性、叶片发育特点与光合性能的差异,阐明不同群体冠层结构对夏玉米叶片超微结构、叶片光合性能的影响,对进一步研发夏玉米高产栽培技术具有重要意义。【前人研究进展】增大种植密度、调整氮肥用量及施肥方式是研究较多的提高产量的栽培措施。单纯增大种植密度,会导致玉米叶片之间相互遮荫,中下部叶片受光不足,加快下部叶片及根系衰老速度[4,8]。氮肥合理运筹[9]、优化株行距配置[10-12]可调节叶片着生状态,构建合理的群体冠层结构,中下部叶片接收更多光能[13],改善群体内光环境。综合密植和优化肥料运筹的栽培措施可提高氮肥利用率[14]和光能生产效率[15]。光照会通过影响叶片发育、调节叶绿体超微结构,进而影响叶片光合作用[16],叶片受光不足时,叶绿体排布变得不规则,结构膨胀、基粒片层排列异常、基粒个数和片层数减少,叶绿体膜开始溶解,导致叶片早衰[17-18],影响其光合作用。【本研究切入点】尽管有较多学者对夏玉米群体结构、光合性能进行了研究,但多集中在密度、肥料等单一措施的影响,关于不同栽培措施对夏玉米群体发育及光合性能的综合影响的研究相对较少,难以系统解释夏玉米生长发育及产量形成过程中所受外界因素的综合影响,难以精准确定增产措施。【拟解决的关键问题】本文通过研究夏玉米不同栽培模式的群体冠层特性、叶片发育状况及其光合能力,从所处光环境及叶绿体结构两方面分析不同群体内叶片光合能力及产量差异的原因,为进一步制定可构建高效冠层结构的夏玉米高产栽培模式提供理论依据。
1 材料与方法
1.1 试验区概况
本试验于2018—2019年在山东省泰安市岱岳区马庄镇(35°58′41″N,116°58′22″E)进行,播前土壤耕层养分含量为有机质 9.22 g·kg-1,碱解氮 70.54 mg·kg-1,速效磷 35.75 mg·kg-1,速效钾 137.57 mg·kg-1。该区域为温带季风性气候,种植制度为一年两熟,夏玉米生育期内(6—10月)日平均气温、日光合有效辐射量、降雨量详见图 1。室内试验在山东农业大学作物生物学国家重点实验室进行。
1.2 试验设计

图1 玉米生育期内试验地的日平均气温、日光合有效辐射、日降雨量Fig. 1 Daily average temperature, effective photosynthetic radiation, and daily rainfall of the test site during the maize growth period

表1 密度及肥料运筹Table 1 Density and fertilizer management
本试验以玉米品种登海605为材料,在同一地块结合种植密度、肥水管理及种植方式设置超高产(SH)、高产高效(HH)、农户习惯(FP)3种栽培模式,各处理的具体种植密度、肥料管理详见表1。试验所用氮肥为包膜缓控尿素(PU,含N 42%)和普通尿素(U,含N 46%),磷肥为过磷酸钙(含P2O512%),钾肥为硫酸钾(含K2O 51%),有机肥料为山东友邦肥业科技有限公司生产的商品有机肥(含有机碳(干基)304 g·kg-1、P2O531.2 g·kg-1、K2O 30.4 g·kg-1、C/N为11.2)。试验为随机区组设计,各试验小区长18 m、宽12 m,3次重复,各小区之间设立1 m的隔离带。在小麦收获后旋耕(25 cm)灭茬,整平播种。夏玉米生育期内根据土壤墒情采用微喷带统一喷灌,遇涝及时排水。统一采用病虫害预防方案进行病虫害防控。
1.3 测定项目与方法
1.3.1 地上部干物质积累量 玉米生长至拔节期(V6)、大喇叭口期(V12)、吐丝期(R1)、吐丝后30 d(R1+30 d)、成熟期(R6)时,取各处理内长势一致的玉米植株5株,将植株按茎秆、叶片、雌穗(穗轴和籽粒)、雄穗、苞叶分开,105℃杀青30 min,80℃烘至恒重并称重,计算不同生育时期群体干物质积累量。
1.3.2 茎叶夹角、叶向值和叶面积指数 R1期分别于各小区选取长势一致的植株10株,穗位叶、穗位上叶及下叶为中部叶层,中部叶层以上为上部叶层,中部叶层以下为下部叶层。测量各层叶片叶长(Li)、沿叶片方向叶基部至叶片最高点的距离(Lf),用量角器测量茎叶夹角,并计算叶向值(LOV)。

式中,θi为叶片与水平面夹角,Lf为沿叶片方向叶基部至叶片最高点的距离,Li为叶片伸直时长度,n为叶片数。
拔节期(V6)每个处理内选取长势一致的植株5株,定株。分别于V6、V12、R1、R1+30 d、R6期测量所选定植株绿叶的叶长、叶宽。单株叶面积(m2)=∑完全展开叶的叶长(m)×叶宽(m)×0.75+∑未完全展开叶的叶长(m)×叶宽(m)×0.5;叶面积指数(LAI)=(单株叶面积×单位面积株数)/占地面积。
1.3.3 群体冠层结构 采用大田切片法测定R1期群体冠层垂直结构[16],在每个处理内选取2 m2(1 m×2 m)内的植株,从基部起以40 cm为每层高度,按照层高分层割取样品,每层按照茎秆、叶片、雌穗、雄穗分样。在烘箱内105℃杀青30 min,80℃烘干至恒重,并称重。
1.3.4 冠层光能截获率 采用SunScan(Delta,英国)冠层分析仪,在玉米生长至 R1期,选择晴朗无云的天气,于10:00—13:00测定各处理群体冠层内不同叶层及冠层顶部的光合有效辐射(PAR)。
光能截获率=PARi/TPAR×100%
式中,PARi为某叶层的PAR;TPAR为冠层顶部PAR。
1.3.5 叶绿体超微结构 在玉米R1期,在各处理中选取长势一致的植株,在其穗位叶片中段(避开叶脉)割取边长为0.5 cm的方形叶片,用3.3%戊二醛固定液(0.1 mol·L-1pH 7.2的磷酸缓冲液配制)固定,抽真空,4℃下固定24 h。用磷酸缓冲盐溶液洗3次,每次20 min,再将材料转移到锇酸中,4℃固定4 h,用磷酸缓冲盐溶液冲洗 3次。常规梯度(45%、55%、70%、85%、95%、100%)乙醇系列脱水,环氧丙烷置换。Epon812树脂包埋,70℃下聚合 8 h,LKB-V型切片机切割超薄切片,经醋酸双氧铀和柠檬酸铅双重染色后,用日立-600 型透射电镜随机选取视野观察并拍照。
1.3.6 净光合速率 在玉米R1期,选择晴朗无云的天气,于9:00—11:00使用CIRAS-Ⅲ(PP System,美国)光合仪,每个处理选具有代表性植株 10—15株,测定其穗位叶净光合速率(Pn)。
1.3.7 籽粒产量及产量构成因素 于玉米R6期,在每个处理内选取5个9 m2(5 m×1.8 m)具有代表性玉米带,将其全部果穗收获、晾晒,测定其产量和产量构成因素。
1.4 数据分析与作图
采用 Microsoft Excel 2010进行数据处理;采用DPS进行数据统计分析,用 LSD法做显著性分析(α=0.05);用Sigmaplot 14.0作图。
2 结果
2.1 不同栽培模式对夏玉米群体冠层结构的影响
栽培方式影响玉米叶片着生状态及生长发育,各叶层茎叶夹角均表现为FP>SH>HH,叶向值则表现为SH>HH>FP,SH和HH模式群体上部叶片上冲,利于中、下部叶片接收光能(表2)。全生育期内叶面积指数呈现先增大后降低的变化趋势,在吐丝期达到最大值,各个生育期内均表现为SH>HH>FP,在吐丝期后处理之间呈显著性差异(图2)。相比于FP模式,SH、HH模式群体中单位面积内干物质积累量显著提高;SH、HH模式群体内植株干重在120 cm以下的比例有显著增加,穗位叶及以下叶片的长势较好(图3),2年试验不同处理间变化趋势一致。

表2 不同栽培模式对夏玉米叶片着生状态的影响Table 2 Effects of different cultivation modes on the implantation status of summer maize
2.2 不同栽培模式夏玉米群体内光分布的差异
各冠层高度光能截获率均表现为SH>HH>FP,SH模式的光能截获率最大,漏光损失最小,HH模式次之,FP模式最易造成漏光损失,2年试验规律一致。2年试验SH、HH、FP模式中部叶层较上部叶层光能截获率分别平均增大39.67%、47.21%、45.04%,HH模式中、上部叶层结构最优(图4)。

图2 不同栽培模式群体叶面积指数在各生育时期的变化Fig. 2 Changes of leaf area index of populations in different cultivation modes at different growth stages
2.3 不同栽培模式对夏玉米叶绿体超微结构的影响
不同处理叶片叶绿体在外形上无明显差异,均为正常的“纺锤形”;SH、HH模式的叶绿体内部结构发育良好,FP模式发育相对较差。SH和HH模式的类囊体发育良好数目较多,基粒片层和基质片层排列整齐、清晰,细胞内膜结构完整;FP模式的叶绿体中类囊体发育相对较差,未发育完全的类囊体数目占比较大,且其基质片层模糊,且排列不齐(图5)。
2.4 不同栽培模式夏玉米穗位叶净光合速率的差异
夏玉米不同栽培模式的穗位叶吐丝期净光合速率表现为 SH>HH>FP,且处理之间差异显著,2年大田试验呈现相同的变化趋势。2年试验中,SH模式较FP模式分别增大26.09%、24.34%;HH模式较 FP模式分别增大 15.07%、18.02%;SH模式较HH模式分别增大9.57%、5.48%(图6)。
2.5 不同栽培模式对夏玉米干物质积累量及产量的影响
不同栽培模式干物质积累量表现为 SH>HH>FP。在2年试验中,干物质积累量SH、HH模式较FP模式平均增加27.74%、7.45%;对比玉米开花前、开花后干物质积累量的比例,与FP模式相比,SH、HH模式在开花后干物质积累量显著提高,SH、HH、FP模式干物质在吐丝后积累量占全生育期的比例分别为 64.38%、60.03%、58.04%(表 3)。SH、HH模式较 FP模式可显著提高夏玉米籽粒产量,SH模式较FP模式平均增产14.20%,HH模式较FP模式平均增产4.91%。与FP模式相比,SH、HH模式的穗粒数及千粒重降低,单位面积穗数显著提高。SH、HH模式籽粒产量提高的主要原因是单位面积穗数的增加(表4)。

图3 不同栽培模式下夏玉米吐丝期冠层结构垂直分布Fig. 3 Vertical distribution of canopy structure of summer maize during silking stage under different cultivation modes

表3 不同栽培模式夏玉米干物质积累量及吐丝前后分配比例Table 3 Dry matter accumulation and distribution ratio of summer maize before and after silking in different cultivation modes

图4 不同栽培模式群体光能截获率Fig. 4 Light energy interception rate of different cultivation modes

图5 不同栽培模式群体内叶片叶绿体的发育状况Fig. 5 Development of leaf chloroplasts in different cultivation mode populations
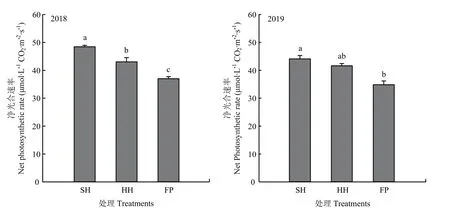
图6 不同栽培模式中夏玉米穗位叶吐丝期净光合速率Fig. 6 Net photosynthetic rate of panicle leaves of summer maize during silking stage under different cultivation modes

表4 不同栽培模式玉米籽粒产量及产量构成因素Table 4 Grain yield and yield components under different cultivation modes
3 讨论
叶片是植株进行光合作用的主要场所,是植物吸收、利用光能的最重要器官[19],叶面积指数是反映植株生长发育和光能利用率的重要指标,夏玉米要实现高产就要保持较高的叶面积指数[20-23],调节叶片着生状态和伸展方向,构建合理的冠层结构[21,24]。合理的冠层结构有利于叶片发育、形成适宜的群体内环境,可接收充足的光照,提高叶光合能力,从而提高干物质积累量及产量[25]。种植密度过高,上部叶片发育良好、生长健壮[26],导致植株间叶片相互遮荫[4],群体内光照不足,中下部叶片光能利用能力降低。适宜的肥料运筹、种植方式可调节植株生长发育状况[13,27],调整群体冠层结构使上层叶片上冲,群体内不同高度叶层的光照分布趋于合理化,保证叶片处于适宜的光环境[28],以提高光能利用率。本研究中,通过统筹各栽培措施构建的2种高产栽培模式,与农户生产模式相比具有较为合理的冠层结构。SH、HH模式叶面积指数显著大于 FP模式,且具有更长的叶面积指数高值持续期(图 2)。SH、HH模式群体上层叶片茎叶夹角小于FP模式、叶向值大于FP模式(表2)。对于120 cm以下叶片干物质积累量,SH模式显著大于FP模式,HH模式大于FP模式。SH、HH模式调节了上部叶片的着生状态,使上部叶片上冲,中下部叶层可接受充足的光能,既防止漏光损失、又减缓了高密植群体内叶片相互遮荫,SH模式中、下层叶片生长发育状况显著优于HH和FP模式,这是SH、HH模式可实现高产但增产水平不同的重要原因之一。
叶绿体是叶片进行光合作用的主要细胞器,叶绿体超微结构与植株叶片光合性能密切相关。发育良好的叶绿体呈纺锤形,靠近细胞膜排布在细胞内,类囊体结构完整,叶绿体基粒数目增加、基粒片层和基质片层排列紧密[29]。当受光不足时,叶片细胞及叶绿体结构会被破坏,导致光合系统受损,从而影响光合性能[18,30]。施用适量的氮、钾肥可保持番茄[31]、甘蔗[32]的叶绿体超微结构。在本研究中,SH、HH模式的叶绿体内部结构发育良好,FP模式发育相对较差。SH和HH模式的类囊体发育良好且数目较多,基粒片层和基质片层排列整齐、清晰,细胞内膜结构完整;FP模式的叶绿体类囊体发育相对较差,未发育完全的比例较高,基质片层模糊且排列不齐(图 5)。进一步说明SH、HH模式2个群体冠层结构适宜,群体内光环境良好,未造成叶片之间相互遮荫影响叶绿体结构发育,而且SH、HH模式的叶绿体结构更有利于进行光合作用。HH模式的叶绿体结构发育良好,但其净光合速率显著低于SH模式,这可能与光合相关酶的活性有关。
与农户生产模式相比,通过优化种植密度和肥料运筹等措施构建的超高产模式和高产高效模式可显著促进根系发育、提高氮肥利用率[14]和光能生产效率[15]。本试验结果表明,超高产模式和高产高效模式可实现增产的原因是优化了群体冠层结构,促进植株及叶绿体结构的发育,延缓叶片衰老,提高了叶片光合能力。
4 结论
相比于农户习惯管理模式,超高产模式、高产高效模式实现产量提高的原因是优化了群体冠层结构,促进叶片的发育,保证叶绿体结构的完整性,显著提高了叶片光合能力。与超高产模式相比,高产高效模式减小肥料施用量,其群体结构适宜且叶片发育良好,是更有助于利用光能的栽培模式。
