氧化锆材料电化学检测汞的性能研究
2020-11-26张重宠孙宇峰
张重宠,孙宇峰
(安徽工程大学 机械工程学院,安徽 芜湖 241000)
水中的重金属离子污染是对生物系统以及人类有着直接危害的一类环境污染问题。它们能够在食物链之间传导,并且会在人体中长期存在从而加剧毒性效应,破坏正常细胞活动。虽然急性重金属中毒很少见,但长期慢性低度毒性可能更具危害性,导致慢性疾病。因此,开发直接、高灵敏度地测定溶液中重金属浓度的工具具有重要意义[1-2]。
迄今为止,重金属离子的检测已应用了多种技术,包括质谱法、种光学方法和电化学方法。电化学分析具有低功耗、高灵敏度和广泛适应性,电化学分析方法检测重金属具有很大的潜力[1,3]。电化学分析方法检测重金属离子的关键是修饰在工作电极上的材料设计与合成,实质是重金属离子被电催化还原后得到电化学信号的过程,在这个过程中材料吸附重金属离子的能力对电化学信号有重要影响。据报道在非贵金属纳米材料中,Fe2O3、TiO2、ZrO2都是吸附重金属离子的理想材料[4-5]。因此,利用这些材料检测电化学重金属离子的研究得到较大的进展。例如,研究暴露于不同晶面或具有不同形态的Fe2O3表现出对Pb(Ⅱ)的电化学行为差异,或者缺陷型的TiO2实现了Cu(Ⅱ)的高电化学检测灵敏度。与具有窄带隙的n型半导体(如Fe2O3和TiO2)不同,ZrO2是具有宽带隙(约5 eV)的p型半导体,其导电性更差,因此在电子传递过程中受到极大的阻碍[6-7]。氧化锆的多功能性可通过掺杂异价氧化物(例如MgO、La2O3和Y2O3)而产生晶体中的原子或点缺陷,或通过氧空位的形成影响电荷之间的电荷平衡,这些都会极大地影响氧化锆(SZ)的结构、热、机械和电性能[8-12]。例如在氧传感器和高温燃料电池中,掺杂后的氧化锆所形成的缺陷会导致高离子电导率[11,13]。氧化锆还可用作非均相催化的载体材料,除此之外氧化锆表面常常展现出酸碱两面性,使得它能够作为特异性催化剂[9,14-15]。基于以上的考虑,考察掺杂后的氧化锆用于电化学检测重金属离子具备一定的研究意义。
1 实验部分
1.1 实验所需试剂
氯化锆(分析纯,上海阿拉丁生化科技股份有限公司);尿素(中国上海国药控股化学试剂有限公司);乙酸钠(NaAc)、乙酸(HAc)、磷酸二氢钾(KH2PO4)、磷酸氢二钠(Na2HPO4)、氯化铵(NH4Cl)、氨水(NH3·H2O)、硝酸铅Pb(HNO3)2、硝酸铜Cu(HNO3)2、硝酸汞Hg(HNO3)2、八水合硫酸镉(3CdSO4·8H2O)。
1.2 实验过程
以氯化锆(ZrCl4)为金属源,采用尿素-玻璃法制备了ZrO2纳米颗粒。在一个典型的合成过程中,将1 g ZrCl4(≥99%,阿拉丁工业公司)粉末分散在乙醇(2 mL)中,达到目标浓度,形成稳定、澄清的溶液。加入尿素(1 g,大于99%,阿拉丁工业公司),搅拌至尿素溶解,溶液完全澄清。将溶液老化12 h,以完成尿素对锆的络合作用,得到无色透明溶胶。随后将溶胶放置在管式炉中煅烧,控制炉中空气速率为100 mL·min-1,升温速率为10 ℃·min-1,达到800 ℃后继续保持3 h结束,冷却至室温后取出[16]。在该反应中缓慢的初始加热对于避免过度起泡和溶剂从玻璃状前体中喷发释放非常重要。尿素可以作为稳定剂来控制纳米颗粒的大小。该方法具有试剂简单、成本低、无毒等优点,且制备的产品具有较高的催化活性和广阔的应用前景。使用与ZrO2相同的前驱体和加热循环合成纯多晶样品Zr2ON2,合成过程的唯一不同之处在于将通入管式炉中的气体换成氨气。氮化处理前后无需净化,无副产物和副反应。
1.3 修饰电极的制备
首先,依次用0.3 μm和0.1 μm氧化铝粉末对裸露的玻碳电极表面进行打磨处理,随后将电极在稀HNO3溶液、乙醇和超纯水中依次超声处理2 min,以获得干净的表面。将1 mg氧化锆样品均匀分散在5 mL去离子水中后,取7 μL悬浮液滴涂到玻碳电极表面,使用N2吹干干燥后静止过夜后使用。
1.4 电化学测试
一切的电化学实验都是在CHI 660D电化学工作站(上海晨华仪器有限公司)上进行,其中以铂丝电极作为对电极,Ag/AgCl电极为参比电极,工作电极是玻碳电极。循环伏安法(CV)和电化学阻抗谱(EIS)测试时都是在铁氰化钾溶液中进行。电化学检测重金属离子选择的是方波溶出伏安法(SWASV),在自配置的NaAc-Hac缓冲液中搅拌进行。电化学检测第一个是电沉积过程,电压选择为-1.3 V沉积120 s,使得足量的Hg(Ⅱ)被电化学还原为Hg(0)并富极在工作电极的表面,接着在-1.0~0.4 V的电位区间进行SWASV测试并关闭搅拌,记录下该电位范围的SWASV图。最后继续开动搅拌,设置电位为1 V持续100 s使电极表面的重金属离子被解附重新回到缓冲溶液中。
1.5 表征与电化学测试
X射线衍射(XRD)的测量是在X'Pert上进行操作,使用的是Cu Kα辐射源,在2θ(10°~90°)范围内使用入射角为ω=0.3°的平行X射线束进行设置。使用计算机控制的CHI 660D稳压器(上海晨华仪器有限公司)进行了一切的电化学实验。通过聚焦离子束(FIB)(AURIGA,ZEISS Co)检查氧化锆的形貌。
2 结果与讨论
2.1 材料表征
Zr2ON2和ZrO2的SEM图像如图1所示。其中Zr2ON2为不规整近球状的纳米颗粒,而ZrO2的形貌与前者较为相近,但是颗粒的边角更加尖锐,呈现类似块状形貌。为了确定Zr2ON2中氮元素确实存在,使用扫描电镜对小区域的样品作了元素能谱分布。在图1c中显示了Zr2ON2的EDS只含有Zr、O、N三种化学元素,其中O元素所占含量最高,为43.1%,N元素所占含量为34.6%,Zr元素所占含量最低,为22.3%。ZrO2的元素能谱图如图1d所示。O元素所占含量最高,为19.2%,而Zr元素所占含量最低,为8.4%,它们的比例约等于2∶1,而多余的Si和C为看电镜所需要的硅片得到。
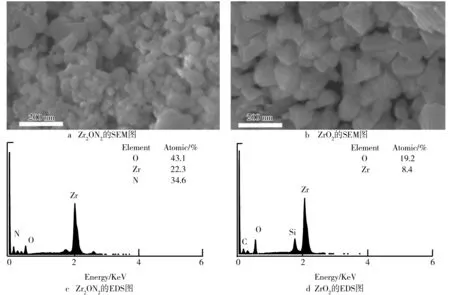
图1 Zr2ON2、ZrO2的SEM图以及Zr2ON2、ZrO2的EDS图
XRD是一种可靠的确定材料组成的方法,利用此方法能够进一步确定所合成样品为Zr2ON2和ZrO2。图2a是合成出的Zr2ON2测试得到的XRD谱图,其中最明显的30.5°位置对应为(222)晶面,峰角尖锐表明Zr2ON2结晶程度高,该谱图与Zr2ON2标准卡片(JCPDS NO.87-0173)对比重合度高,确认得到Zr2ON2样品无误。ZrO2的XRD谱图如图2b所示。可以看出图2b中出峰位置更为复杂,结晶度同样明显,与标准卡片中ZrO2(JCPDS NO.86-1451)切合度最高,得出了该ZrO2晶体为单斜相。
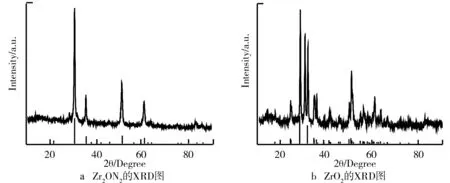
图2 Zr2ON2、ZrO2的XRD图
bare GCE、ZrO2和Zr2ON2的电化学测试CV曲线图如图3a所示。当使用bare GCE在铁氰化钾中测试时,所得的曲线在-0.2 V出现的峰为铁离子的标准溶出峰位置,并且电流值最高。将ZrO2和Zr2ON2修饰在玻碳电极之后测试的溶出峰位置都发生了明显的偏移,电流值相对于bare GCE也都有一定程度的降低,由此可知ZrO2的峰值电流略低于Zr2ON2显示的峰值电流。图3b显示的bare GCE、ZrO2和Zr2ON2的电化学阻抗图谱同样是在铁氰化钾中进行,其中bare GCE近似于一条直线表示电阻最小,而ZrO2的曲线半径大于Zr2ON2的曲线半径,这意味着ZrO2的电阻大于Zr2ON2。以上两项测试结果正对应,导电性从大到小依次为bare GCE、Zr2ON2、ZrO2。以上的CV与EIS都是在浓度为5 mM铁氰化钾溶液中进行测试,其中CV测试扫描数据为0.1 V/s。
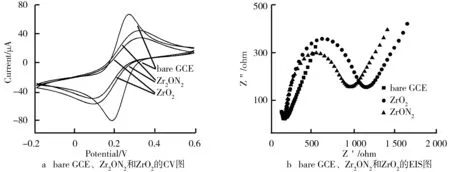
图3 bare GCE、Zr2ON2和ZrO2的CV图及EIS图
2.2 电极活性面积测试
在进行电化学检测重金属离子之前,需要对bare GCE以及材料修饰在玻碳电极后电极的活性面积进行测试,以方便计算后续获得更为精确的每单位面积灵敏度。bare GCE、ZrO2和Zr2ON2材料修饰在玻碳电极后的电化学活性面积是通过在不同扫描速率(0.01~0.2 V·s-1)记录下对应的CV曲线计算得出,如图4所示。Randles-Sevcik方程如式(1)所示。
ip=2.69×105×n3/2ACD1/2v1/2,
(1)
式中,n为电子转移数;A为活性面积;C为探针浓度;D为溶液扩散系数。由式(1)分别得到bare GCE、ZrO2/GCE和Zr2ON2/GCE的电化学活性面积为0.071 cm2、0.065 cm2、0.045 cm2。可以发现裸玻碳的电化学活性面积最大,而修饰了材料后的电化学活性面积都会相对减小,再根据此数据计算出更精确的单位活性面积灵敏度。
2.3 条件优化
一直以来被报道的电化学检测都是在特定的电解质溶液中进行,在实验中研究了电解质、pH值、沉积时间和沉积电位4个因素对重金属离子出峰情况的影响,以发现最佳的实验条件从而应用于之后的检测。首先在醋酸盐缓冲液(NaAc-HAc)、氯化铵溶液(NH4Cl-NH3·H2O)与磷酸盐缓冲液(PBS)中分别对相同浓度的Hg(Ⅱ)进行了电信号的发现,以上三种缓冲液都是在pH=8的情况下进行,其中对于仅通过基础液混合未能得到该pH值的PBS与NaAc-HAc,使用0.1 M NaOH进行了调节。电解质溶液、沉积电位、pH值、沉积时间分别对Hg(Ⅱ)峰值电流的作用如图5所示。由如图5a能够清楚地看到当选用NaAc-HAc作为电解质时所得到的电信号最为明显,而在PBS的时候则几乎没有溶出峰出现。这表示NH4Cl-NH3·H2O最适于对Hg(Ⅱ)的检测,所以在接下来的三种因素优化时都以NH4Cl-NH3·H2O为标准液。
沉积电位作为电还原Pb(Ⅱ)的重要因素之一,对Hg(Ⅱ)的峰值电流起到一定的作用。在图5b中显示了电势范围在-0.9 ~-1.5 V之间的电流变化,其中当沉积电位为-1.1 V时得到最大电流值。通常沉积电位被认为电势越负,越有利于重金属离子的还原,然而在实验中当电势超过-1.1 V时,电流数值反而出现了减小的现象。这是由于沉积电位过负,玻碳电极表面会分生析氢反应产生气泡,减小电极活性面积,导致所富极的重金属离子量降低减弱了电流强度,因此选择-1.1 V为最佳沉积电位。
接下来,继续在酸性pH 6.0到中性pH 11.0的范围内进行了多次实验并分别记录下每个pH值所对应的峰值电流,如图5c所示。由图5c可以看到,随着pH值的增加,电流值呈现不断升高的趋势,而当pH=8时,电流值达到最高,随后又呈现了下降的趋势。这种现象在其他材料对Hg(Ⅱ)的检测时同样出现,可以将它归因于吸附相关联。已有报道同样在对Hg(Ⅱ)的吸附实验中,展现出最大吸附量是在pH=8的附近,而在电化学检测过程中,对Hg(Ⅱ)的吸附是重要的步骤,因此吸附越多的Hg(Ⅱ)所显示的电流值也就越高。
与沉积电位相同,沉积时间决定着所富极的重金属离子含量的多少,相同电势时间越久,越多的重金属离子被还原富极在电极的表面。从图5d能够看到,从沉积时间50 s延长到190 s,电流值也不断得到了提高。同时我们也看到所示线段的斜率在90 s到110 s之间最大,而超高130 s之后电流增加得不多,结合提升实验效率的要求,选择130 s作为理想沉积时间。
2.4 电化学检测汞离子
完成了优化实验之后,在最佳优化条件下比较了ZrO2和Zr2ON2分别修饰后的玻碳电极对Hg(Ⅱ)的电化学行为表现,得到的SWASV图如图6所示。由图6可知,当Hg(Ⅱ)的浓度不断增加,在0.1 V时出现了不断上升的溶出峰,0.1 V位置对应为Hg(Ⅱ)的溶出范围,而随着浓度增加,相应的信号峰也出现明显的提升。根据各图中数据的电流值比上所对应浓度再除以各电极单位活性面积,得出了它们检测Hg(Ⅱ)的灵敏度,根据此计算ZrO2和Zr2ON2的灵敏度分别为655 μA·cm-2·μM-1,1457 μA·cm-2·μM-1,另外使用3σ方法能够得出理论检测限(LOD)分别为0.04 μM,0.02 μM。在以上计算中发现Zr2ON2/GCE的单位活性面积低于ZrO2/GCE并远低于bare GCE,然而所获得灵敏度却极大优于ZrO2/GCE,这表明虽然由于材料的覆盖,牺牲了电极一定的活性面积,但是由于ZrO2自身较好的吸附性与氮掺杂所引起材料性质的变化,改善了材料表面Hg(Ⅱ)之间的作用方式,使得缓冲液中更多的Hg(Ⅱ)被有效富集在电极的表面,从而显著增强检测的效果。此外根据世界卫生组织发布的水中Hg(Ⅱ)安全标准为0.042 μM,我们开发的ZrO2理论检测限都低于这个标准,有希望将它们应用于实际水样的检测当中。
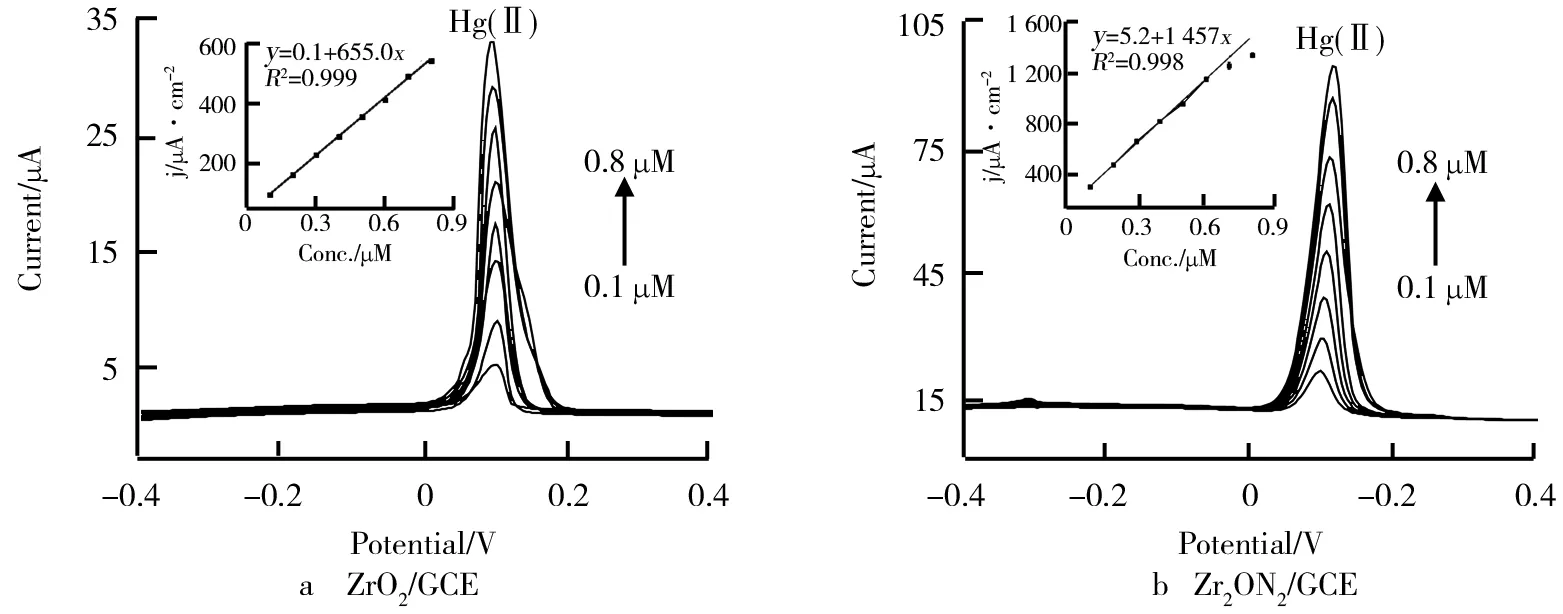
图6 用于检测Hg(Ⅱ)的SWASV响应和线性方程式
2.5 稳定性
通过在NH4Cl-NH3·H2O缓冲溶液中加入0.2 μM Hg(Ⅱ)来评估Zr2ON2/GCE的稳定性,结果如图7所示。从图7可以看出,在这10个循环中Hg(Ⅱ)的峰值电流的相对标准偏差(RSD)为4.22%,小于5%,表明电极具有优异的稳定性。
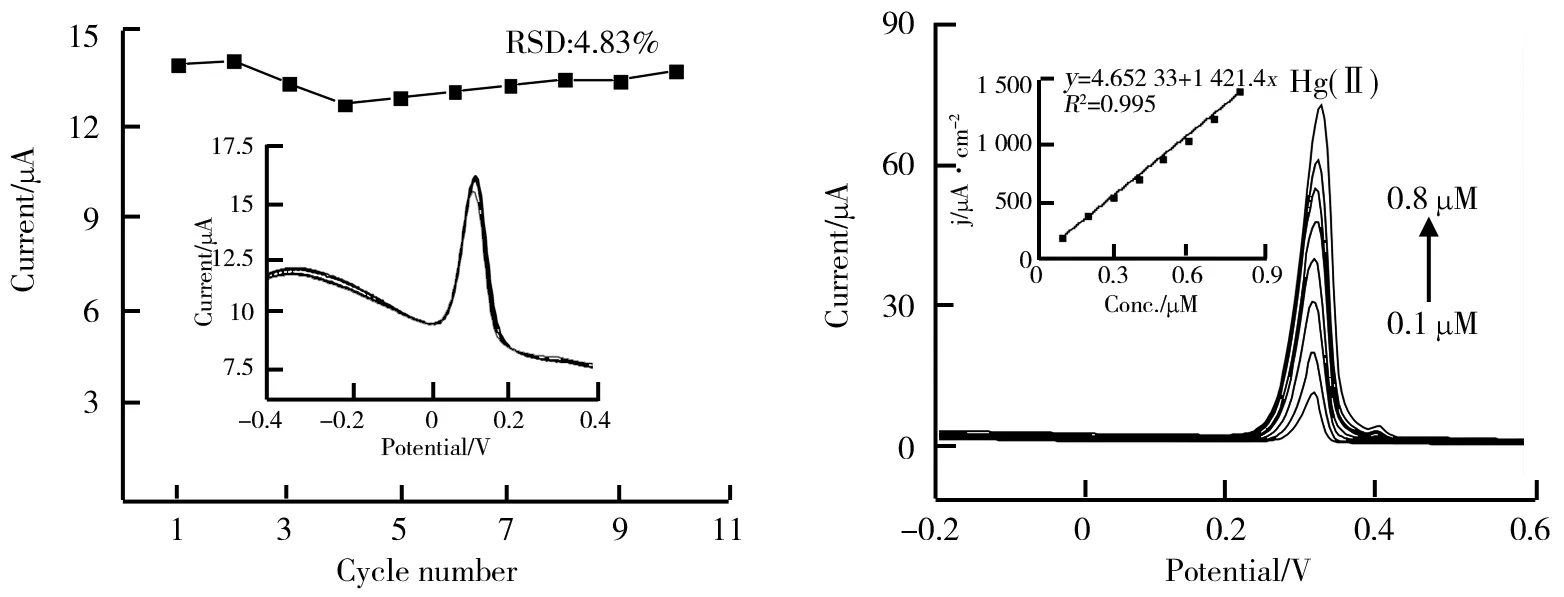
图7 在相同浓度(0.2 μM)下Zr2ON2/GCE对Hg(Ⅱ)的稳定性 图8 复杂背景下水样中Zr2ON2/GCE对Hg(Ⅱ)的SWASV响应和线性方程式
2.6 实际水样检测
为了验证Zr2ON2/GCE是否可以实际应用于真实水样的复杂背景中,水样品取自合肥市董铺水库,并与0.1 M NH4Cl-NH3·H2O溶液(pH 8.0)以1∶4的比例混合,制成10 mL混合溶液进行测试。标准添加Pb(Ⅱ)后,在该混合溶液中的Zr2ON2/GCE的SWASV响应和线性方程如图8所示。由图8可知,即使在检测实际水样时,灵敏度仍可达到1 421.4 μA·cm-2·μM-1,与在缓冲溶液中获得的值相差不大,再一次验证了Zr2ON2在实际检测中的实用性。
3 结论
研究通过用相同实验方法制备了氧化锆和氮掺杂的氧化锆,考察了它们分别在电化学检测Hg(Ⅱ)时的电化学表现。通过SEM观察到两者在形貌上无明显变化,XRD确认了它们在物相上的不同即成功地合成了氧化锆和氮掺杂的氧化锆。根据电化学数据得出,氮掺杂后的氧化锆对Hg(Ⅱ)的灵敏度明显优于氧化锆,其中氮掺杂的氧化锆对Hg(Ⅱ)的灵敏度达到了1 457 μA·cm-2·μM-1,且利用3σ方法所得出的理论最低检测限为0.03 μM。此外在对实际水样的测试中,氮掺杂的氧化锆同样能够维持高灵敏检测,同时氮掺杂氧化锆修饰后的玻碳电极还表现出较高的稳定性。此项工作为后续研究低成本的修饰电极材料提供了一定的参考范围,推动了金属氧化物在电化学表现上的理解。然而,关于金属氧化物的本征性质与电化学行为之间的关系还有待进一步探究。
