基因敲除去乙酰化酶SIRT1并靶向结合miR-138-5p诱导前列腺癌细胞PC-3氧化应激和凋亡
2020-11-25张志明聂志勇邱建新
张志明,薛 炜*,聂志勇,桑 楠,邱建新,张 波
(1.空军军医大学第二附属医院 泌尿外科,陕西 西安710038;2.空军军医大学第二附属医院 肿瘤科,陕西 西安710038)
前列腺癌是男性中最常见的癌症,近年来其发病率和死亡率不断上升,是男性癌症相关死亡的第二大原因[1]。根据2012年GLOBOCAN的估计,2012年全世界大约有110万前列腺癌新发病例,约301.000人死亡[2]。大多数临床局限性前列腺癌患者接受根治性前列腺切除术或放疗。随后,20%至40%的患者最终出现生化复发,一旦诊断出复发,这些患者就接受雄激素剥夺治疗。虽然雄激素剥夺治疗可以延长患者的总生存期,降低患者的肿瘤负担,但最终所有患者都对雄激素剥夺治疗产生了耐药性,出现了去势性前列腺癌[3]。目前前列腺癌的分子机制尚未完全阐明,因此,研究前列腺癌的分子机制,有助于临床干预,延缓甚至抑制肿瘤的发生发展。SIRT1是沉默信息调节因子2(silent information regulator 2,Sir2)基因的哺乳动物同源基因,通过DNA修复蛋白P300、P73 NF-kB、肿瘤抑制蛋白FOXO转录因子和P53等非组蛋白去乙酰化参与多种细胞过程,包括增殖、凋亡和侵袭,在肿瘤发生中起着重要的作用[4-6]。本研究通过基因敲除去乙酰化酶SIRT1,探究其靶向结合miR-138b-5p对前列腺癌细胞PC-3氧化应激和凋亡的作用,以期为前列腺癌开发新的治疗策略提供实验依据。
1 材料与方法
1.1 试剂与仪器
DMEM培养液、胎牛血清、胰酶(Invitrogen公司,美国); MatrigelTM底膜基质(BD公司,美国);二喹啉甲酸(bicinchoninic acid,BCA) 蛋白定量试剂盒(PIERCE公司,美国);裂解缓冲液(Beyotime,Shanghai,China);Caspase-3,Caspase-9,Bcl,Bax抗体 (NEB公司,美国);HRP标记的山羊抗小鼠二抗(Santa Cruz公司,美国);ELX808酶标仪(Bio-Tek公司,美国) ;凋亡检测试剂盒(BD Bioscience,San Jose,CA,USA) ;CO2培养箱(Thermo公司,美国);Transwell小室及人工基底膜(BD公司,美国) ;电热恒温水浴箱(上海医疗器械七厂);高速低温离心机(Beckman公司,美国);电泳槽,电转仪(Bio-Rad公司,美国);流式细胞仪(Becton-Dickinson,San Jose,CA,USA);ChemiDoc XRS 凝胶/发光图像分析仪(Bio-Rad公司,美国);凝胶成像系统GDS-800 UVP (UVP公司,美国)。
1.2 细胞培养
PC-3细胞株在补充有10%胎牛血清的DMEM培养基中生长。所有细胞均在含有5%CO2的培养箱中37℃培养。细胞汇合率达到85%以上时用0.25%胰酶进行消化传代。
1.3 实验方法
1.3.1细胞转染
将PC-3细胞传代培养于6孔板中。培养24 h后根据转染试剂盒说明书用Lipofectamine 3000(Invitrogen,Carlsbad,CA)单独或联合转染inhibitor和 shRNA-SIRT1,将细胞分为4组:对照组(Control),miR抑制剂组(inhibitor),SIRT1敲除组(shRNA-SIRT1),miR抑制剂组+SIRT1敲除组(inhibitor+ shRNA-SIRT1),48 h后对各组进行相应检测。
1.3.2RT-PCR
使用TRIzol试剂提取总RNA,并通过超微紫外光分光光度计在260和280 nm处测定吸光度。 按照试剂盒说明书,使用Super RT cDNA试剂盒合成cDNA。 此外,使用Quantifast○RSYBR○RGreenPCR Kit进行PCR,分别在95℃ 15 s 和60℃ 60 s条件下使用ABI 7500将反应激活。用于该反应的SIRT1,miR-138-5p和GAPDH的引物如下:SIRT1:5’-TGGCAAAGGAGCAGATTAGTAGG-3’,5’-CTGCCACAAGAACTAGAGGATAAGA-3’;miR-138-5p:5’-GCTTAAGGCACGCGG-3’,5’-GTGCAGGGTCCGAGG-3’;GAPDH:5’-CATCATCCCTGCCTCTACTG-3’,5’-GCCTGCTTCA-CCACCTTC-3’。
1.3.3克隆形成实验
PC-3细胞单独或联合转染shRNA-SIRT1和inhibitor 48 h后,细胞移入6孔板,每孔1000个细胞,孵育10天。在培养过程中每3天更换一次新鲜的完整培养基。细胞菌落洗涤2次,用3 ml甲醇固定15 min,加入1 ml/孔0.1%结晶紫孵育15 min,PBS洗涤3次。记录细胞克隆数,并在显微镜下观察。
1.3.4Hoechst33258细胞凋亡染色
将细胞用预冷的PBS洗涤2次,每次5 min。细胞在4℃下于 4%多聚甲醛中固定1 h。然后每孔加入1 ml Hoechst33258荧光染料,总共15 min,每次5 min,然后弃去染色液,在暗处用PBS洗涤2次,每次5 min。用荧光显微镜观察细胞并拍照(OLYMPLUSIX73,Japan) 。细胞的核浓缩和分裂被用作细胞凋亡的指标。
1.3.5试剂盒检测SOD,MDA,LDH的含量
分别采用SOD,MDA,LDH试剂盒测定PC-3细胞上清液 SOD,MDA,LDH的含量。操作步骤严格按照大鼠SOD,MDA,LDH试剂盒说明书进行。
1.3.6流式细胞术
采用Annexin V-FITC凋亡检测试剂盒对PC-3细胞凋亡诱导进行分析和测量。用不同浓度的二氢杨梅素或二甲基亚砜作对照,在6孔板中以每孔3×106个细胞的密度培养48 h。然后用过氧化氢处理细胞,在5% CO2、37℃的培养箱中诱导氧化应激。细胞用冷PBS冲洗3次,然后用100 μl结合缓冲液处理。然后用3 μl Annexin V-FITC(BD Bioscience) 和10 μl 碘化丙啶孵育20 min。采用流式细胞仪进行细胞凋亡。
(2)午餐或下午茶吃多了的人。比如午餐吃了自助餐,下午又没有很大的运动量,到晚餐时间一点都不饿。对于这种情况,可以考虑不吃晚餐。还有下午加餐的朋友,点心、水果、酸奶、坚果、薯片、饼干……样样都不少,吃得饱饱的,也可以考虑省去晚餐。
1.3.7免疫印迹法
使用裂解缓冲液裂解细胞样品。然后,使用BCA蛋白质测定试剂盒定量蛋白质浓度。含有20 mg蛋白质的样品在10%SDS-PAGE中分离,然后转移到聚偏二氟乙烯膜上。用5%脱脂牛奶室温封闭蛋白2 h,随后加入一抗(Caspase-3,1∶1000;Caspase-9,1∶1000;Bcl,1∶1000,Bax 1∶1000;) 于4℃封闭过夜,第二天加入对应二抗室温封闭1 h,最后滴加ECL,设置曝光参数,检测目的条带对应化学发光强弱。
1.4 统计学方法
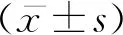
2 结果
2.1 miR-138-5p和SIRT1在PC-3细胞中的表达量变化
如图1所示,miR-138-5p mimic转染PC-3细胞后,与Control组比较,miR-138-5p的表达显著升高(P<0.05),SIRT1的表达显著降低(P<0.05)。inhibitor转染PC-3细胞后,与Control比较,miR-138-5p的表达显著降低(P<0.05),SIRT1的表达显著升高(P<0.05)。
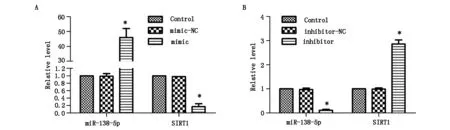
图1 miR-138-5p和SIRT1在前列腺癌细胞PC-3中的表达
2.2 基因敲除SIRT1抑制PC-3细胞克隆形成
如图2所示,单独或联合转染inhibitor,shRNA-SIRT1后,与Control组比较,SIRT1的表达水平显著降低(P<0.05)。与Control组比较,inhibitor组PC-3细胞克隆形成率显著升高(P<0.05)。与Control组比较,shRNA-SIRT1组PC-3细胞克隆形成率显著降低(P<0.05)。与shRNA-SIRT1组比较,inhibitor+ shRNA-SIRT1组PC-3细胞克隆形成率显著升高(P<0.05)。

图2 克隆形成实验检测细胞的生长能力
2.3 基因敲除SIRT1促进PC-3细胞凋亡
如图3所示,Control组细胞核具有弥散且较均匀的荧光。inhibitor组细胞核荧光较Control组更均匀。shRNA-SIRT1组细胞核呈不规则形状或染色质聚合分离,具有密集的颗粒荧光。inhibitor+ shRNA-SIRT1组细胞核致密染色、收缩减少,染色状态改善。与Control组比较,inhibitor组细胞凋亡率显著降低(P<0.05);shRNA-SIRT1组细胞凋亡率显著升高(P<0.05)。与shRNA-SIRT1组比较,inhibitor+ shRNA-SIRT1组细胞凋亡率显著降低(P<0.05)。

图3 Hoechst33258染色检测细胞凋亡
2.4 基因敲除SIRT1对SOD,MDA,LDH含量的影响

表1 不同组SOD,MDA,LDH,GSH的含量
2.5 基因敲除SIRT1促进PC-3细胞凋亡
正常PC-3细胞经染色后发出红色荧光,提示线粒体膜电位完整。如图4所示,与Control组比较,inhibitor组线粒体膜电位显著降低 (P<0.05),shRNA-SIRT1组线粒体膜电位显著升高(P<0.05)。与shRNA-SIRT1组比较,inhibitor+shRNA-SIRT1组线粒体膜电位显著降低(P<0.05)。

图4 不同组PC-3细胞线粒体膜电位变化
2.6 基因敲除SIRT1抑制线粒体凋亡通路相关蛋白的表达
如图5所示,与Control组比较,inhibitor组裂解的Caspase-3,Caspase-9及Bcl/Bax的蛋白表达水平均显著降低(P<0.05);shRNA-SIRT1组裂解的Caspase-3,Caspase-9及Bcl/Bax的蛋白表达水平均显著升高(P<0.05)。与shRNA-SIRT1组比较,inhibitor+ shRNA-SIRT1组裂解的Caspase-3,Caspase-9及Bcl/Bax的蛋白表达水平均显著降低(P<0.05)。

图5 不同组caspase-3,caspase-9,Bcl-2,Bax蛋白表达的变化
3 讨论
前列腺癌是男性最常见的癌症,是癌症相关死亡的主要原因[7]。大部分患者最终进展为化疗耐药,出现局部复发、远处转移、死亡[8]。传统的化疗由于其疗效低、副作用大,在正常组织中应用效果有限。因此,急需开发一种新的治疗策略来更有效地治疗前列腺癌。
miR-138-5p与SIRT1存在靶向关系。已有研究表明SIRT1是miR-138-5p结合的直接靶点[9]。研究发现,SIRT1基因可以通过上调癌基因和上皮-间质-间充质转化促进肿瘤生长,在前列腺癌中,SIRT1基因的表达水平升高[10]。同样,Kuzmichev等人通过免疫组织化学分析证明,SIRT1在人前列腺癌小鼠模型的癌组织中过表达,而在正常组织中的表达非常低[11]。SIRT1可通过调控多种miRNA的表达影响癌症的发展,但尚未有研究报道SIRT1是否能通过靶向调控miR-138-5p的表达影响前列腺癌细胞氧化应激和凋亡。本研究发现miR-138-5p与SIRT1在前列腺癌细胞中的表达呈负调控,用miR-138-5p inhibitor抑制miR-138-5p表达后,SIRT1的表达显著升高。因此,可进一步研究基因敲除SIRT1靶向结合miR-138-5p对前列腺癌的影响。
癌细胞无限增殖是癌症发生发展的重要机制。SIRT1过表达与更高水平的前列腺瘤PC-3细胞增殖相关[6]。研究发现基因敲除SIRT1后的胰腺癌细胞增殖明显受到抑制[12]。相关研究中,基因敲除SIRT1同样能抑制人宫颈癌细胞的增殖[13]。而有关SIRT1在前列腺癌中的研究,研究证实SIRT1可以促进人类前列腺癌细胞的增殖[14]。Duan等人研究发现miR-34a通过下调SIRT1表达抑制前列腺癌细胞增殖[15]。与前人研究结果一致,本研究发现基因敲除SIRT1明显降低PC-3细胞克隆形成率,抑制前列腺癌细胞的克隆形成,表明基因敲除SIRT1可抑制PC-3细胞的增殖生长,从而抑制前列腺癌的发展。
LDH是一种可靠的细胞毒性指标,细胞的内源性抗氧化能力与SOD、 MDA有关。研究报道称前列腺癌患者MDA水平升高,SOD活性降低,LDH活力升高[16,17]。SOD是另一种内源性抗氧化剂,可以中和自由基,保护细胞免受活性氧损伤[18]。 MDA是脂质过氧化途径的主要终产物,是前列腺癌患者氧化状态的标志物[19]。因此本研究通过试剂盒测定SOD、 MDA和LDH,与前人研究结果一致,结果发现基因敲除SIRT1提高PC-3细胞SOD活性,降低MDA含量及LDH活力,表明基因敲除SIRT1可能通过改变PC-3细胞的内源性抗氧化能力来诱导氧化应激。
抑制细胞生长和诱导细胞死亡是抑制肿瘤生长的两种主要手段。在凋亡信号的刺激下,线粒体跨膜电位(ΔΨm)的下降出现在凋亡的特征性细胞核改变之前,而ΔΨm的下降必然引起凋亡。研究发现MiR-204通过靶向SIRT1/p53通路增强阿霉素治疗的前列腺癌细胞线粒体凋亡[20]。SIRT1 siRNA能显著增强多西他赛诱导的裂解的caspase-3表达,并促进22RV1/DR细胞凋亡[6]。同样,Wang等人研究发现SIRT1的抑制导致Bax表达增加,激活的caspase-3激活以及Bcl-2的表达降低,从而导致缺氧/再灌注诱导的心肌细胞凋亡[9]。与前人研究结果相似,本研究发现基因敲除SIRT1使线粒体膜电位明显升高,提高裂解的Caspase-3,Caspase-9及Bcl/Bax的蛋白表达水平,表明基因敲除SIRT1能促进前列腺癌细胞的凋亡。
综上所述,通过基因敲除去乙酰化酶SIRT1,靶向结合miR-138-5p抑制前列腺癌PC-3细胞的生长,诱导PC-3细胞氧化应激和凋亡,以及促进凋亡相关蛋白的表达,表明基因敲除SIRT1可缓解前列腺癌的发生发展,为将来临床防治前列腺癌提供实验依据。
