外泌体中miR-223的表达对胃癌细胞的生物学影响
2020-11-25付立业隋承光孟凡东
王 宁,付立业,隋承光,孟凡东,李 妍*
(1.沈阳市第六人民医院 肿瘤介入综合治疗科,辽宁 沈阳110006;2.中国医科大学附属第一医院 肿瘤研究所,辽宁 沈阳110001)
微小RNA(miRNA)具有调节基因表达的能力,通过与靶mRNA结合调控基因表达。miRNA的检测被广泛应用于恶性肿瘤的诊治[1]。miRNA-223(miR-223)高度保守,既可以作为致癌基因也可以作为抑癌基因在多种肿瘤中发挥作用,miR-223通过靶向调控肿瘤细胞中不同基因的表达及其下游信号通路,参与肿瘤细胞的增殖、凋亡、转移及耐药性等生物学行为。miR-223作为致癌基因还是抑癌基因参与胃癌的生物学功能,目前研究甚少。本文研究血清外泌体miR-223与胃癌相关基因表达的相关性,进一步探讨miR-223在胃癌中的作用。
1 材料与方法
1.1 材料
1.1.1 一般资料
选取2019年1月至2019年12月中国医科大学附属第一医院肿瘤内科收治的100例确诊胃癌患者(病例组),均未接受放、化疗等治疗;其中男59例,女41例;年龄25-75岁,平均(48.54±10.11)岁。另选取50例健康志愿者(健康对照组)以及50例良性胃病患者(良性疾病对照组)。健康对照组中男26例,女24例;年龄25-65岁,平均(44.23±9.03)岁。良性胃病患者男28例,女22例;年龄20-73岁,平均(47.22±11.13)岁。3组性别构成比和年龄比,差异均无统计学意义(P>0.05)。
1.1.2样本采集
采集患者及健康志愿者外周静脉血(5 ml/人),置于抗凝真空管中,离心留取上清液-80℃保存,待后续实验,采用外泌体试剂盒对剩余血液进行血清外泌体提取。
1.2 方法
1.2.1实时荧光定量PCR检测研究对象血清外泌体中miR-223的表达水平 Trizol法提取细胞总RNA,逆转录cDNA,反应体系为70℃ 10 min,42℃ 60 min,72℃ 15 min,扩增40个循环,每个标本3个复孔。miR-223上游:5′-CGGACGTGTATTTGACAAGC-3′,下游:5′-CAGTGCAGGGTCCGAGGTA-3′。
1.2.2外周血细胞因子检测
ELISA法检测患者及对照组外周血中IGF-1R的表达,依据说明书进行。
1.2.3细胞转染
将处于对数生长期的胃癌MKN-28细胞消化后,接种于6孔细胞培养板中,细胞数为5×105/孔。当细胞生长达到40%-50%时,根据Lipofectamine 2000脂质体说明书进行操作,分别将microRNA空白序列(miR-223 NC,NC组)及miR-223模拟物(miR-223 mimic,miR-223 mimics 组)按终浓度为50 nmol/L转染到胃癌MKN-28细胞。细胞转染24h后,应用RT-PCR法检测细胞的转染效率及细胞中miR-223的表达。
1.2.4增殖及侵袭相关基因表达的检测
采用RT-PCR对胃癌细胞增殖及侵袭相关基因进行检测。方法同1.2.1。miR-223引物序列,上游:5′-CGGACGTGTATTTGACAAGC-3′,下游:5′- CAGTGCAGGGTCCGAGGTA-3′;PTEN引物序列,上游:5′-ACACGACGGGAAGACAAGTT-3′,下游:5′-TCCTCTGGTCCTGGTATGAAG-3′;β-catenin引物序列,上游:5′-AAGTTC TTGGCTATTACGACA-3′,下游:5′-ACAGCACCTTCAGCACTCT-3′;N-cadherin引物序列,上游:5′-GTGCCATTAGCCAAGGGAATTCAGC-3′,下游:5′-GCGTTCCTGTTCCACTCATAGGAG-3′;E-cadherin引物序列,上游:5′-TCCATTTCTTGGTCTACGCC-3′,下游:5′-CACCTTCAGCCAACCTGTTT-3′;GAPDH引物序列,上游:5′-GAGTCAACGGATTTGGTCGT-3′,下游:5′-TTGATTTTGGAGGGATCTCG-3′。PCR反应条件:预变性94℃ 5 min,变性94℃ 30 s,退火53℃ 45 s,延伸72℃ 45 s,扩增40个循环周期,最后延伸72℃ 10 min。每个样本检测3个复孔。
1.3 统计学分析
采用SPSS22.0软件对数据进行分析处理,计量资料用均数±标准差表示,组间数据的差异采用单因素方差分析进行比较,Pearson相关分析检验两变量之间的相关性。P<0.05视为差异有统计学意义。
2 结果
2.1 各组人群血清外泌体中miR-223和IGF-1R的表达
胃癌患者血清外泌体中miR-223的表达明显低于良性胃病患者和健康对照组(P<0.05);血清中IGF-1R的表达明显高于良性胃病患者和健康对照组(P<0.05),如图1。

图1 血清外泌体中miR-223和IGF-1R的表达水平
2.2 miR-223的表达与胃癌分期的相关性
比较不同TNM分期胃癌患者血清中miR-223的表达水平,结果显示Ⅲ、Ⅳ期胃癌患者血清中miR-223的表达水平明显低于Ⅰ、Ⅱ期(P<0.05),且差异有显著的统计学差异(图2)。

图2 血清中miR-223的表达水平与胃癌分期的相关性
2.3 胃癌细胞系MKN-28中miR-223的表达
采用RT-PCR方法检测细胞中miR-223的转染效率,结果显示,与空白对照组和miR-223 NC组相比,转染miR-223后的MKN-28细胞中miR-223的表达显著增加,且差异有统计学意义(P<0.05),如图3。

图3 胃癌细胞系MKN-28中miR-223的表达水平
2.4 胃癌细胞中PTEN的表达
为验证miR-223对胃癌细胞增殖的影响,采用RT-PCR检测各组胃癌细胞中增殖基因PTEN的表达,结果显示,miR-223组中PTEN的表达明显高于miR-223 NC组(P<0.05)和Control组(P<0.05),表明miR-223可以上调PTEN的表达,进而抑制胃癌细胞的增殖(图4)。

图4 胃癌细胞中增殖基因PTEN的表达水平
2.5 胃癌细胞中侵袭基因的表达
为验证miR-223对胃癌细胞上皮间质转化及侵袭的影响,采用RT-PCR法检测相关基因的表达,结果显示,miR-223组中β-catenin、N-cadherin和E-cadherin的表达水平均高于miR-223 NC组(P<0.05)和Control组(P<0.05),揭示miR-223的过表达可抑制胃癌上皮间质转化(图5)。
3 讨论
miR-223在多种肿瘤细胞和组织中高表达,与肿瘤的恶性程度有一定相关性[2]。miR-223通过与肿瘤靶基因及相关信号通路作用,参与肿瘤细胞的增殖、凋亡、转移侵袭等生物学过程。
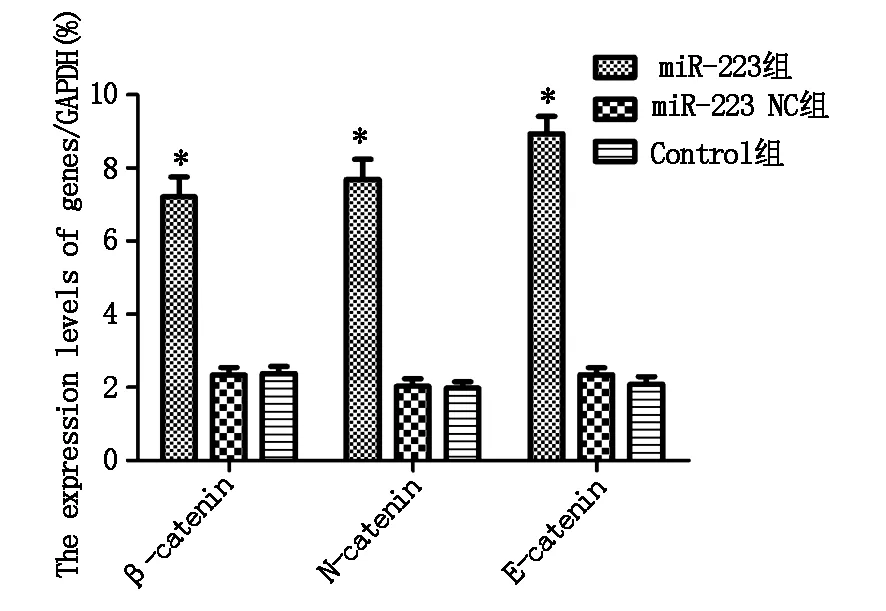
图5 胃癌细胞中侵袭基因的表达水平
外泌体(exosomes)具有传递细胞间信号的作用[3]。研究表明,胰腺炎大鼠模型腺泡细胞外泌体中含有大量的miRNAs,参与激活肺泡巨噬细胞,调节炎症反应,可见,外泌体携带的miRNA一定程度可以反映细胞的病理状态[4]。为研究miR-223在胃癌中的作用,本实验检测了血清外泌体中miR-223和IGF-1R的含量,显示,胃癌患者miR-223的表达明显低于良性胃病患者和健康对照组;IGF-1R的表达明显高于良性胃病患者和健康对照组,且miR-223和IGF-1R的含量呈负相关。
胰岛素样生长因子1受体(IGF-1R)是miR-223的一个靶点。miR-223在肝癌患者血清及组织中低表达,而过表达miR-223后,肝癌细胞的增殖明显受到抑制,但其凋亡率增加,同时导致IGF-1R的表达下降[5]。过表达的miR-223通过抑制PI3K/Akt/S6信号通路,还可以增强非小细胞肺癌对厄洛替尼的敏感性,从而抑制肿瘤细胞生长,诱导细胞凋亡[6,7]。这也表明,同一肿瘤细胞中miR-223可以同时调控多个靶点,发挥不同作用。
低表达的PTEN可以引起多种肿瘤的发生,负向调节PI3K/AKT信号通路活性,促进细胞增殖。为验证miR-223对胃癌细胞增殖的影响,本实验设计了miR-223过表达细胞组,miR-223 NC组和Control组,结果miR-223过表达中PTEN的表达明显高于其他两组,表明PTEN作为新发现的与肿瘤关系密切的抑癌基因[8],miR-223可以通过上调PTEN的表达,抑制胃癌细胞增殖。研究发现,过表达的miR-223与胃癌患者的预后成负相关,miR-223通过下调肿瘤抑制因子EPB41L3的表达,促进细胞的侵袭转移[9]。乳腺癌细胞中miR-223 通过调控FOXO-1的表达,促进细胞的增殖[10]。表明高水平的miR-223与肿瘤侵袭有关,且能促进肿瘤细胞增殖。
miR-223参与调控多种肿瘤细胞的生理过程[11]。上皮-间质转化(Epithelial-stromal transformation,EMT)过程可以导致肿瘤细胞迁移及侵袭能力增强。本实验分析了上皮间质转化相关基因的表达,结果显示,miR-223组中β-catenin、N-cadherin和E-cadherin的表达均高于miR-223 NC组和Control组,揭示胃癌细胞miR-223过表达可抑制胃癌上皮间质转化。EMT过程中,通过切断E-cadherin介导的细胞黏附,诱导N-cadherin的表达和释放β-catenin[12]。
E-cadherin表达降低或缺失可导致上皮细胞间黏附能力的减弱或丢失[13]。β-catenin可与E-cadherin结合共同参与细胞间的黏附,当调节β-catenin的系统失调时,胞浆内游离状态的β-catenin即可参与Wnt信号途径的作用[14]。胃癌发生发展中,E-cadherin与β-catenin的表达也相应出现异常改变[15]。E-cadherin表达减少或丢失是细胞失分化的一种危险因素,也是判定患者预后不良的标志,更是肿瘤侵袭转移的重要原因之一[16]。肿瘤细胞中β-catenin基因突变还可使β-catenin与E-cadherin的结合位点发生异常,不能形成E-cadherin/β-catenin复合体,进而使β-catenin从细胞膜脱离而游离到细胞浆中。
目前,对miR-223的研究日渐增多,明确miR-223在胃癌中的调控机制,将为胃癌患者寻找新的治疗靶点提供更可靠的理论依据。
