海藻糖对冻存海马神经元电生理特性的影响
2020-11-25王国祥周志远
王国祥, 刘 娟, 周志远, 刘 旭*
1. 复旦大学脑科学研究院,上海 200032 2. 复旦大学附属中山医院放疗科,上海 200032 3. 复旦大学附属中山医院神经内科,上海 200032
海马作为中枢神经系统的重要组成部分,与学习、记忆、癫痫密切相关[1-3],是神经生物学研究的热点。体外培养的海马神经元是研究神经系统疾病常用的载体,在神经生物学研究中被广泛应用[4-6]。实验过程中,海马神经元需要从胎鼠或乳鼠提取进行原代培养,无法像肿瘤细胞株进行体外传代培养,因此无论从动物保护、动物伦理,还是尽量减少资源浪费和保存珍稀动物模型细胞样本的角度出发,神经元冻存后复苏再利用都显得尤为重要。
冻存细胞的常规操作是缓慢降温,最后保存于-80℃冰箱或者液氮中。目前常用的冷冻保护剂有二甲基亚砜(DMSO)、乙二醇和甘油等。既往研究[7-10]大多对冻存后海马神经元的形态进行观察,而未检测其电生理功能,仅Quasthoff等[11]利用多电极微阵列(MEA)进行了皮层神经元冻存后整体神经元放电情况观察。海藻糖是一种非渗透性保护剂,由2个葡萄糖分子构成,能稳定生物膜和蛋白质结构,使生物体免受氧化应激的损伤,可应用于多种细胞和器官冻存中[12-14]。本实验采用无血清冻存液、DF12+10% DMSO冻存液、DF12+10% DMSO+海藻糖冻存液冻存细胞,评估其对海马神经元冻存复苏后电活动的影响,为建立稳定的原代海马神经元保存技术提供基础。
1 材料与方法
1.1 原代海马神经元分离与混合培养 采用石莹等[15]的方法:孕18~19 d SD大鼠,经乌拉坦深度麻醉后,剖腹取胎鼠5~6只,快速去除头皮及颅骨,取出完整的脑组织,分离海马并去除血管。用预热好的0.25%胰蛋白酶消化10~15 min,期间摇匀2~3次,用含10% 磷酸盐缓冲液(FBS)的DF12培养基终止消化,用经火焰抛光的玻璃滴管吹打20次左右,直到无明显的组织块。离心收集细胞,接种于预先用贴壁因子多聚赖氨酸(PDL)包被过的24孔板中。培养后每隔3 d更换NB27培养基(每次均为半换液)。第14~17天进行膜片钳检测。
1.2 海马神经元冷冻保存及复苏 海马神经元培养当天,分别用无血清冻存液(无血清组)、DF12+10% DMSO(DF12+DMSO组)、DF12+10% DMSO+0.1 mol/L海藻糖(DF12+DMSO+海藻糖组)冻存。
7 d后取出冻存的海马神经元,快速放入37℃水浴箱中解冻,然后以1 000r/min离心5 min,除去冻存液,对收集得到的海马神经元计数、接种。冻存成活率定义为复苏当日计数的海马神经元与原代分离的海马神经元数目之比。
1.3 神经元电生理记录 玻璃电极经拉制后,电阻为3~5 MΩ,当电极尖端与神经元形成GO封接后,负压吸破细胞,随后进行全细胞模式下电压钳或者电流钳记录。采集电流经放大器Axonpatch 700B放大,由Digital 1440A采集后储存。记录动作电位时,细胞外液含NaCl 128 mmol/L、葡萄糖 30 mmol/L、Hepes 25 mmol/L、KCl 5 mmol/L、CaCl22 mmol/L、MgCl21 mmol/L,pH为7.3;细胞内液含K-gluconate 125 mmol/L、KCl 10 mmol/L、乙二醇双四乙酸(EGTA)5 mmol/L、Hepes 10 mmol/L、Tris-磷酸肌酸 10 mmol/L、MgATP 4 mmol/L、 NaGTP 0.5 mmol/L, pH为7.3。记录微抑制性突触后电流(mIPSC)时,在上述记录动作电位的细胞外液中添加河豚毒素(TTX,1 μmol/L)、2-氨基-5-膦酰戊酸(APV,25 μmol/L)、二硝基喹酮(DNQX,20 μmol/L),细胞内液含CsCl 140 mmol/L、EGTA 10 mmol/L、Hepes 5 mmol/L、CaCl22 mmol/L、MgATP 2 mmol/L、NaGTP 0.3 mmol/L、QX-314 5 mmol/L。记录微小兴奋性突触后电流(mEPSC)时,在上述记录动作电位的细胞外液中添加TTX 1 μmol/L、Bicuculline 20 μmol/L;内液与上述记录动作电位内液相同。
1.4 观察指标 观察原代神经元及冻存神经元复苏培养后形态、成活率、动作电位。Burst样放电神经元定义:持续去极化超过10 mV,在整个去极化放电过程中有连续不少于5个动作电位发放,定义为1次Burst样放电,10 min内有2次及以上Burst样放电则定义该神经元为Burst样放电神经元[16]。mIPSC与整个神经网络中抑制性神经递质γ-氨基丁酸(GABA)的释放量、抑制性突触数目和GABA受体相关[17-18];mEPSC与兴奋性神经递质谷氨酸的释放量、兴奋性突触数目和受体相关[19-20]。
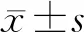
2 结 果
2.1 细胞形态学 培养成熟的原代未冻存神经元胞体饱满,细胞周围有光晕,经MAP2染色发现树突光滑无间断点(图1);接种2 h后可观察到细胞贴壁;接种24 h后,神经元伸出较长的轴突,其中星形胶质细胞伸出片状伪足进行贴壁生长。无血清组和DF12+DMSO组复苏后,神经元的树突和轴突生长缓慢,而经DF12+DMSO+海藻糖组复苏后的神经元生长情况与原代未冻存海马神经元接近(图2)。
2.2 海马神经元成活率 海马神经元采用不同的冻存液冻存7 d后复苏,测定其成活率。计数发现,添加海藻糖的DF12+DMSO+海藻糖组成活率最高,且与无血清组有较大差异(P<0.01,图3)。
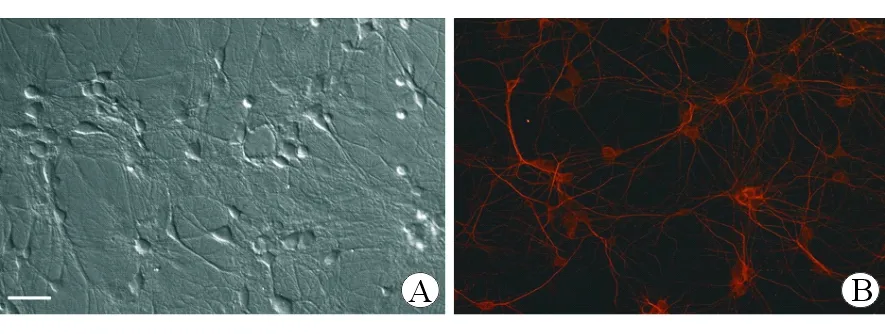
图1 原代未冻存海马神经元体外培养形态

图2 海马神经元体外培养24 h轴突生长情况

图3 不同冻存液冻存7 d后细胞存活率
2.3 动作电位发放 神经元经膜片钳记录显示,原代未冻存海马神经元中有Burst样放电的神经元约占20%。无血清组和DF12+DMSO组神经元中Burst样放电神经元占比升高(P<0.05),DF12+DMSO组神经元中Burst样放电内动作电位频率显著升高(P<0.001);而DF12+DMSO+海藻糖组神经元中Burst样放电神经元占比与原代未冻存海马神经元接近(图4)。
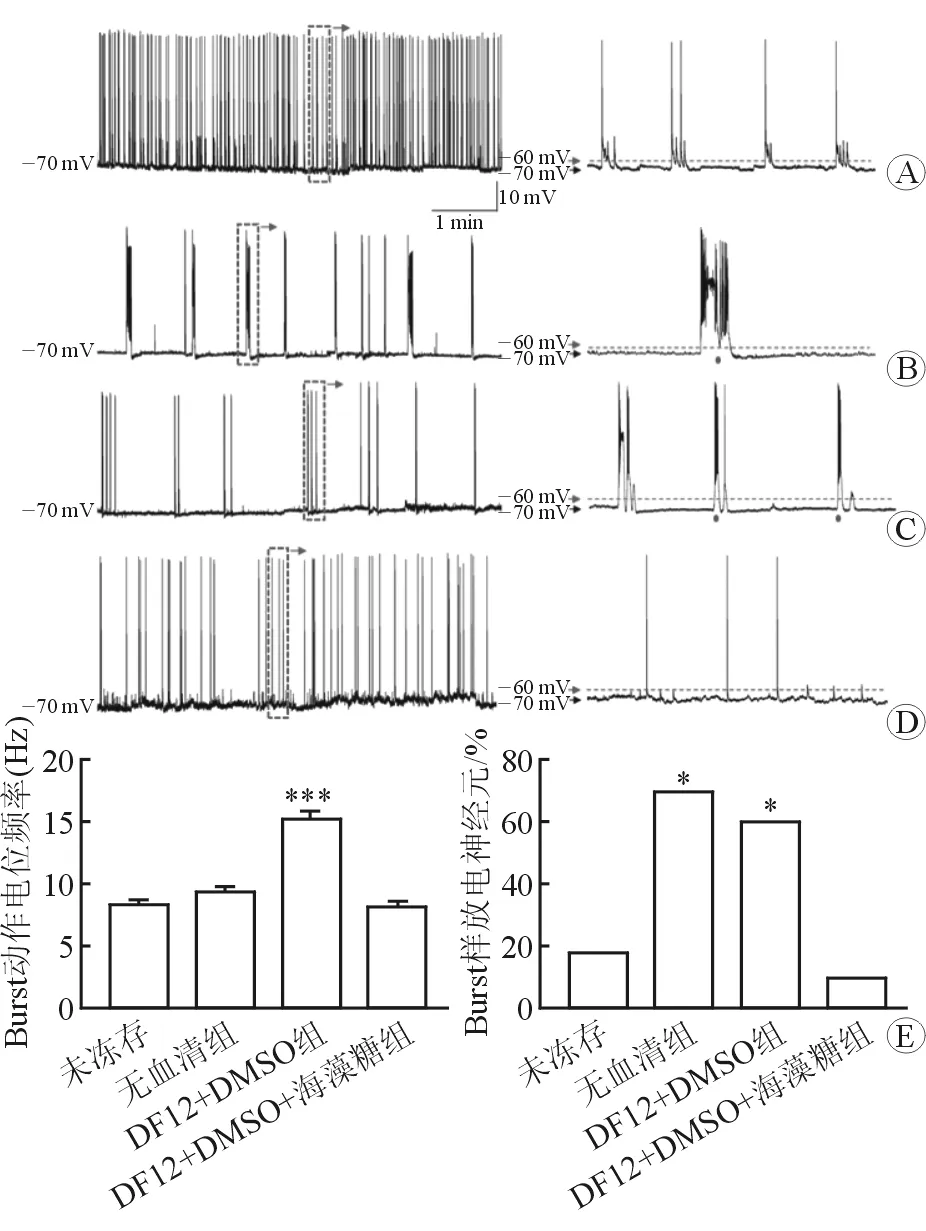
图4 未冻存和经冻存后的海马神经元动作电位发放比较
2.4 mEPSC和mIPSC 与原代未冻存海马神经元相比,经3种不同冻存液冻存过的神经元mEPSC幅度变化均较小,频率略升高,但差异无统计学意义(图5)。与原代海马神经元相比,无血清组和DF12+DMSO组神经元的mIPSC幅度显著下降(P<0.001),DF12+DMSO组神经元的频率显著下降(P<0.01);而DF12+DMSO+海藻糖组神经元的mIPSC幅度和频率均无明显变化(图6)。
3 讨 论
DMSO是常用的冻存保护剂,但是DF12+(10%~20%)DMSO冻存后的海马神经元的电生理特性是否改变,目前鲜见探索。神经元培养的特点是形成神经网络和电活动。本研究显示,体外分离培养的原代海马神经元具有典型的“三角形”椎体神经元形态,表面光滑、轮廓清晰,Burst样放电的神经元比例低。

图5 原代未冻存和经冻存后的海马神经元mEPSC比较
图6 原代未冻存和经冻存后的海马神经元mIPSC比较
目前,海藻糖对低温保存细胞,例如胰岛、皮肤、脐带血、肾细胞等均表现出较好的保护效果[21-24]。并且,海藻糖在器官(如气管、肺脏等)的保存中取得了满意的临床效果[25-27]。
第1次冻存神经元是在1953年,由Luyet和Gonzales[28]完成。Paynter[29]对于各种神经元的冻存方法进行过总结。Fortin等[30]将冻存后的神经干细胞诱导成神经元样细胞后进行动物活体移植,发现与未冻存细胞效果无明显差异。有研究[31]将冻存后的内侧神经节隆起(MGE)核团的神经元冻存后移植到动物体内,发现其能形成神经网络,且与正常GABA能神经元形态接近。但上述研究仅关注了神经元的形态和复苏存活率,而忽视了神经元的电生理特性改变的可能。Seggio等[10]冻存大鼠脊髓背根神经节(DRG)神经元后发现,冻存后的DRG神经元的轴突生长速度与原代培养的DRG神经元接近。本研究也发现,利用无血清冻存液和DF12+10%DMSO冻存后,海马神经元的轴突生长速度减慢,而利用含海藻糖的冻存液冻存后轴突生长速度与原代神经元类似。有研究[11]用MEA记录发现,皮层神经元经冻存后整体放电频率与原代培养的皮层神经元类似。本研究发现,用DF12+10%DMSO或冻存肿瘤细胞株常用的无血清冻存液冻存神经元后,单个神经元的放电特点和神经元网络均改变,与原代未冻存海马神经元的放电特点有较大差异。已有文献[32-33]表明,0.1 mol/L的海藻糖在动物精子的冻存中对其具有保护作用。本研究发现,添加0.1 mol/L海藻糖的冻存液冻存海马神经元后,神经元的电生理特性与原代未冻存神经元类似,可能是由于海藻糖能使抑制性神经元的数目减少,或对神经元细胞膜表面的GABA受体起保护作用,从而未诱导Burst样放电产生。同时,本研究中DF12+DMSO+海藻糖组成活率也提高,神经元细胞形态与原代未冻存海马神经元类似。
DMSO保护细胞的机制可能是其与水形成氢键改变了水变成冰的速度,同时进入细胞内减少细胞脱水,使细胞免受高浓度盐离子损伤。海藻糖不能穿透细胞膜进入细胞内,其保护海马神经元的具体机制尚不明确[34],目前主要有2种假说。(1)水替代假说:海藻糖在细胞脱水时取代水分子与细胞膜的磷脂双分子层和膜蛋白结合保护其天然结构[35];(2)玻璃态假说:海藻糖与邻近分子在-30℃左右形成玻璃态,该温度远高于DMSO形成玻璃态所需温度,玻璃态扩散系数低,可以使生物大分子维持比较稳定的空间结构[36]。另有研究[37]表明,海藻糖可以抑制炎症、氧化应激反应;且星形胶质细胞可以产生内源性海藻糖供神经元利用,促进神经元树突生长[38]。海藻糖保护神经元可能是多种机制共同作用的结果,从神经元功能、网络和成活率角度讲,建议在冻存海马神经元时冻存液中添加海藻糖。
综上所述,本研究采用含海藻糖的冻存液冻存原代海马神经元后,神经元的电生理特性优于不含海藻糖的冻存液冻存的海马神经元。本研究为提高原代海马神经元的利用率、保存珍贵海马神经元标本奠定了基础。
