肠系膜上动脉压迫综合征2例报告
2020-11-25翁成钊周朝晖林思慧唐启瑛孙达龙
翁成钊, 周朝晖,2, 王 超, 林思慧, 唐启瑛, 孙达龙,2*
1. 复旦大学附属中山医院厦门医院消化科,厦门 361000 2. 复旦大学附属中山医院消化科,上海 200032 3. 复旦大学附属中山医院厦门医院放射科,厦门 361000
肠系膜上动脉压迫综合征(superior mesenteric artery syndrome, SMAS),又称十二指肠瘀滞症,是肠系膜上动脉(superior mesenteric artery, SMA)与腹主动脉(abdomial aorta, AO)间夹角变小,压迫十二指肠水平段引起的临床综合征。其在临床上比较少见,容易被误诊、误治。为提高临床对SMAS的认识,现将本院近期诊治的2例病例报告如下。
1 病例资料
1.1 患者1 患者男性,37岁,因“体质量减轻8年,进食后腹胀1年”入院。患者近8年来体质量减轻15 kg左右,近1年来进食后出现明显腹胀,伴有嗳气、上腹隐痛(钝痛),进食2 h后腹痛逐渐缓解,无腹泻,偶有恶心呕吐,呕吐后症状缓解。2018年10月外院就诊时腹部超声结果:肝右叶稍高回声,前列腺囊肿;胃镜结果:食管胃黏膜异位,慢性非萎缩性胃炎伴胆汁反流。予以质子泵抑制剂、促胃肠动力药物治疗未见好转。2019年2月21日来我院就诊。近1年来因“腹胀”曾服用中药(具体不详),服用4个月后发现肝功能异常,保肝治疗后未见好转。患者结婚多年,未育。入院查体:体型消瘦,身高为174 cm,体质量为46 kg,体质量指数(BMI)为15.2 kg/m2;浅表淋巴结未及肿大;心肺听诊无异常;舟状腹,腹软,无压痛,未扪及腹块,移动性浊音阴性,振水音阴性,肠鸣音4次/min。入院查血常规、甲胎蛋白(AFP)、癌胚抗原(CEA)、CA199、高敏感C-反应蛋白、血沉、补体C3、补体C4、肿瘤坏死因子、IL-6、IL-10,均未见异常;自身抗体、免疫固定电泳未见异常。查甲状腺功能,示游离三碘甲状腺原氨酸降低(1.9 pmol/L,正常参考值为3.1~6.8 pmol/L),余未见异常。促肾上腺激素水平(8:00)为34.71 pg/mL(正常范围为7.2~63.3 pg/mL);皮质醇激素水平(8:00)为396.3 nmol/L(正常范围为73.8~291.0 nmol/L);铜蓝蛋白0.18 g/L(正常参考值为0.2~0.6 g/L),IgG4未见异常。肝功能:丙氨酸氨基转移酶112 U/L;天冬氨酸氨基转移酶64 U/L,余正常。24 h尿酮浓度及24 h尿酮含量未见异常。嗜肝病毒血清学指标阴性,自身免疫性肝炎指标阴性,无眼角膜色素环(K-F环)。肠镜未见异常。腹部、盆腔增强CT示:SMA与AO夹角偏小(约20°),盆腔少量积液(图1A)。消化道钡餐检查示轻度胃下垂,胃炎,十二指肠SMAS。胃呈无力型,胃内可见多量潴留液,蠕动波正常,胃排空速度尚可;十二指肠球部三角形对称,未见明显龛影及激惹征,水平段可见笔杆状压迹,近端十二指肠稍扩张,可见逆蠕动波,余十二指肠未见明显异常(图1B,图1C)。结合患者病史及辅助检查,诊断为SMAS。予以促胃肠动力药物、少食多餐,体位治疗(餐后俯卧、膝胸位或左侧位),症状改善后出院。
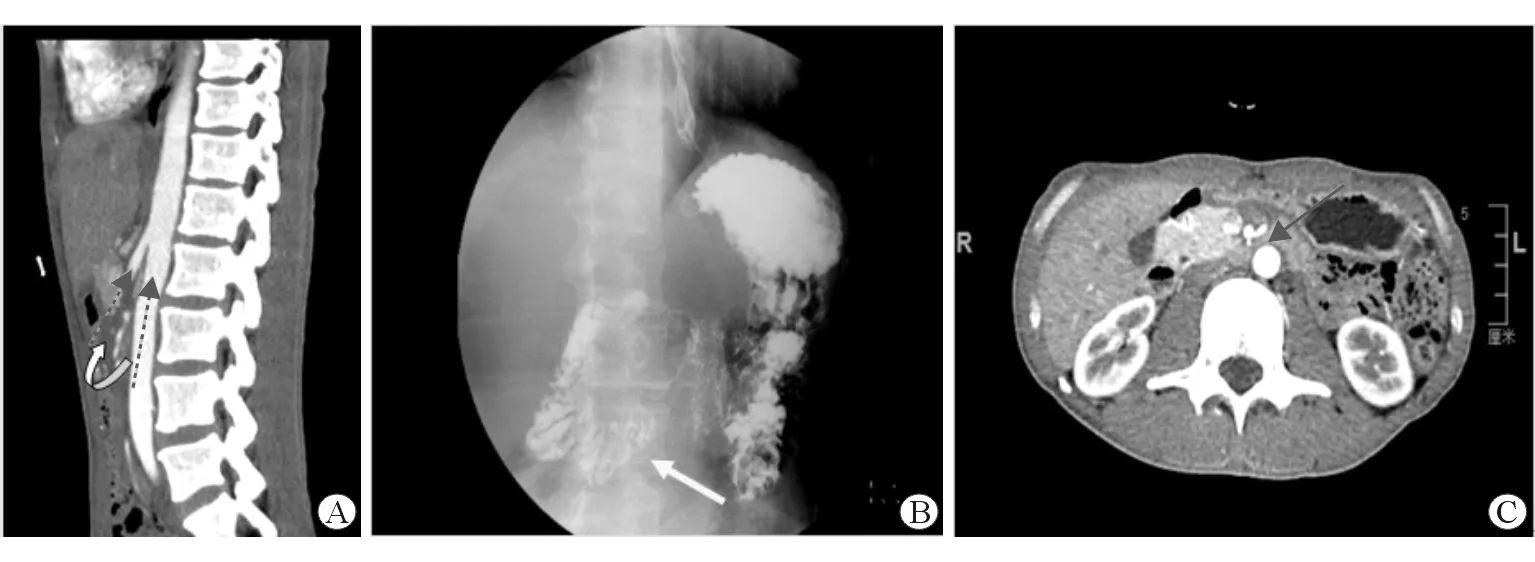
图1 患者1入院检查影像学资料
1.2 患者2 患者男性,15岁,因“反复恶心呕吐6年,再发2 d”入院。患者近6年来反复出现恶心呕吐,伴有反酸、左上腹隐痛,多次外院就诊。腹部平片示腹部激惹征,结肠内较多气便影存留。腹部超声:胆囊内实性病变,胆囊内泥沙样结石可能,肝胰脾未见异常;上消化道造影:瀑布胃;胃镜:慢性浅表性胃炎伴胆汁反流;肠镜未见明显异常;头颅MRI未见异常。予促胃动力、抑制胃酸分泌治疗后好转。患者入院前2 d再次恶心呕吐,伴有持续性上腹部隐痛,膝胸位可缓解。2019年9月18日来我院就诊,入院查体示消瘦,身高166 cm,体质量46 kg,余体征未见异常。患者既往地中海贫血5年。本次入院查血红蛋白为112 g/L,余检验指标未见异常。腹部增强CT:SMA与AO夹角缩小,角度约为24.2°,左肾静脉及十二指肠水平部受压。诊断为十二指肠SMAS。予以禁食、营养支持治疗后,逐渐开放流质饮食加用肠内营养液,给予促胃肠动力药物,少食多餐、体位治疗,症状改善后出院。出院后继续肠内营养支持,2个月后体质量增加2 kg,恶心呕吐症状消失。
2 讨 论
2.1 SMAS简介 SMAS属于临床少见病,发病率为0.013%~0.78%[1],好发于青年人[2-3],因SMA位置异常导致其或其分支压迫十二指肠水平段,导致十二指肠部分或完全梗阻而引起一系列症状。此病也被称为Cast综合征、Wilkie综合征、十二指肠血管性压迫综合征等。正常情况下,十二指肠水平部被Treitz韧带固定于SMA与AO的夹角内,夹角角度38°~65°[4],十二指肠到两侧血管的平均距离为10~28 mm[5]。当SMA与AO夹角小于25°时,或二者距离小于8 mm时,易使SMA将十二指肠水平部压迫于主动脉或椎体上,从而造成肠腔狭窄和梗阻[6]。导致SMAS的因素可能是先天的,如肠旋转不良、低肠系膜上动脉起源、十二指肠旁疝等[7];也可能是后天因素:肿瘤、结核、克罗恩病[8]、烧伤、减肥手术等高代谢状态引起体质量减轻、腹腔脂肪组织减少,各种需重建消化道的手术、脊柱手术[9],腹主动脉瘤、妊娠子宫、外伤致SMA假性动脉瘤[10]、多发性硬化症[11]等邻近组织的形态改变导致二者间距变小。
SMAS的症状包括早饱、餐后疼痛、饭后恶心呕吐、腹胀、嗳气、反流等[12]。因此,对于反复发作餐后腹胀、恶心、呕吐,症状与进食、体位相关,且体型瘦长的患者均应考虑此病。对于SMAS的诊断,首选上消化道钡餐造影。造影典型表现:(1)十二指肠水平段与上升段交界处有纵行压迫征象(刀切征或笔杆征)或呈瀑布状下落;(2)钡剂通过受阻,改变体位或加压按摩后可通过或部分通过;(3)受阻近端十二指肠可有不同程度的扩张和逆蠕动波[13]。同时应行CT及胃镜,胃镜可排除其他上消化道疾病;而CT增强后可进行血管三维重建,可明确SMA与AO的夹角情况、间距是否缩短、近端有无梗阻扩张,也可排除肿瘤。SMA与AO的夹角和间距是诊断SMAS的较好指标,夹角<22°诊断的敏感度为42%,特异度为100%,间距<8 mm诊断的敏感度和特异度均接近100%[14]。故有研究[15]推荐将上消化道钡餐造影结合CT检查作为诊断SMAS的首选方法。
2.2 病例1 病例1患者以进食后腹胀症状起病,外院胃镜检查未见梗阻、溃疡,腹部、盆腔增强CT示SMA与AO夹角约20°,偏小;消化道钡餐示十二指肠水平段可见笔杆状压迹,近端十二指肠稍扩张,可见逆蠕动波,据此SMAS诊断明确。但患者伴发肝酶升高、甲状腺功能减退、皮质醇水平升高,可能并发蛋白质-能量营养不良的继发性改变。病例1患者BMI为15.2 kg/m2,为重度营养不良[16]。当发生蛋白质-能量营养不良时,性腺轴、甲状腺轴被抑制,可表现为停经、性欲减退、非甲状腺病态综合征,同时肾上腺轴激活[17]。该患者的甲状腺功能减退,甲状腺轴被抑制;皮质醇水平升高,肾上腺轴激活,同时存在肝损伤。病程中曾服用中药,但患者停用中药且口服保肝药物后,肝功能未见好转,故不排除饥饿诱导肝细胞自噬导致的肝损伤[18]。患者结婚多年,未育,也未测睾酮,不排除其性腺轴被抑制。当甲状腺轴、生长激素轴、骨髓被抑制后可减少机体消耗,肾上腺轴激活被用于支持基本生命活动,将主要的能量储备用于维持最基本的生命活动,保障机体的生存,当患者的营养情况改善后,激素水平的改变能够恢复。该患者经过治疗后症状改善,肝功能逐渐恢复。
2.3 病例2 病例2患者年龄较小,恶心呕吐间断发作,促胃动力治疗后好转,症状无特异性。因此对于高度怀疑的病例早期适当行影像学联合检查是必要的。上消化道造影示瀑布胃,未见典型SMAS改变,但腹部CT示SMA与AO夹角缩小,明确了该病的诊断。但该患者SMA与AO夹角缩小角度较小,发现较早,短期肠外营养后即过渡到肠内营养,通过合理的肠内营养有效地改善了患者营养状况,体质量增加,症状改善。
2.4 SMAS治疗 目前,对于SMAS的治疗,以保守治疗为主,成功率较高,约为83%[19]。患者对营养治疗的耐受程度不一,需制订个体化肠内外营养方案,改善患者营养状况。对于肠内营养患者,建议少量多餐,流质饮食,辅以体位治疗(左侧卧位、俯卧位或者膝胸位),并增强腹壁肌肉锻炼;部分保守治疗无效难以进食者,可行经皮内镜下胃或空肠造口术,通过胃管引流出胃内容物,减轻患者呕吐等症状,并给予肠内营养,改善患者营养状况。对于慢性SMAS,需注意患者是否合并抑郁或焦虑,根据情况加用抗抑郁药物。
外科手术治疗一般不作为首选,仅当保守治疗无缓解、出现严重并发症等情况下考虑。术式包括十二指肠空肠吻合术、十二指肠血管前移位术、Treitz韧带松解术、BillrothⅡ式胃空肠吻合术、胃大部切除、胃空肠吻合术及十二指肠环形引流术、腹腔镜手术。目前以十二指肠空肠吻合术和Treitz韧带松解术为主流的手术方式,成功率较高,可达90%[20-21]。
2.5 小 结 SMAS为临床少见病,症状不典型,易误诊或漏诊,当出现反复发作餐后腹胀、恶心、呕吐症状,影像学检查示SMA与AO夹角缩小及十二指肠水平段受压表现时,需考虑本病可能。SMAS的治疗首选内科保守治疗,需制定个体化肠内外营养支持方案,严格把握手术指征。
