结节性硬化症合并双肾多发错构瘤出血1例报告
2020-11-25李奎庆李卓航许可慰
李奎庆, 刘 成, 李卓航, 黄 立, 许可慰
中山大学孙逸仙纪念医院泌尿外科,广州 510120
1 病例资料
患者,男性,27岁,因突发右侧腰腹部疼痛伴肉眼血尿3 d于2018年3月13日在我院就诊。泌尿系统CT示双肾实质及右肾盂内多发大小不等肿块影,最大者位于右肾,大小约61.2 mm×60.9 mm,其内密度不均匀,可见脂肪密度影,增强扫描见部分组织强化;双肾可见多条动脉供血,较多动脉供血结节(图1)。头颅CT示双侧侧脑室室管膜下多发结节样钙化(图2)。入院后查体:患者贫血貌,体温36.5℃,脉搏75次/min,呼吸21次/min,血压120/70 mmHg (1 mmHg=0.133 kPa)。口鼻三角区、鼻翼两侧可见对称蝶形分布的针尖至蚕豆大小的褐色丘疹样皮脂腺瘤,左腋下、右腰部、背侧肩甲区及右小指甲床下可见散在灰褐色纤维瘤样病变,无压痛及表面破溃。右侧肾区叩痛及腹部压痛明显。动态监测血红蛋白示其进行性下降。诊断为结节性硬化症(tuberous sclerosis,TSC)合并双肾多发错构瘤伴出血。
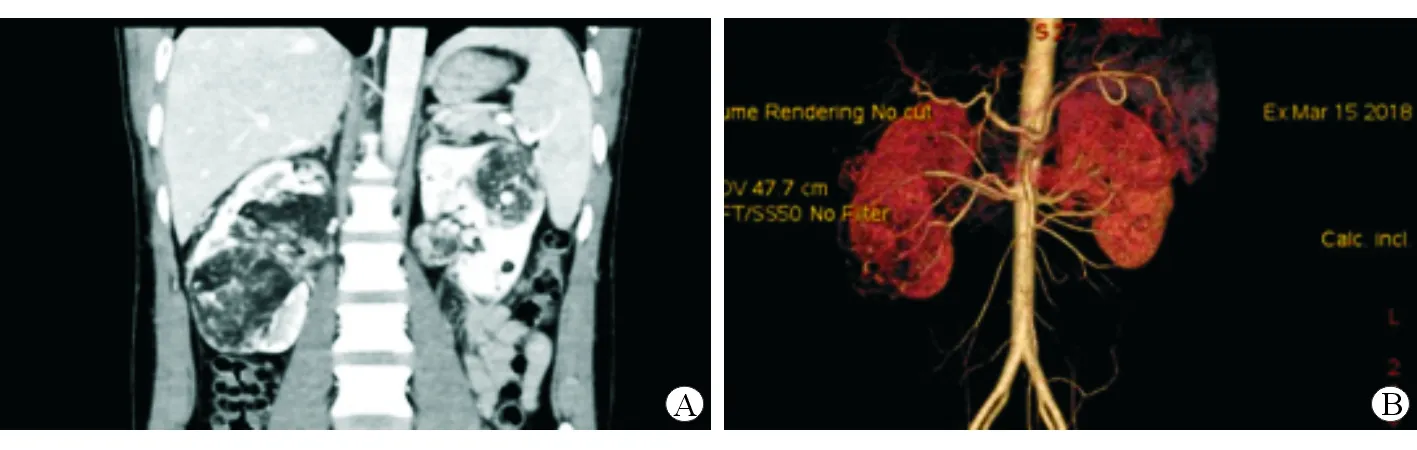
图1 双肾多发错构瘤增强CT(A)及CT血管造影表现(B)
急诊行一期选择性右侧肾动脉栓塞术,术中探查3支左肾动脉,上支增粗,远端细小分支增多并迂曲呈团状,实质期染色明显;右肾动脉分3支入肾,各分支远端均见大小不等迂曲、小团状异常血管分支并于实质期呈大小不等球形染色;肾静脉未见明显异常。采用微导管分别经3支肾动脉超选至异常占位染色区,透视下漂注聚乙烯醇(PVA)颗粒(栓塞剂100~300 μm),直至异常染色消失。术后生命体征平稳。术后6周行二期双侧选择性肾动脉造影和栓塞治疗。术中发现左肾3支动脉供血,中间支增粗,远端小分支增多并迂曲呈团状,实质期染色明显;该支动脉近端近肾门区见一小动脉分支,向一小瘤灶供血并染色明显;右肾原异常染色团大部分缩小,残留右下前段动脉及一小包膜支动脉供血染色;肾静脉未见明显异常。微导管分别超选左肾中部及肾门区、右肾2支异常供血动脉,透视下漂注PVA颗粒栓塞剂(300~500 μm),直至异常染色消失。出院后密切随访,未见破裂出血,二期术后6个月复查CT,提示血肿吸收,错构瘤体积较前缩小(图3)。
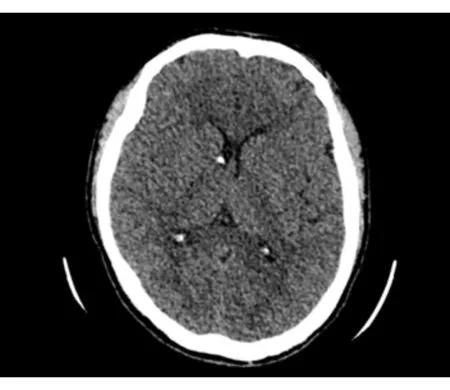
图2 术前头颅CT表现
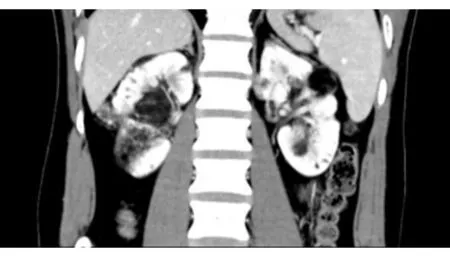
图3 二期术后6个月双肾增强CT表现
2 讨 论
TSC是一种常染色体显性遗传疾病,人群患病率为1/(6 000~10 000)[1]。该疾病可累及多器官系统,包括神经系统、心脏、肾脏、肺、肝脏、脾脏、皮肤等,其病死率差异较大,取决于所涉及的器官类型和数量。TSC可合并多种肾脏病变,其中80%的患者伴发肾血管平滑肌脂肪瘤(AML),该肿瘤多为双侧多发,进展缓慢,大小和数量可随年龄增长而增加,其中直径大于4 cm者发生破裂出血的风险较高[2]。TSC-AML患者易出现肿瘤破裂出血、尿毒症及肾癌等多种并发症,这是成人患者TSC相关死亡的主要原因[3]。
2.1 TSC的发病机制 TSC为常染色体遗传疾病,TSC1或TSC2基因缺失突变是其发病机制的核心。TSC1及TSC2基因产物为mTOR信号通路的重要调控组成部分。mTOR信号通路是调控细胞生长、代谢及细胞自噬的关键信号通路。其中TSC1基因定位于9q34,编码错构瘤蛋白;TSC2基因定位于16p13,编码结节蛋白。TSC1与TSC2通过形成异二聚体(TSC1/TSC2)而发挥调控作用。突变的TSC1和(或)TSC2可抑制活性TSC1/TSC2异质二聚体的形成,导致mTOR信号过度活跃和细胞信号通路失调[4-5]。
2.2 TSC的诊断 TSC诊断包括临床表现、影像学检查和基因检测3个方面。2012年国际结节性硬化症共识会议已制定11个主要和6个次要的疾病特征。主要临床特征:(1)脱色斑(数目>3个,直径至少为5 mm);(2)指甲纤维瘤;(3)血管纤维瘤(>3个)或纤维头静脉斑;(4)多发视网膜AML;(5)鲨鱼斑;(6)室管膜下结节;(7)皮质结节;(8)肺淋巴血管肌瘤病;(9)心脏横纹肌瘤;(10)室管膜巨细胞星形细胞瘤;(11)血管肌瘤(>2个)。次要临床特征:(1)皮肤损害;(2)口内纤维瘤(≥2个);(3)牙齿釉质凹陷(>3个);(4)多发性肾囊肿;(5)视网膜无色性斑块;(6)非肾错构瘤。确诊条件:出现2条及2条以上主要临床特征,或出现1条主要临床特征和2条以上次要临床特征[6]。本病例临床特点为鼻背部周围皮肤可见片状脱色斑,头颅CT发现双侧侧脑室室管膜下多发样结节,双肾多发性错构瘤,符合TSC-AML诊断标准。
2.3 影像学检查 B超检查实时动态观察病灶,其影像学特征为瘤体边界清晰,无包膜,内部强回声或高回声。由于B超具有价格低、无创、易操作等特点,且对TSC-AML的诊断符合率较高,可用于初期筛选及随访检查。CT对脂肪组织辨识力较高,可充分显示病灶的大小及其与周围组织的关系,目前普遍作为TSC-AML最重要的影像学检查手段,可为进一步完善术前评估及术后随访提供客观资料[7]。MRI对于TSC-AML的脂肪成分具有较高敏感性,尤其可对乏脂肪性AML的鉴别诊断提供帮助。本病例行增强CT检查,结果提示双肾实质多发大小不等肿块影,最大者位于右肾,大小约61.2 mm×60.9 mm,其内密度不均匀,可见脂肪密度影,增强扫描部分组织强化,符合多发错构瘤表现。
2.4 基因检测 85%的TSC患者可检测出突变的TSC1和TSC2[8]。致病性TSC1或TSC2突变可以作为TSC诊断的独立标准。但10%~25%的根据临床及影像学特征确诊的TSC患者未检测到TSC1/TSC2基因突变,此类患者被认为存在体细胞嵌合体或者用传统方式无法检测出TSC1或TSC2突变基因。故基因检测结果正常并不能排除TSC诊断[9]。
2.5 破裂风险评估 肾错构瘤的大小、动脉瘤直径是瘤体自发破裂的独立危险因素。体积较大的AML因其血供丰富,破裂出血的风险较高。Jou等[10]认为瘤体直径超过4 cm发生自发性出血的风险为50%~60%。预防性栓塞适用于肿瘤直径超过4 cm患者的观点逐渐得到认可。肾错构瘤中的异常血管通常弯曲成螺旋状的血管网络,此类异常动脉易形成瘤。研究[11]发现,同瘤体直径相比,动脉瘤直径>5 mm对发生瘤体破裂具有更高的预测价值。
2.6 药物治疗 TSC-AML发病率极低,药物治疗的临床研究集中于mTOR抑制剂雷帕霉素及其衍生物依维莫司(everolimus)[12]。此类药物可抑制mTOR的活性,降低苏氨酸/丝氨酸蛋白激酶的活性,抑制成纤维细胞及平滑肌细胞的增殖,从而抑制肾错构瘤的生长。依维莫司作为首个被美国食品药品监督管理局(FDA)正式批准用于临床的mTOR抑制剂,是治疗TSC伴有室管膜星形胶质细胞瘤的一线药物。在TSC-AML方面,研究[13-14]发现,与安慰剂相比,依维莫司治疗后AML进展的反应率和中位时间均显著改善(P<0.001)。长期使用mTOR抑制剂可缩小AML肿瘤体积,并保护肾脏功能。在安全性方面,依维莫司可增加肺炎、口腔炎、肾毒性以及静脉血栓的发生率[15]。
2.7 手术治疗 肾错构瘤破裂出血可形成肾周和腹膜后血肿,严重者可迅速发展为休克。手术方法包括选择性肾动脉栓塞术、肾部分手术及患肾切除术[16]。选择性肾动脉栓塞术具有创伤小、可重复、尽可能多地保留肾单位等优点,是TSC-AML破裂出血的首选术式[17-18]。因TSC-AML常为双侧多发病灶,单次的选择性栓塞,并不能完全使病灶梗塞及萎缩,研究[19]表明,栓塞后瘤体常不能完全吸收消失,体积缩小率仅为20%~50%。因此,TSC合并AML破裂出血者需要二期或更多次的栓塞。患肾切除术仅在并发肾肿瘤或介入失败时才进行。本研究中患者血压、心律紊乱,血红蛋白进行性下降,表现为出血性休克,遂行一期选择性右侧肾动脉栓塞术,术后评估左侧肾错构瘤出血风险,其中多发错构瘤直径>4 cm,符合预防性栓塞指征,于一期栓塞术后6周行二期选择性双侧肾动脉栓塞术。
综上所述,AML是成人患者TSC相关死亡的主要原因。积极监测是无症状性疾病低风险患者的首选方法。对于肿瘤直径<4 cm的无临床症状患者,推荐将mTOR抑制剂作为一线治疗药物。对于TSC-AML破裂出血的患者,首选选择性肾动脉栓塞以尽量保留肾单位。密切随访将有助于及时掌握TSC-AML患者的病情变化,并采取相应措施,从而改善其预后。
