菟丝子多糖的抗氧化活性和抑制肿瘤细胞增殖的研究
2020-11-25叶春林KHUDOYBERDIEVIlkhomjon李瀚鑫
叶春林,KHUDOYBERDIEV Ilkhomjon,陈 颖,李瀚鑫
浙江科技学院 生物与化学工程学院,浙江省农产品化学与生物加工技术重点实验室,浙江 杭州 310023
菟丝子是菟丝子属植物菟丝子(CuscutachinensisLam.)的种子,是一味普遍使用的中药材,具有益精、明目、补肝肾、抗氧化和抗衰老的作用,还可以增强免疫力、调节血脂与血糖[1-2]。菟丝子中含有许多种化学成分,如黄酮类、多糖类、多酚类、甾体类、皂苷类和生物碱类等[3]。多糖是组成生命、生物体和遗传物质的重要成分之一,植物、微生物细胞壁和动物细胞膜中含有大量多糖,多糖还参与分子间的识别、信号传导等生理生化活动[4-5]。菟丝子多糖是中药菟丝子(Semen Cuscutae)的主要药理药效成分之一,目前,对其生物活性的研究主要集中在抗衰老以及增强免疫系统功能等方面[6-7],对其抗氧化研究有零星的报道[8],对其抗肿瘤活性研究鲜见报道。
作者通过菟丝子多糖对DPPH自由基、羟自由基和超氧阴离子自由基的清除效果以及多糖的总还原能力的测定等抗氧化模型,研究其抗氧化活性。在此基础上,考察了菟丝子多糖对人肺腺癌细胞A549、人肝癌细胞HepG2、人胰腺癌细胞PANC-1和人正常肝细胞L-02、人胚肺成纤维细胞HFL-1生长的抑制作用,从而确定菟丝子多糖的抗肿瘤活性,为其开发利用提供依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料
菟丝子:杭州市西湖区药房,粉碎过60目筛;1,1-二苯基-2-三硝基苯肼(DPPH)、2,6-二叔丁基-4-甲基苯酚(BHT)、维生素C(Vc)和MTT:Sigma公司;DMEM培养基和RPMI 1640培养基:美国Life Technologies公司;小牛血清:杭州四季青生物技术有限公司;L-02、HFL-1、A549、HepG2和PANC-1细胞:中国科学院上海细胞库。其他试剂均为国产分析纯。
1.1.2 仪器与设备
BS2202S精密天平:Sartorius公司;SHZ-Ⅲ型循环水式真空泵:河南巩义市英峪予华仪器厂;DKS-24型电热恒温水浴锅:杭州蓝天化验仪器厂;752紫外可见分光光度计:上海菁华科技仪器有限公司;XD202倒置显微镜:南京江南永新光学有限公司;MK3酶联免疫检测仪:美国Thermo公司;BB15 CO2培养箱:德国Heraeus公司。
1.2 方法
1.2.1 菟丝子多糖的提取
菟丝子多糖的提取工艺参考文献[8],采用热水浸提法。修改如下:称取适量的菟丝子粉于三口烧瓶中,在80 ℃和料液比1∶30 (g/mL)条件下,提取100 min,提取液减压抽滤,去除滤渣。将滤液在真空旋转蒸发器中浓缩至适当体积,加入4倍体积的无水乙醇,静置、沉淀1 d,在4 200 r/min下离心,收集沉淀,获得粗多糖。将粗多糖溶解,用半透膜透析1 d,然后在多糖溶液中加入氯仿和正丁醇的混合溶液(V氯仿∶V正丁醇=4∶1),除去蛋白,然后在脱除蛋白的多糖溶液中加入无水乙醇(乙醇的加入体积为母液体积的4倍),得到的沉淀依次用乙醇、丙酮及乙醚反复洗涤,经离心、真空干燥得到菟丝子多糖。
1.2.2 DPPH自由基的清除活性测定
菟丝子多糖DPPH自由基的清除活性测定参考文献[9]。修改如下:取不同浓度的菟丝子多糖溶液4 mL,加入等体积的DPPH乙醇溶液,混匀后,于暗处室温放置0.5 h,然后在517 nm处测定吸光度(As)。同时测定不加样品的DPPH乙醇溶液作为空白对照的吸光度(A0),测定不加DPPH的多糖溶液和乙醇混合后的吸光度(Ac)。以抗坏血酸(Vc)做阳性对照,计算菟丝子多糖及Vc的DPPH自由基清除率。
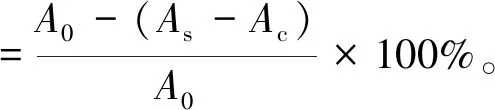
1.2.3 羟自由基的清除活性测定
参考文献[10-11]测定羟自由基的清除能力。修改如下:2 mL不同质量浓度的多糖样品(0.2~1.0 mg/mL)与1 mL邻二氮菲溶液(5 mmol/L)、0.5 mL硫酸亚铁(7.5 mmol/L)、0.5 mL H2O2(3%)和1 mL的0.05 mol/L磷酸钠缓冲液(pH 7.4)混匀后37 ℃水浴1 h,在510 nm处的吸光度记录为A1,用蒸馏水代替样品吸光度记为A2,用蒸馏水代替 H2O2溶液吸光度记为A3。Vc做阳性对照,计算菟丝子多糖及Vc的羟自由基清除率。
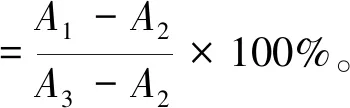
1.2.4 超氧阴离子的清除活性测定
参考文献[12]测定超氧阴离子的清除活性。修改如下:取4 mL不同浓度的多糖溶液,然后分别加入0.1 mol/L的Tris-HCl (pH 8.2)溶液2.5 mL(25 ℃水浴中预热)、6 mmol/L的邻苯三酚溶液2.5 mL,充分混匀,反应5 min后,加入0.5 mL盐酸(8 mol/L)终止反应,299 nm处测吸光度,以Vc做阳性对照。A0为对照品的吸光度,A1为样品的吸光度。
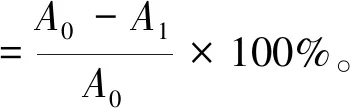
1.2.5 菟丝子多糖的总还原能力测定
菟丝子多糖的总还原能力测定参考文献[13]。修改如下:0.5 mL不同质量浓度的多糖溶液(0.2~1.0 mg/mL)与0.5 mL 1%铁氰化钾溶液、0.5 mL 0.2 mol/L磷酸盐缓冲液(pH 6.6)充分混匀;溶液在50 ℃的水浴中反应0.5 h后,再加入10%的三氯乙酸0.5 mL,混匀。溶液在1 500g条件下,离心10 min。取上清液0.5 mL,与0.1 mL 0.1% FeCl3以及1.5 mL蒸馏水混匀,常温放置5 min,在700 nm处测吸光度。以BHT做阳性对照,吸光度越高,还原力越强。
1.2.6 菟丝子多糖对肿瘤细胞以及正常细胞增殖的影响
在96孔培养板中,分别接种对数生长期的L-02、HFL-1、A549、HepG2和PANC-1细胞,每孔0.2 mL(细胞数约104个),培养24 h后,分别加入一定浓度的药物,每浓度平行3孔,加等量体积的培养液作为对照,置于37 ℃、5% CO2及饱和湿度的培养箱培养2 d,试验终止前4 h每孔加入5 mg/mL MTT 10 μL,培养结束后每孔加入150 μL 0.04 mol/L DMSO (二甲基亚砜),振荡10 min,以492 nm为试验波长,630 nm为参照波长,用MK3型酶标仪测定吸光度,分别计算多糖对各种细胞的毒性。以细胞的存活率和药物的不同浓度作图,确定细胞的半数抑制浓度(IC50)[14-15]。IC50为细胞存活率达到一半时的药物作用浓度。
细胞存活率=测试组OD平均值/对照组OD平均值×100%。
1.3 数据处理
采用Origin 7.5软件,计算3次重复试验数据的平均值和标准偏差并作图。使用SPSS 22.0软件进行统计分析,用t检验分析组间差异的显著性,P<0.05被认为具有统计学意义。
2 结果与分析
2.1 菟丝子多糖对DPPH自由基的清除能力
在测定抗氧化剂清除自由基活性的模型中,DPPH自由基作为一个稳定的自由基,被广泛地应用在抗氧化模型中[16]。由图1可知,菟丝子多糖和Vc对DPPH自由基具有很好的清除作用,且清除率随质量浓度的升高而逐渐增大。菟丝子多糖的IC50为0.25 mg/mL,Vc的IC50为0.26 mg/mL,说明菟丝子多糖具有很强的DPPH自由基清除能力,清除作用与Vc很接近。可能是菟丝子多糖中的羟基容易释放·H,并与DPPH·配对,所以对DPPH自由基有很强的清除效果[17]。
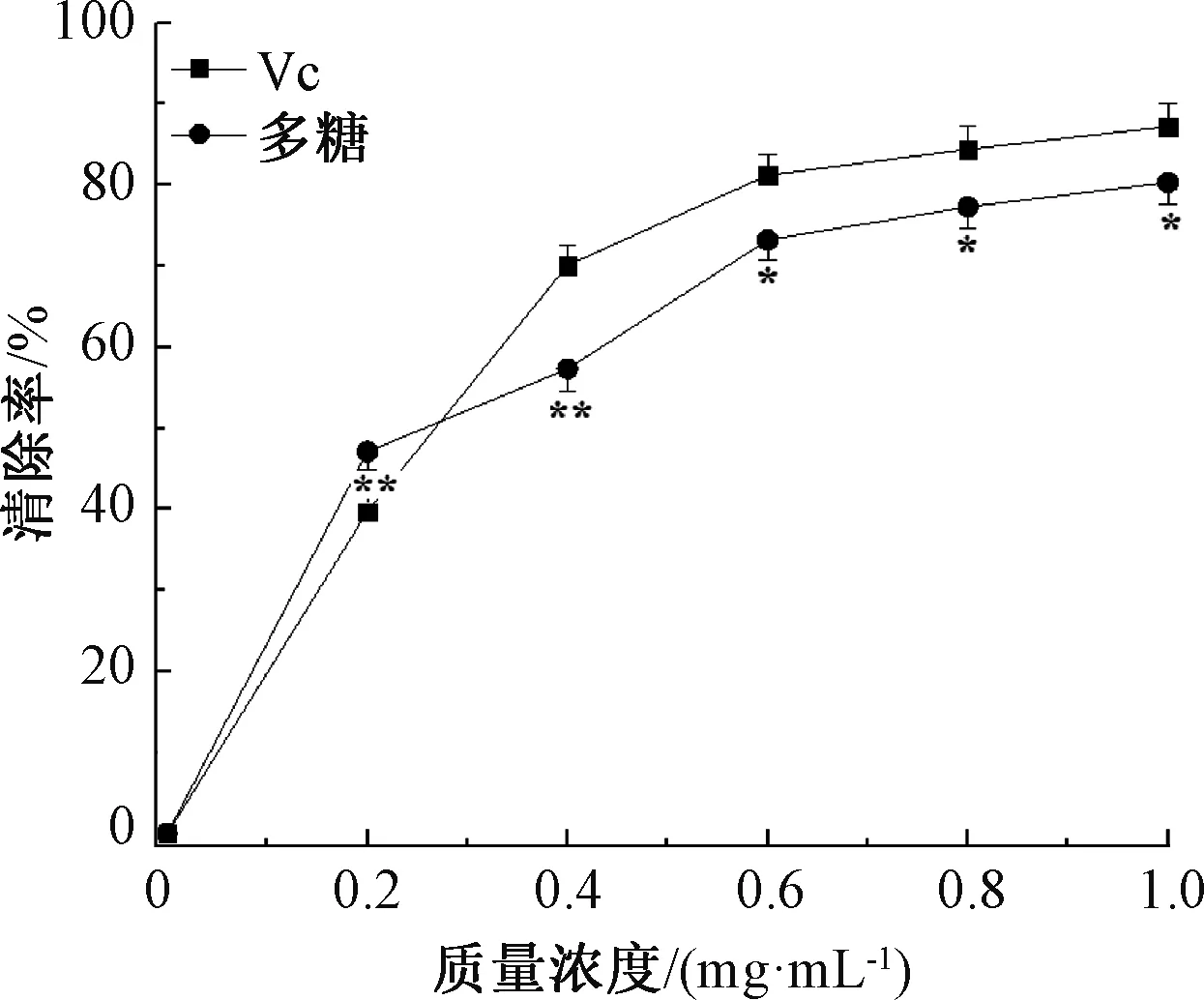
注:与Vc对照组比较,*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。图2—图3同。图1 菟丝子多糖对DPPH自由基的清除作用Fig.1 DPPH scavenging activities of the polysaccharides
2.2 菟丝子多糖对羟自由基的清除作用
羟自由基是最具有活性和生理毒性的自由基,可导致生物体内DNA、蛋白质和脂质氧化等不可逆损伤[18]。由图2可知,菟丝子多糖和Vc对羟自由基的清除率具有浓度依赖性,随着浓度的升高,清除率逐渐增大。菟丝子多糖的IC50为0.36 mg/mL,Vc的IC50为0.29 mg/mL,表明菟丝子多糖具有强的羟自由基清除活性。可能是该多糖是亚铁离子螯合剂,能通过抑制Fenton反应而减少羟自由基的生成,提高羟自由基的清除能力[19]。
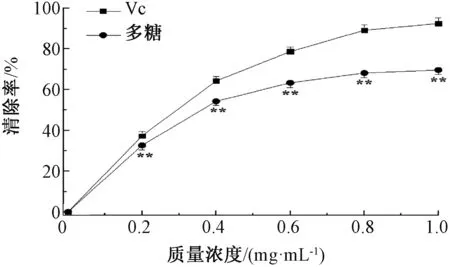
图2 菟丝子多糖对羟自由基的清除作用Fig.2 Hydroxyl scavenging activities of the polysaccharides
2.3 菟丝子多糖对超氧阴离子自由基的清除能力
超氧阴离子自由基被认为是许多活性氧物质的前体,对细胞非常有害[20]。在299 nm下测定菟丝子多糖和Vc对超氧阴离子自由基的清除作用,结果见图3,多糖质量浓度从0.2 mg/mL增加到1.0 mg/mL时,对超氧阴离子的清除率从53.5%增长到75.3%。菟丝子多糖对超氧阴离子自由基有很好的清除作用,多糖的IC50为0.18 mg/mL,Vc的IC50为0.16 mg/mL,IC50越小说明抗氧化活性越好。可能是因为菟丝子多糖的伯、仲羟基的协同作用使邻苯三酚在自氧化初期产生的超氧阴离子自由基形成稳定的分子,从而有效地阻断了自由基的反应链[21]。
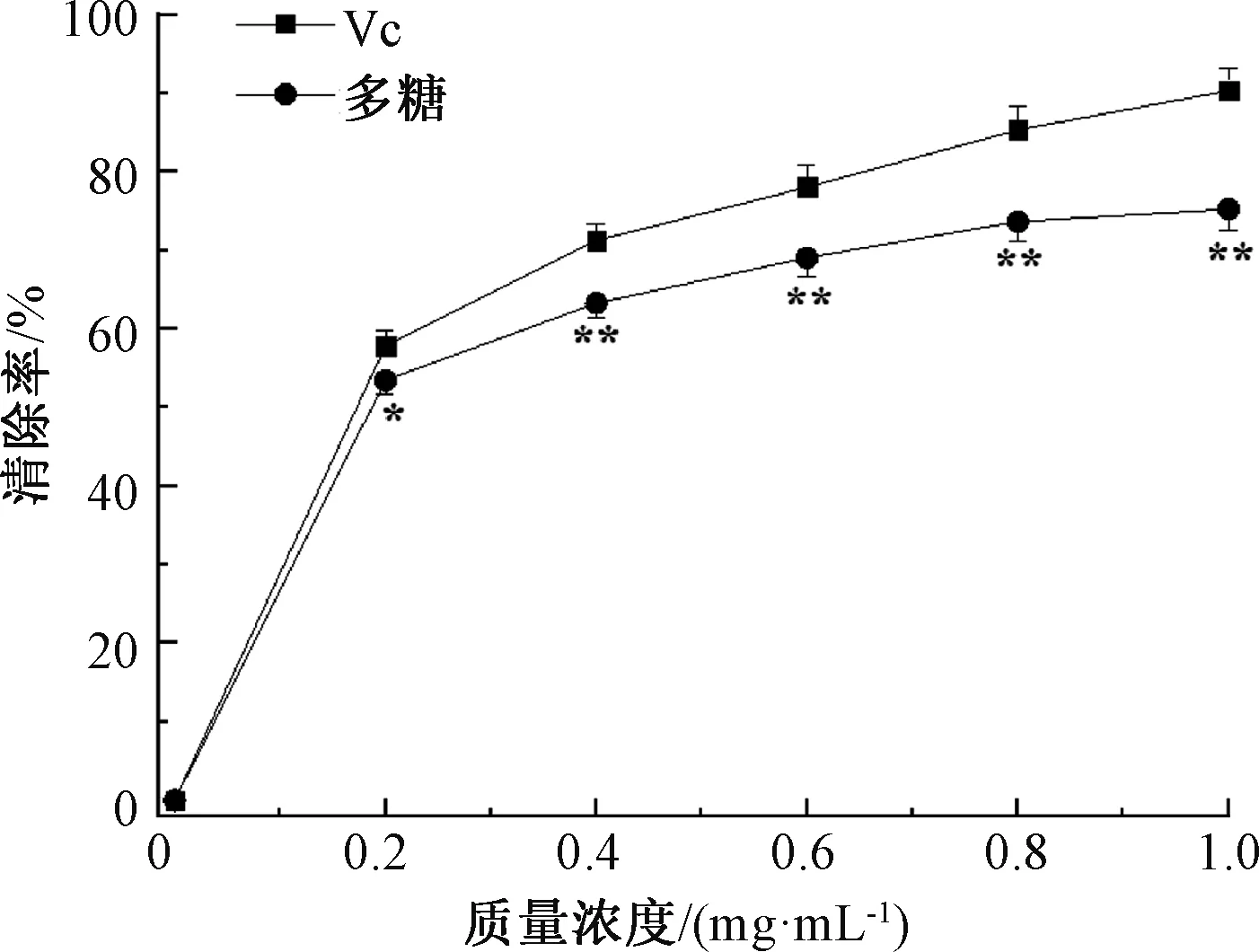
图3 菟丝子多糖对超氧阴离子自由基的清除作用Fig.3 Superoxide scavenging activities of the polysaccharides
2.4 菟丝子多糖总还原能力的测定
由图4可知,菟丝子多糖的还原能力随质量浓度的升高逐渐增大,呈浓度依赖性。当质量浓度为1.0 mg/mL时,多糖和BHT的还原力(以700 nm处的OD值表示)分别为0.55和1.07,尽管多糖的还原能力比具有极强还原能力的BHT要低,但仍表现出较好的还原能力。菟丝子多糖的还原力与其抗氧化活性之间存在关系,菟丝子多糖通过自身的还原作用,给出电子将Fe3+还原成Fe2+,使Fe2+发生Perl’s Prussian蓝反应,普鲁士蓝的生成量越多,则700 nm处的吸光度越高[22]。
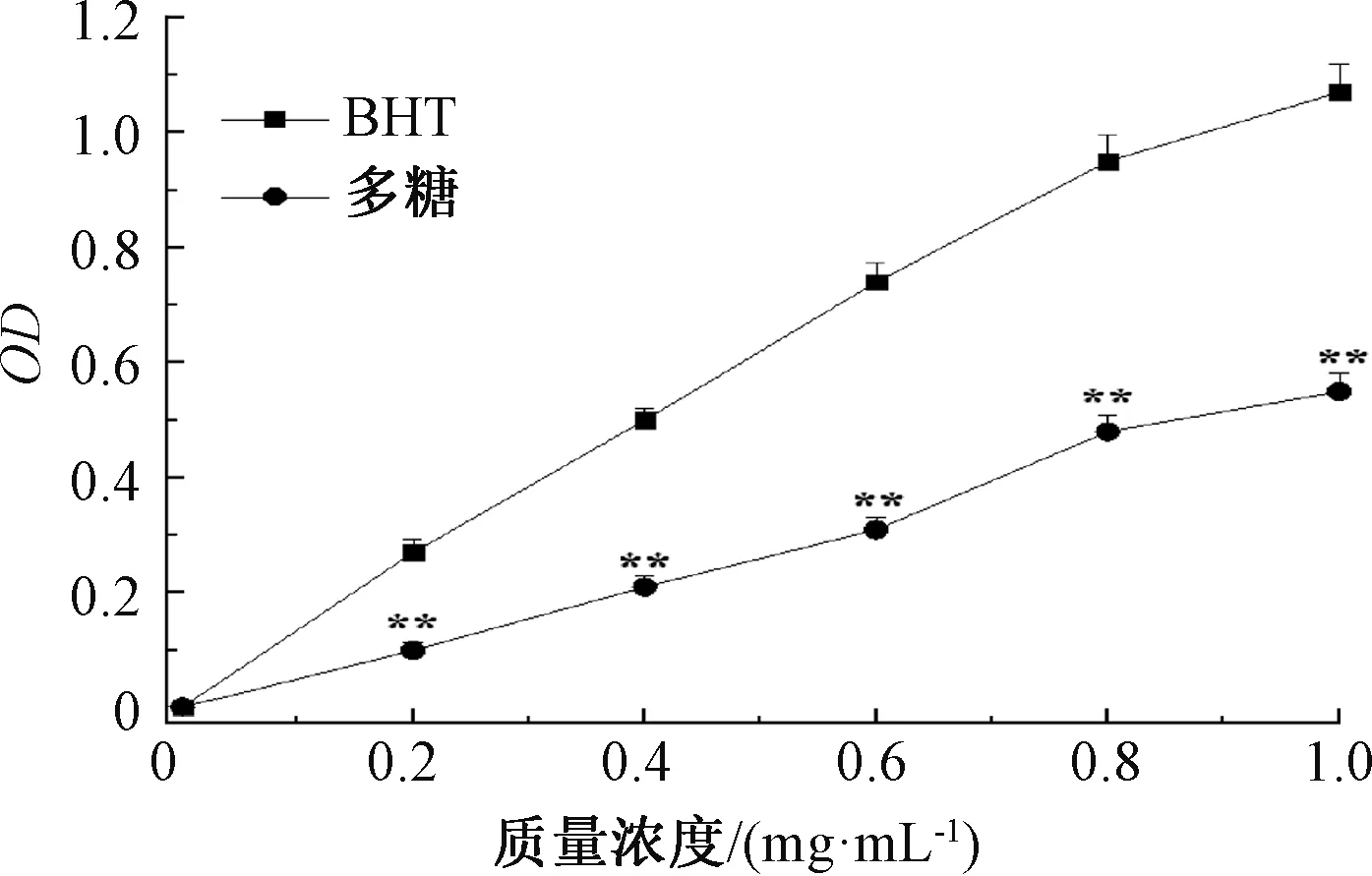
注:与BHT对照组比较,**表示差异极显著(P<0.01)。图4 菟丝子多糖的总还原能力Fig.4 Total reducing power of the polysaccharides
2.5 菟丝子多糖对肿瘤细胞以及正常细胞的毒性研究
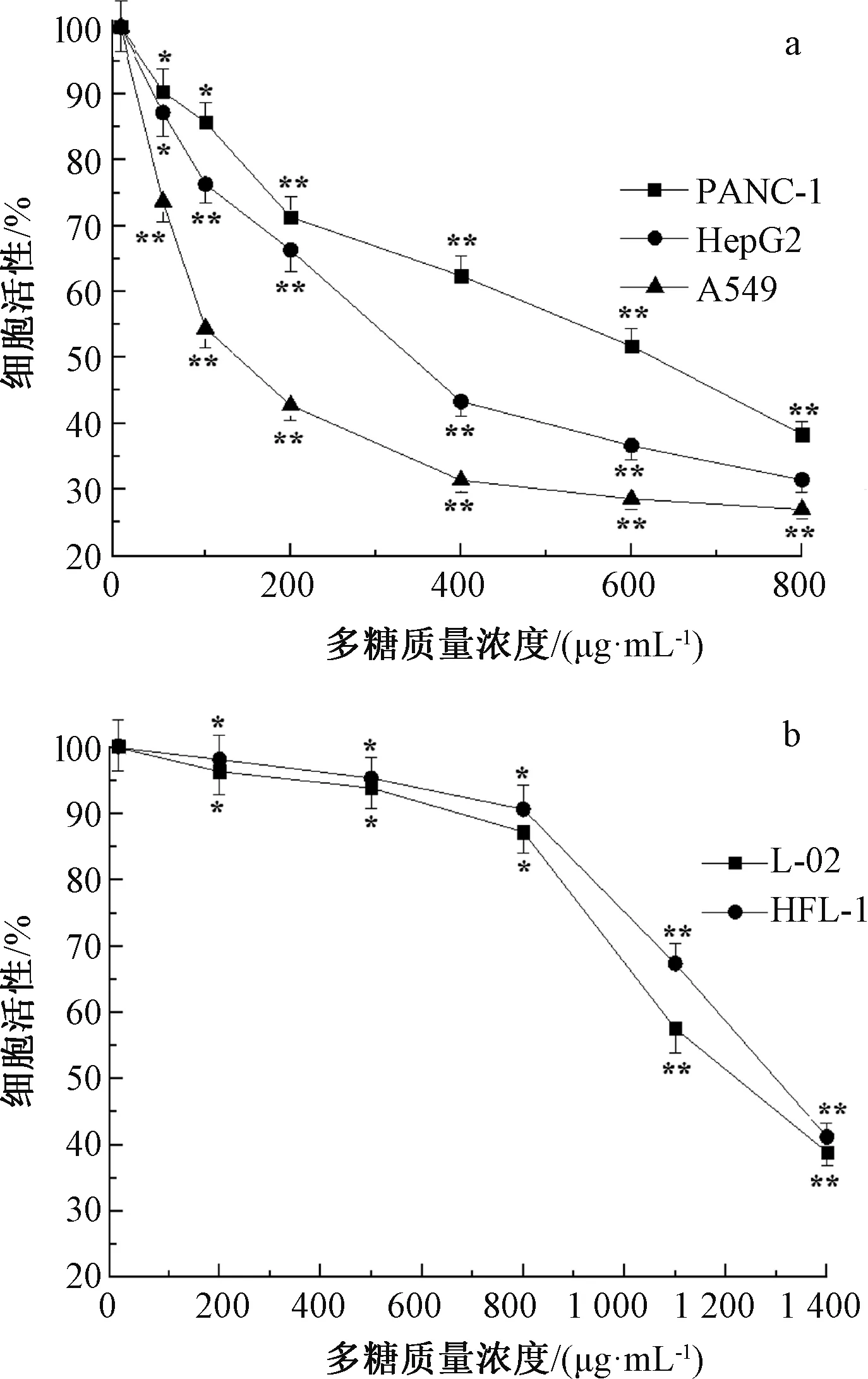
注:a为肿瘤细胞,b为正常细胞。与空白对照组比较,*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。图5 菟丝子多糖对肿瘤细胞及正常细胞的毒性Fig.5 Cytotoxic effects of the polysaccharides on A549, HepG2, PANC-1, L-02, and HFL-1 cells
采用MTT的方法,考察菟丝子多糖对细胞的毒性。如图5a所示,菟丝子多糖对人肺腺癌细胞A549、人肝癌细胞HepG2和人胰腺癌细胞PANC-1的生长均有抑制作用,且随着多糖质量浓度的增加,抑制率也增加。当菟丝子多糖质量浓度分别为137.6、341.7、625.4 μg/mL时,对A549、HepG2和PANC-1生长抑制率可达50%。表明菟丝子多糖能有效地抑制肿瘤细胞增殖,且对不同肿瘤细胞表现的抑制效果存在一定的差异。菟丝子多糖对A549细胞的抑制作用比苦荞茶多糖强[23],对HepG2细胞的IC50与五叶地锦果实多糖接近[24],而有关其对PANC-1细胞的增殖抑制作用还未见报道。
从图5b可知,菟丝子多糖对人正常肝细胞L-02和人胚肺成纤维细胞HFL-1的毒性极小,IC50分别为1.223、1.299 mg/mL。在A549、HepG2和PANC-1肿瘤细胞的半数抑制浓度时,正常细胞L-02和HFL-1的成活率在90%以上,表明菟丝子多糖可以选择性抑制肿瘤细胞的生长,而对正常细胞增殖抑制作用很小。
3 结论
本试验探究了菟丝子多糖的抗氧化和抗肿瘤活性。结果表明:随着菟丝子多糖质量浓度的增加,抗氧化和抗肿瘤活性增强。菟丝子多糖对DPPH自由基、羟自由基和超氧阴离子自由基有很强的清除作用,清除能力与Vc接近。菟丝子多糖的还原力虽比极强还原性的BHT弱,但仍表现出较强的还原能力。菟丝子多糖对人肺腺癌细胞A549、人肝癌细胞HepG2和人胰腺癌细胞PANC-1细胞都有较好的抑制作用,IC50分别为137.6、341.7、625.4 μg/mL,而对正常细胞的增值抑制作用很小,对人正常肝细胞L-02和人胚肺成纤维细胞HFL-1的IC50分别为1.223、1.299 mg/mL,说明菟丝子多糖能够选择性抑制肿瘤细胞的生长。
