金纳米粒子修饰酶脂质体生物传感器检测Hg2+和Cu2+浓度的研究
2020-11-25关桦楠吴巧艳迟德富
关桦楠,吴巧艳,彭 勃,薛 悦,孙 璐,迟德富,张 娜
1.哈尔滨商业大学 食品工程学院,黑龙江 哈尔滨 150076 2.东北林业大学 林学院,黑龙江 哈尔滨 150040
近年来,重金属污染已成为影响环境、经济和社会可持续发展的重大战略问题之一,引起了学者的广泛关注[1-4]。虽然自然环境中的重金属离子浓度处于微量水平,但它们可以通过食物链在人体内积累到高浓度,当摄入超过阈值时,会导致人类出现严重的健康紊乱状况[5]。目前,重金属残留常规的检测方法主要有高效液相色谱法、光谱法、酶分析法、免疫分析法[6-10]等,然而,这些方法都有价格昂贵、仪器沉重和不易携带等诸多缺点。电化学检测方法具有成本低、响应快、简单、灵敏度高、小型化等优点,逐渐成为许多领域的研究热点。
电化学酶生物传感器因其简单性、灵敏性、选择性和低成本而备受关注[11]。但由于受到酶活性及稳定性的影响,导致酶生物传感器的应用受到限制,因此,将脂质体作为酶的载体引入其中,能有效保持酶的活性和提高酶抑制反应的稳定性,可解决此类问题。此外,金纳米粒子(AuNPs)因具有特殊的性质[12],如离子共振特性[13]、金纳米荧光特性[14]、电化学特性[15]、吸附特性[16]和分子识别特性[17]等,可通过其修饰工作电极以增强电极的灵敏度,提高响应信号和空白的比值[18-20]。
作者采用薄膜蒸发-冻融联用法构建具有“细胞”通透结构的半封闭的葡萄糖氧化酶脂质体反应器,用以提升葡萄糖氧化酶(GOD)的稳定性;利用自组装技术将金纳米粒子与葡萄糖氧化酶脂质体(GLM)反应器共修饰于玻碳电极表面,以期构建新型的用于检测重金属残留(Hg2+和Cu2+)的葡萄糖氧化酶电化学生物传感器。
1 材料与方法
1.1 材料与仪器
葡萄糖氧化酶(100 U/mg)、鱼精蛋白、大豆卵磷脂和胆固醇:Sigma-Ameresco公司;石墨粉:哈尔滨赛拓生物公司;高锰酸钾:天津市致远化学试剂有限公司;浓硫酸、浓磷酸、水合肼、氯化汞、硫酸铜、丙酮:天津市永大化学试剂有限公司;铁氰化钾:天津市北辰方正试剂厂。
CJJ79-1型磁力加热搅拌器:常州越新仪器制造有限公司;LK98电化学工作站:天津兰力科化学电子有限公司;JK-100型超声波清洗器:西安常仪仪器设备有限公司;JSM-6460LV SEM扫描电子显微镜:日本JEOL公司。
1.2 方法
1.2.1 金纳米粒子的制备及表征
采用硼氢化钠法制备金纳米粒子。取20 mL去离子水于冰箱中预冷,之后加入0.5 mL 的1%的氯金酸溶液,再加入0.1 mL的Na2CO3溶液(0.2 mol/L)。将磁力搅拌器搅拌速度调至快速,分3次加入新配置的0.5 mL的0.5 mg/mL硼氢化钠溶液中,直至溶液颜色变为酒红色,继续搅拌10 min后,结束反应。获得的金纳米粒子溶液4 ℃保存于棕色瓶中备用。
1.2.2 葡萄糖氧化酶脂质体(GLM)的制备与表征
称取带负电的大豆卵磷脂0.5 g、胆固醇0.1 g和GOD粉末15 g,将3种物质共溶于10 mL的二氯甲烷中,再准确加入0.1 mL吐温20。将上述体系移至茄形烧瓶中,置于37 ℃水浴锅内,调节蒸发仪的旋转速度,利用减压蒸馏法完全蒸出二氯甲烷,在茄形烧瓶的内壁出现一层均匀的薄膜时,加入配置好的葡萄糖溶液5 mL,持续旋转30 min,得到悬浮液。采用微孔滤膜器除去杂质,将获得的滤液放入液氮中停留1 min,随后立即放入37 ℃水浴锅内,待融化后放入液氮中再次冷冻,重复冷冻融化多次后,将溶液在室温下放置10 min。然后离心5 min (10 000 r/min),舍弃上清液。反复操作5次,过滤后经过冷冻干燥,最终得到粉末状脂质体(GLM),4 ℃下封闭保存备用。
1.2.3 电化学响应性能研究
利用电化学工作站中的3种不同的电极,将玻碳电极作为工作电极,铂电极为对电极,Ag/AgCl电极为参比电极,将与玻碳电极同等直径大小的乙酸纤维素膜圆片固定在电极表面,利用乙酸配制0.5 mg/mL的壳聚糖溶液,调节 pH值为5.0,将电极浸泡其中,于-0.3 V恒定电位条件下,电沉积3 min。取下酸纤维素膜置于红外灯下烘干,再用去离子水反复清洗电极及环形塑料盖,干燥后重新将膜(带正电荷)固定在电极表面。利用磷酸盐缓冲溶液(pH 7.4)配制1 mg/L的GLM悬浮液,取1 mL与8 mL金纳米溶液均匀混合,缓慢滴涂于乙酸纤维素膜上,氮气吹干,4 ℃干燥保存(不超过1 d),即得由金纳米粒子修饰的酶脂质体电极。将连接好的电极置于盛有10 mL磷酸盐缓冲溶液的烧杯中,放在恒温磁力搅拌器台面上,调节温度为37 ℃,加入2 mL的葡萄糖溶液(1 mol/L),反应时间为10 min。采用循环伏安(CV)法,考察电极修饰前后电流响应性能的变化,以未经过修饰的酶脂质体电极作为对照,重复试验3次。
1.2.4 金纳米修饰酶脂质体生物传感器对重金属离子Hg2+和Cu2+的检测
将连接好的电极置于盛有10 mL磷酸盐缓冲溶液(pH 7.6)的烧杯中,调节磁力搅拌器速度,当CV曲线稳定后,分别加入0.1 mL不同浓度(10-2、10-3、10-4、10-5、10-6、10-7、10-8、10-10mol/L)的重金属离子(Hg2+和Cu2+)溶液,搅拌均匀,加入2 mL葡萄糖溶液(0.1 mol/L),继续搅拌30 min后,进行曲线扫描检测电流响应情况。根据重金属离子浓度的不同,观察不同的电流变化,绘制抑制率-浓度对数拟合曲线,并计算最低检出限。每组试验重复3次,抑制率计算公式如下[21-22]:
式中:I为抑制率(%);I0为氧化峰电流(体系无添加重金属离子);I1为氧化峰电流(添加重金属离子)。
2 结果与分析
2.1 金纳米粒子的表征
选择硼氢化钠还原法制备金纳米粒子,对其进行紫外-可见吸收光谱法分析,结果如图1所示。从图1可以看出,在波长527 nm处具有明显的吸收峰,这是由于紫外-可见光谱对高度分散状态和以缔合状态存在的金属颗粒有着显著差异的响应信号。根据Mie理论可知,金纳米粒子在波长520 nm左右出现吸收峰时粒径为3~20 nm。因此,可初步认为所制备的金纳米粒子的粒径约为25 nm。
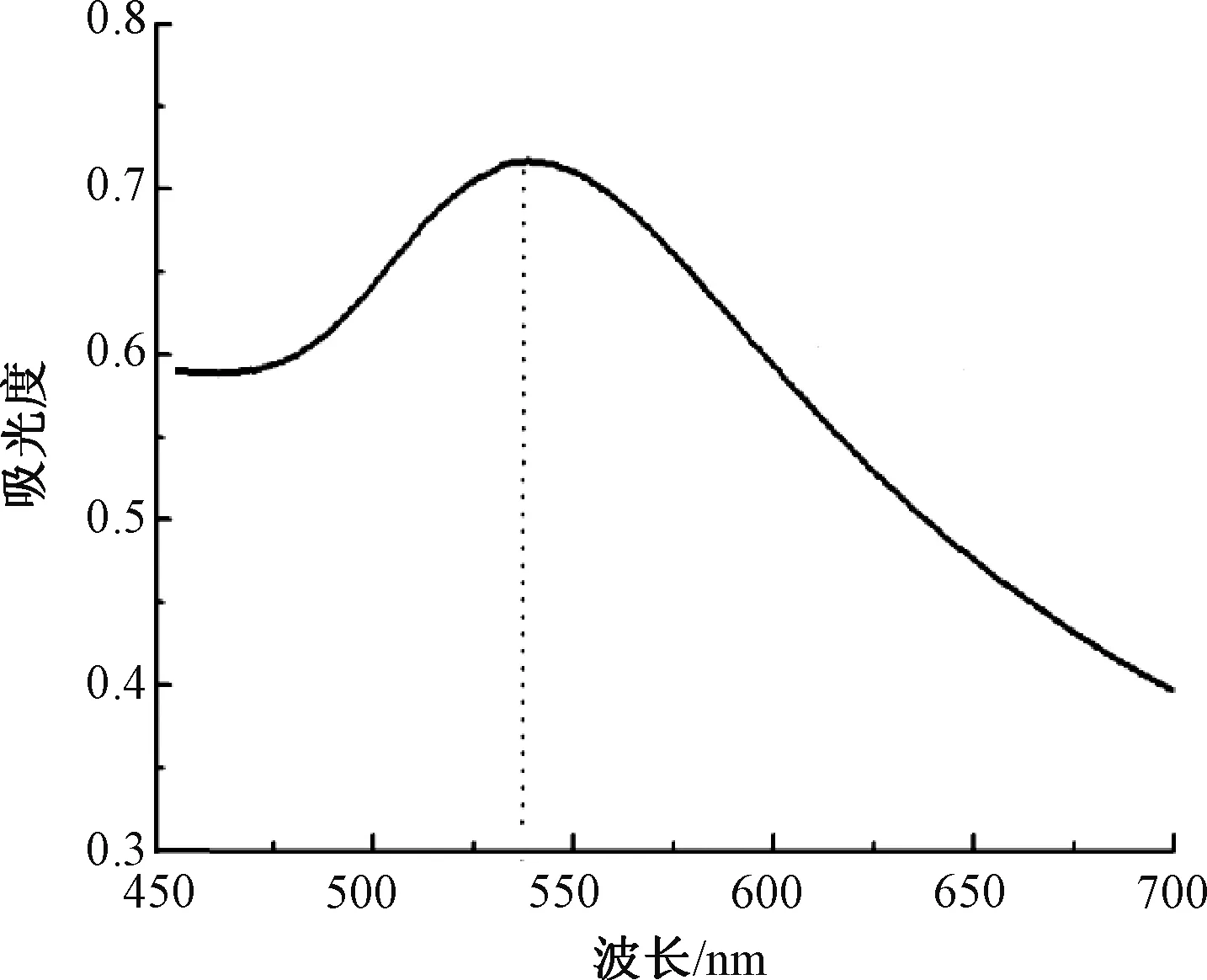
图1 金纳米粒子的紫外-可见光吸收光谱Fig.1 UV-Vis spectrum of gold nanoparticles
利用透射电子扫描电镜(TEM)观察所制备的金纳米粒子的表观形态,结果如图2所示。由图2可以看出,金纳米粒子整体呈规则的圆球型,均匀分布其中,平均粒径大小约为27 nm,且没有成团出现,说明具有良好的单分散性能。综上所述,基于硼氢化钠还原法成功制备出金纳米粒子,它是一种良好的修饰材料。

图2 金纳米粒子的透射电镜图Fig.2 Transmission electron micrograph of gold nanoparticles
2.2 GOD脂质体的表征

图3 脂质体扫描电子显微镜图Fig.3 Scanning electron micrograph of liposomes
利用扫描电子显微镜(SEM)观察所制备的GLM的表观形态,结果如图3所示。由图3可知,GLM整体呈规则的球型,表面完整,且无明显的聚集现象,平均直径为4~8 μm。由于胶囊壁的弹性作用,脂质体之间表现出相互挤压的状态。动态光散射粒度仪(DLS)分析证实,该脂质体的平均直径为(5.83±0.75) μm。若按体积计算,78%的脂质体的直径均低于8 μm,且大部分的悬浮液主要集中在3~12 μm。
2.3 金纳米粒子修饰酶脂质体生物传感器的电化学响应
考察金纳米粒子修饰电极前后,在相同的条件下(详见1.2.3)电极电流响应性能的变化。由图4可以看出,采用用金纳米粒子修饰过的酶脂质体电极所构建的葡萄糖氧化酶传感器的氧化还原电流相对较大,这是由于金纳米粒子修饰过酶脂质体电极后,使得电极表面有效面积显著增加,且金纳米粒子具有良好的电信号传导性能,增加了电极表面电子的传递速度,有效地提高了整个体系中的反应活跃程度[20]。虽然氧化峰的电位在0.57 V时出现微小波动,但未对整体造成较大影响。综上所述,经金纳米粒子修饰的酶脂质体电极灵敏度更高。
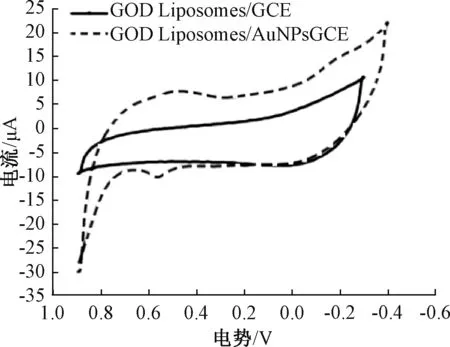
图4 电极修饰前后的电流响应性能对比Fig.4 Comparison of current response performance before and after electrode modification
2.4 金纳米粒子修饰酶脂质体生物传感器检测重金属离子研究
2.4.1 金纳米粒子修饰酶脂质体生物传感器检测Hg2+和Cu2+
金纳米粒子修饰酶脂质体生物传感器检测Hg2+和Cu2+的浓度的原理为重金属离子对葡萄糖氧化酶的酶促反应有特异性抑制作用,从而使得酶促反应的电流响应信号变弱,进而推算出体系中重金属残留的浓度[22]。将葡萄糖氧化酶进行脂质体包埋,隔绝外界环境对酶抑制反应的干扰,可以提高反应的稳定性,增强电流变化的响应性能。由图5可知,两种重金属离子均出现较明显的氧化峰峰型,且随着体系中Hg2+和Cu2+浓度的不断减小,氧化峰电流绝对值却不断增大,说明随着溶液中重金属离子浓度的增大,酶脂质体电极对Hg2+和Cu2+的富集作用越来越接近饱和状态,葡萄糖氧化酶的活性不断降低,体系中的氧化还原反应受到抑制,产生的过氧化氢不断减少,造成整个体系中的电子转移量减少,氧化峰电流绝对值的降低,证明此方法具有较高的检测灵敏度,更适合微量检测。但在检测过程中,两种重金属离子的氧化峰峰谷出现在不同的电位下,即Hg2+在氧化峰电位为0.15 V处,Cu2+在氧化峰电位为0.20 V处。因此,根据氧化峰出峰位置的不同,可直接用以区分Hg2+和Cu2+。
2.4.2 最低检出限、抑制率及拟合曲线的绘制
通过计算抑制率,以重金属离子浓度的对数作为变量,绘制拟合曲线,结果如图6所示。
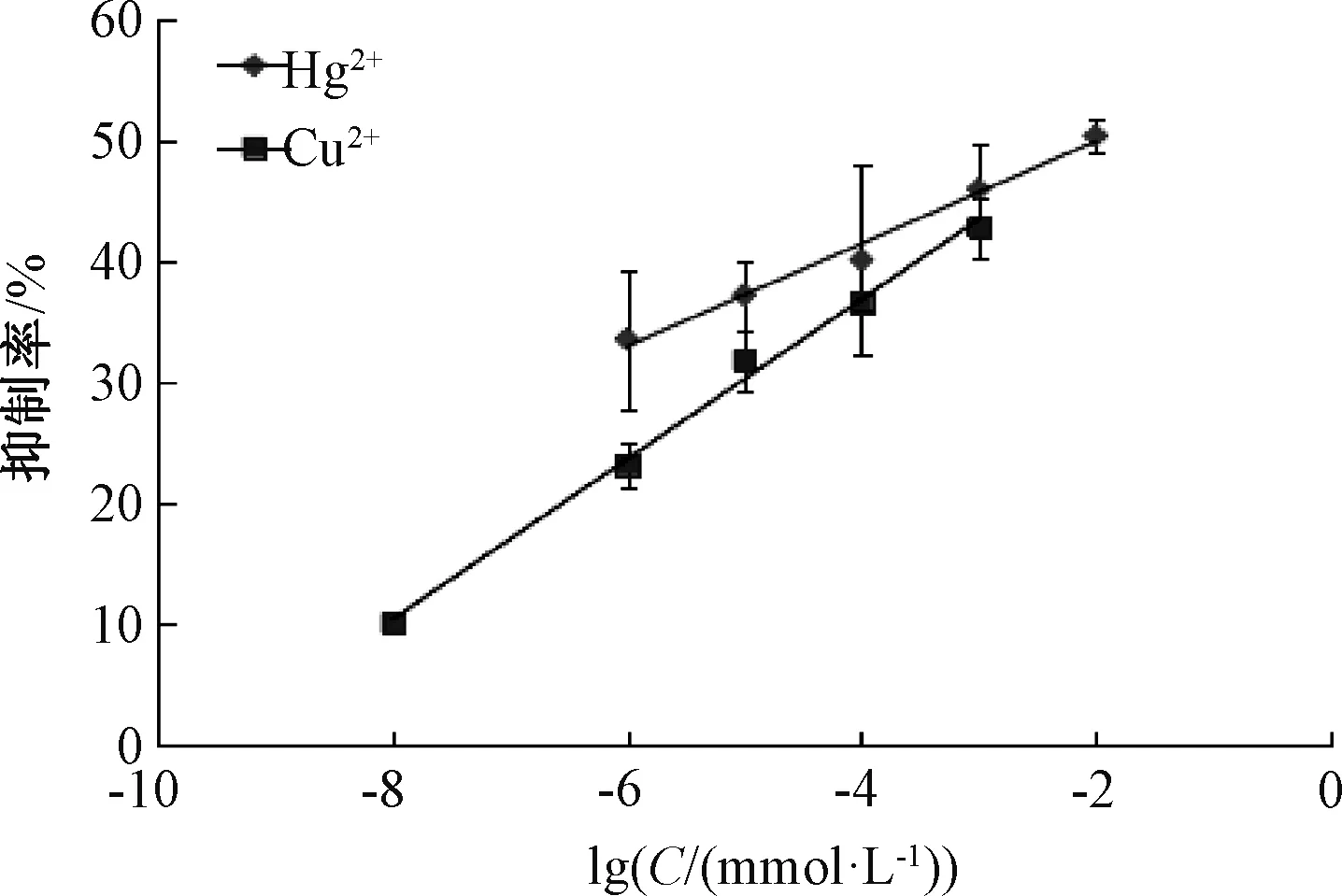
图6 Hg2+和Cu2+不同浓度对数校正拟合曲线Fig.6 Calibrated fitting curves for Hg2+ and Cu2+with different concentrations
由图6可以看出,在10-6~10-2mmol/L浓度之间,Hg2+的拟合线性方程为I=0.042 3lgC+ 0.583 6,R2=0.986 3,最低检出限为4.38 ng/mL,方程具有良好的线性关系;在10-8~10-4mmol/L浓度之间,Cu2+的拟合方程为I=0.066lgC+0.632 3,R2=0.994 9,最低检出限为6.52 ng/mL,同样具有良好的线性关系。利用该方法所获得的最低检出限,均显著低于国家标准(汞残留10 μg/mL,铜残留2 mg/mL),综上所述,基于金纳米粒子修饰酶脂质体构建生物传感器检测Hg2+和Cu2+浓度的方法具有良好的灵敏度。
3 结论
基于葡萄糖氧化酶脂质体反应器,并利用金纳米粒子自组装技术修饰工作电极,构建用于快速检测Hg2+和Cu2+的浓度葡萄糖氧化酶电化学生物传感器。该类型生物传感器在引入脂质体确保酶抑制反应不受外界环境干扰的前提下,通过金纳米粒子修饰酶脂质体电极有效地增强了电极的灵敏度。研究结果表明,在实际检测Hg2+和Cu2+的浓度时,该传感器表现出了良好的灵敏度。本研究将为重金属残留快速检测方法的改良提供新的方向。
