温阳消癥方对单侧输尿管梗阻小鼠肾组织Ⅰ型与Ⅲ型胶原表达的影响
2020-11-24林晓蒙余柯娜蔡旭东
林晓蒙 余柯娜 蔡旭东
慢性肾脏病(chronic kidney disease,CKD)是威胁全人类健康的慢性疾病之一,最新调查显示:2017年全球CKD 患病率估计为9.1%,近五分之一的患者生活在中国(约1.32 亿例)[1]。肾间质纤维化是CKD进展的病理基础及最终结局,早期预防,即在肾脏纤维化开始形成的初期加以干预,可延缓CKD 进程,甚至避免患者进入终末期肾脏病。肾间质纤维化是多因素参与的复杂过程,其直接原因即是细胞外基质(extracellular matrix,ECM)合成与降解失衡,过度堆积的ECM 破坏了肾脏正常的功能结构,最终导致肾功能失代偿[2]。Ⅰ型及Ⅲ型胶原(Col-Ⅰ、Col-Ⅲ)是ECM 的主要成分,可作为观察RIF 程度和治疗情况的指标[3]。肾间质纤维化目前治疗手段有限,应用于临床的主要是血管紧张素转换酶抑制剂(ACEI)/血管紧张素Ⅱ受体拮抗剂(ARB),作用有限,且存在一定的副作用,如高血钾、影响肾小球滤过率等,中医药在肾纤维化治疗方面有良好疗效。温阳消癥方是国家级名老中医张沛虬老先生治疗CKD 的经验方,前期已证明在CKD 患者中辨证使用温阳消癥方(文献中温阳化瘀方即温阳消癥方),可改善血肌酐、肾小球滤过率、尿蛋白等指标及患者临床症状[4],同时我们发现该方可改善肾纤维化模型小鼠的肾功能及肾脏病理[5-6],本研究拟通过观察温阳消癥方对单侧输尿管梗阻(UUO)模型小鼠Col-Ⅰ、Col-Ⅲ蛋白和mRNA 表达的影响,来探讨该方能否减轻肾间质ECM 堆积,减轻肾间质纤维化。
1 实验材料
1.1 动 物 SPF 级C57 小鼠32 只,6~8 周龄,雄性,体质量(18±2)g,由上海中医药大学动物实验中心提供,实验动物质量合格证号2008001658582,许可证号SCXK(沪)2013-0016。实验期间分笼饲养,自由饮水,进食标准普通饲料,恒温25℃,12h 照明,适应性饲养1 周后造模。动物相关处置均符合《中华人民共和国实验动物管理条例》要求。本研究经所属单位伦理委员会审核通过,审批号:SZY2017020041。
1.2 药 物 温阳消癥组(温阳消癥方):黄芪、党参各30g,仙灵脾、肉苁蓉各15g,桃仁12g,川芎15g,莪术30g,由上海曙光医院中药房提供。药材加10 倍量水,浸泡2h,煎煮3 次,每次1h,合并水煎液,浓缩成含生药4.9g/mL 水煎液备用。缬沙坦组(缬沙坦胶囊,商品名:代文),由北京诺华制药有限公司提供,批号X2743,规格:80mg。
1.3 主要试剂及仪器 实时荧光定量多聚核苷酸链式反应(Rt-qPCR):Universal Reverse Transcription Kit 逆转录试剂盒(LR-0103B,上海诺伦生物医药技术有限公司),ComSYBR qPCR Mix(with ROX)荧光定量试剂盒(LK-0107BB,上海诺伦生物医药技术有限公司),新鲜动物组织和细胞总RNA 抽提试剂盒(LN-0108B,上海诺伦生物医药技术有限公司),MX3000P 实时荧光定量PCR 仪(德国Agilent 公司)。蛋白免疫印迹法(Western blot):SuPer-GL ECL超敏发光液、裂解液(上海诺伦生物医药技术有限公司),PVDF 转移膜(美国MilliPore 公司),HRP-conjugated goat anti-rabbit IgG 及HRP-conjugated goat anti-mouse IgG(美国Jakeson 公司),PowerPacTMHC电泳仪、Semi-Dry Transfer Cell、转膜滤纸(美国biorad 公司),VE-180 垂直电泳槽(浙江天能公司),DY-B1 脱色摇床(上海青浦沪西仪器),KODAK XOmat BT Film 及X 光片显影液、X 光片定影液(美国Kodak 公司)。
2 实验方法
2.1 动物造模及分组 32 只小鼠按随机数字表法分为假手术组、模型组、温阳消癥组、缬沙坦组,每组8 只,建立UUO 模型[7],方法如下:小鼠腹腔注射2%戊巴比妥钠,在左侧肋骨下方约1cm 处行纵向切口,长约0.8~1.0cm,逐层分离皮肤、皮下组织及肌层,暴露左肾及左侧输尿管,将左侧输尿管分离,予手术线进行双重结扎,不剪断,最后逐层缝合。假手术组开腹后不予结扎输尿管,单纯分离左侧输尿管后直接缝合。
2.2 给药方法及取材 造模后温阳消癥组以人鼠药物剂量20 倍[8]换算后制成4.9g/mL 温阳消癥方水煎剂,小鼠给药剂量49g/kg;缬沙坦组以人鼠药物剂量12.33 倍[9]换算后制成1.65mg/mL 水悬液,小鼠给药剂量16.5mg/kg;假手术组及模型组予等容量生理盐水每天0.2mL 灌胃,疗程共2 周。治疗2 周后处死各组小鼠,留取各组小鼠左侧肾组织标本于液氮中速冻,后保存于-80℃冰箱,以待检测。
2.3 指标检测方法
2.3.1 Rt-qPCR 检测小鼠肾组织Col-Ⅰ、Col-ⅢmRNA 表达 取出肾组织标本,用Trizol 法提取总RNA,后进行逆转录反应:PCR 试管加入总RNA 5μL、2×逆转录缓冲液10μL、逆转录引物(1μM)1.2μL、MMLV 逆转录酶(200U/μL)0.2μL,用DEPC水加至20μL,30℃30min;42℃30min;85℃10min。实时荧光定量PCR 反应:试管中加入2×定量PCR Master Mix 10μL、上游引物(20μM)0.08μL、下游引物(20μM)0.08μL、cDNA 模板2μL、Taq DNA 聚合酶(5U/μL)0.2μL,用dd H2O 加至20μL,95℃,3min 变性;95℃,12s;62℃,40s,40 个循环。读取CT(cycle threshold)值,计算2-△△CT值对目的mRNA 相对定量分析。查询Genbank 数据库中公开发表的基因序列,并采用primer express 进行引物设计,由上海诺伦生物医药技术有限公司合成引物。Col-Ⅰ上游引物序列:5'-GCTCCTCTTAGGGGCCACT-3',下 游:5'-CCACGTCTCACCATTGGGG-3';Col-Ⅲ上游引物序列:5'-CCTGGCTCAAATGGCTCAC-3',下 游:5'-CAGGACTGCCGTTATTCCCG-3';Mus Actb 为内参,上游引物序列:5'-AAGATCAAGATCATTGCTCCTCC-3',下游:5'-GACTCATCGTACTCCTGCTTGC-3'。
2.3.2 Western blot 检测小鼠肾组织Col-Ⅰ、Col-Ⅲ蛋白表达 每个肾组织样本加入300μL 组织细胞裂解液,用枪混匀使其完全裂解,将裂解物移至新的离心管中。直接取10μL 样本加入10μL 2×SDS-PAGE loading buffer,混匀,100℃加热处理5min,冰上冷却,12000g,14000r/min,离心15min 去除不溶性沉淀。样品使用10% SDS-PAGE 分离,每孔上样量为20μL。电泳结束后,将PVDF 膜在甲醇中浸泡1min,再使用Transfer Buffer 浸泡凝胶、滤纸和在甲醇中浸泡过的PVDF 膜一起4℃放置10min,然后制备转移三明治。注:本实验使用Semi-Dry Cell 进行半干电泳转移,转移条件为30mA 90min。使用Blocking Buffer 封闭转印膜4℃封闭过夜,第二天用1×TBST洗涤3 次,每次15min。加入稀释好的一抗,37℃温育2h。用1×TBST 洗涤4 次,每次10min。加入稀释好的二抗,37℃温育2h。用1×TBST 洗涤4 次,每次10min。用SuPer-GL ECL 超敏发光液进行化学发光检测,并对X 光片曝光。经显影定影处理后,晾干的胶片最后用凝胶成像分析系统拍照,本实验采用Gel-Pro Analyzer 软件进行分析处理。
2.4 统计学方法 应用SPSS 22.0 软件包进行统计分析,数据以均数±标准差() 表示,两组间比较采用独立样本t 检验,多组间差异性比较采用One-way ANOVA,组间两两比较采用LSD 法。以P<0.05 为差异有统计学意义。
3 实验结果
3.1 Rt-qPCR 检测肾组织Col-Ⅰ,Col-ⅢmRNA 表达 模型组Col-Ⅰ及Col-ⅢmRNA 表达均较假手术组显著增强(P<0.01),证明造模成功;比较模型组,缬沙坦组、温阳消癥组Col-Ⅰ,Col-ⅢmRNA 表达均显著下降(P<0.01),温阳消癥组Col-Ⅰ,Col-ⅢmRNA 表达下降程度较缬沙坦组更明显(P<0.01)。见表1。
表1 各组小鼠肾组织Col-Ⅰ、Col-ⅢmRNA 表达水平比较(2-△△CT,)

表1 各组小鼠肾组织Col-Ⅰ、Col-ⅢmRNA 表达水平比较(2-△△CT,)
注:假手术组和模型组给予0.2mL 生理盐水灌胃;缬沙坦组给予缬沙坦水悬液灌胃(浓度4.9g/mL,给药剂量16.5mg/kg);温阳消癥组给予温阳消癥方水煎剂灌胃(浓度4.9g/mL,给药剂量49g/kg);与假手术组比较,aP<0.01;与模型组比较,bP<0.01;与缬沙坦组比较,cP<0.01
3.2 Western blot 检测肾组织Col-Ⅰ、Col-Ⅲ蛋白表达 与假手术组比较,模型组Col-Ⅰ及Col-Ⅲ蛋白表达均显著增强(P<0.01),证明造模成功;缬沙坦组、温阳消癥组小鼠肾组织Col-Ⅰ,Col-Ⅲ蛋白表达较模型组显著降低(P<0.01),温阳消癥组下降程度比缬沙坦组更明显(P<0.01)。见表2,图1。
表2 各组小鼠肾组织Col-Ⅰ、Col-Ⅲ蛋白表达水平比较()
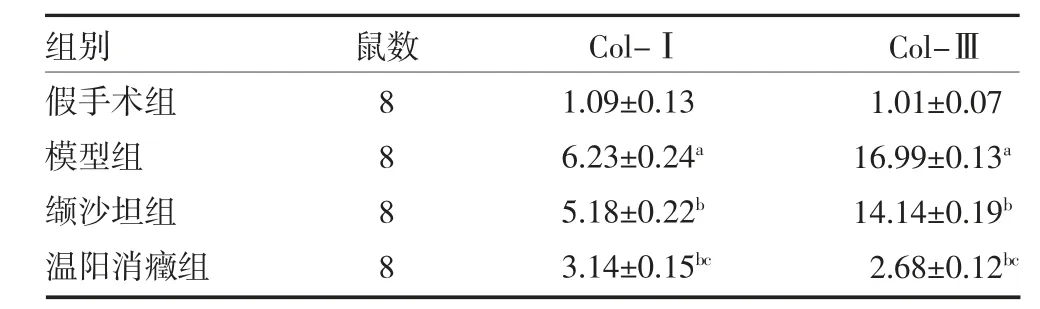
表2 各组小鼠肾组织Col-Ⅰ、Col-Ⅲ蛋白表达水平比较()
注:假手术组和模型组给予0.2mL 生理盐水灌胃;缬沙坦组给予缬沙坦水悬液灌胃(浓度4.9g/mL,给药剂量16.5mg/kg);温阳消癥组给予温阳消癥方水煎剂灌胃(浓度4.9g/mL,给药剂量49g/kg);与假手术组比较,aP<0.01;与模型组比较,bP<0.01;与缬沙坦组比较,cP<0.01
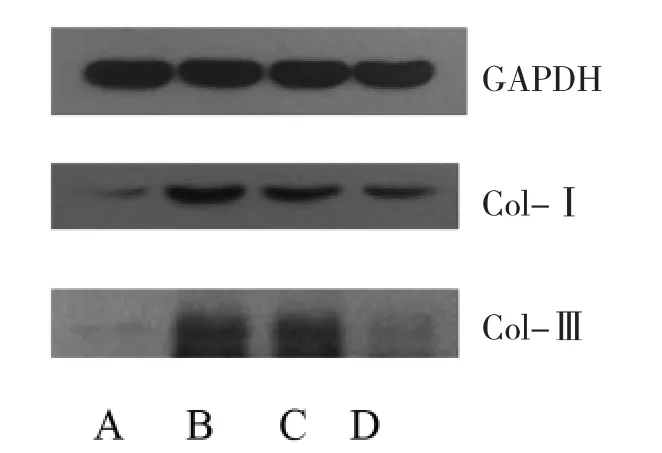
图1 Western bolt 检测小鼠肾组织Col-Ⅰ及Col-Ⅲ蛋白表达
4 讨论
细胞外基质在肾间质的过度沉积是引起肾间质纤维化的直接原因,Col-Ⅰ、Col-Ⅲ是最主要的细胞外基质成分,不但能将各种ECM 成分联结起来,还可诱导肾脏固有细胞合成其他ECM 成分。生理情况下,胶原对修复各种致病因素引起的肾脏损伤有重要的作用,当致病因素持续存在时,修复过程则会出现失控、紊乱,胶原纤维大量聚集,替代正常的肾组织,引起肾单位失功,进展至终末期肾脏病。
目前尚无治疗肾间质纤维化的特效药,临床已证实有确切疗效的药物首选血管紧张素Ⅱ(AngⅡ)的药物。AngⅡ不仅是血管收缩剂,也是重要的肾脏促纤维化因子,可通过一系列细胞内信号传导,调控转化生长因子-β 等因子的表达以及细胞外基质的堆积。本研究的阳性对照药物缬沙坦胶囊即是AngⅡ受体拮抗剂。研究结果提示,缬沙坦组与温阳消癥组Col-I、Col-Ⅲ蛋白与mRNA 的表达均显著下调(P<0.01),证明两种药物均可减轻胶原的堆积,延缓肾间质纤维化的进程,而温阳消癥组胶原表达的下降程度较缬沙坦组更甚(P<0.01),提示温阳消癥方可能在减轻肾纤维化方面疗效更优。
中医认为,“阳气”是人体物质构成和能量发生的本源,人体的功能发挥以阳气充沛为基础,亦因阳气虚衰而致病,因此我们认为,阳虚是肾间质纤维化发生的本因。“瘀血”是肾间质纤维化进程中不可或缺的环节,中医理论认为“久病入络,久病多瘀”,结合现代医学理论,肾脏毛细血管袢闭塞、微血栓形成、细胞外基质沉积等都是瘀血的表现。张沛虬医师根据肾间质纤维化“阳虚血瘀”的病机,拟以温阳消癥方温补脾肾,消癥化瘀。方中以黄芪、党参益气健脾,仙灵脾、肉苁蓉温补肾阳;桃仁、莪术、川芎行气活血,化瘀消癥。研究表明,本方中多种成分在体内外实验中证实有抗肾纤维化的作用,如黄芪是目前抗肾纤维化中药中研究最广泛的药物之一,黄芪甲苷可使UUO 大鼠血肌酐、尿素氮下降,下调α-平滑肌肌动蛋白(α-SMA)及纤维连接蛋白(FN)的表达,抑制转化生长因子-β/Smad 蛋白(TGF-β/smad)信号通路,延缓糖尿病模型小鼠肾纤维化进展[10]。研究还表明,黄芪甲苷通过抑制miR-21 过度表达诱导的足细胞去分化和糖尿病肾病单核细胞活化来改善肾纤维化[11]。淫羊藿总黄酮可下调链脲佐菌素诱导的糖尿病大鼠TGF-β1 蛋白表达,对肾脏损伤有改善作用[12]。
综上,温阳消癥方可下调Col-Ⅰ、Col-ⅢmRNA和蛋白的表达,减少细胞外基质在肾间质的堆积,从而减轻UUO 小鼠肾间质纤维化程度。不足之处在于本研究尚不能明确解释发生作用的分子靶点,因此,研究温阳消癥方发生作用的环节,调控何种因子、通路,是我们未来研究的方向。
