子宫内膜癌拷贝数变异分析
2020-11-24张钏郝胜菊张庆华周秉博陈雪冯暄刘芙蓉王晓黎李富萍刘亚利刘青马旭曹宗富
张钏,郝胜菊,张庆华,周秉博,陈雪,冯暄,刘芙蓉,王晓黎,李富萍,刘亚利,刘青,马旭,曹宗富*
(1.国家卫生健康委科学技术研究所,北京 100081;2.北京协和医学院研究生院,北京 100730;3.甘肃省妇幼保健院医学遗传学中心,兰州 730050)
子宫内膜癌是妇科三大恶性肿瘤之一,约占女性全身恶性肿瘤的7%[1]。子宫内膜癌病死率较高,据统计,2015年,中国的子宫内膜癌新发病例约63 400例,死亡病例21 800例,死亡率约为34.4%[2];2017年,美国的子宫内膜癌新发病例为63 230例,死亡11 350例,死亡率达到18.0%[3]。2013年,美国癌症基因组计划提出通过分子特征来对子宫内膜癌进行分型,并将子宫内膜癌分为POLE超突变组、微卫星不稳定高突变组、低拷贝数变异组及高拷贝数变异组。同年,Nature杂志发表研究报道称通过基因拷贝数变异(CNV)对子宫内膜癌进行重新分级,可能会影响患者的术后辅助治疗方案及疗效,从而为子宫内膜癌患者提供个体化的治疗提供依据[4]。
目前国内外关于子宫内膜癌的基因拷贝数变异研究仍然较少,本研究中我们对10例子宫内膜癌患者的癌组织及其癌旁组织进行拷贝数变异分析,以分析子宫内膜癌的拷贝数变异特点,为给患者提供个体化诊疗方案提供基础。
资料与方法
一、研究对象
收集2018年8月至2019年7月在甘肃省妇幼保健院确诊的10例子宫内膜样腺癌I期患者的癌组织与癌旁组织进行研究,患者平均年龄(54.3±6.72)岁,组织大小为0.5 cm×0.5 cm。排除其他肿瘤及疾病。所有患者均签署了知情同意书,本研究经甘肃省妇幼保健院伦理委员会批准,批准号:[2016]院伦审研第(4)号。
二、研究方法
1.基因组DNA提取:病理切片,经HE染色(图1)排除污染的组织进行DNA提取。应用北京天根公司(中国)生产的石蜡包埋组织基因组DNA提取试剂盒,按照试剂盒说明书进行。使用Nanodrop 2 000核酸定量仪(Thermo Scientific,美国)测定DNA纯度和浓度,OD260/OD280在1.8~2.0之间及DNA浓度>50 ng/μl为初筛合格的DNA样本。使用TE缓冲液将DNA浓度调整至50 ng/μl左右,-20℃保存。

A:癌组织 ×40;B癌旁组织 ×10图1 子宫内膜癌患者癌组织与癌旁组织HE染色
2.基因芯片检测:全基因组DNA拷贝数分析采用昂飞公司(Thermo Scientific,美国)的750 K基因芯片,该芯片包含550 000个检测拷贝数的探针位点及200 000个单核苷酸多态性(SNP)探针位点。除可以进行拷贝数检测外,还可以对杂合性缺失(LOH)和单亲二倍体(UPD)进行分析。实验操作按照文献报道的AffymetrixCytoScanTMAssay 的操作流程进行[5]。主要操作步骤为:初筛合格的基因组DNA经消化和连接后进行PCR扩增,产物进行2%琼脂糖胶电泳检测,5 V/cm 进行 45 min,将主要条带在150~2 000 bp的PCR产物使用磁珠法进行纯化,Nanodrop 2000核酸定量仪测定纯化后的PCR产物浓度,最后产物的浓度≥3.0 μg/μl,产物OD260/OD280在1.8~2.0之间为二次筛选合格的DNA样本;然后将二次筛选合格的DNA样本进行片段化,片段化后的产物经2%琼脂糖胶电泳检测,5 V/cm 进行 45 min,片段分布在25~125 bp之间的产物经Labeling 试剂标记后进行芯片杂交,杂交条件为50℃,60 转/min,16~18 h;芯片杂交好以后分别经过500 μl Stain Buffer 1、500 μl Stain Buffer 2 及800 μl Array Holding Buffer洗涤后进行数据扫描。
3.数据分析:通过ChAS软件(美国)对芯片扫描数据进行分析。当被检测数据的质量控制(Quality Control,QC)数据SNP-QC≥15.0、绝对对差中值(MAPD)≤0.25及Waviness-SD≤0.12时,说明被检测数据的质量高。MAPD表示相对于log2值的探针之间的距离。SNP-QC代表各个探针聚集的基因型簇之间的分离程度。Waviness-SD代表探针组之间的差异。这些质量控制指标可以评估SNP芯片检测数据的整体质量。根据人类基因组版本GRCh37(hg19)注释对微阵列数据进行解释。选择符合QC标准并CNV片段超过100 Kb和出现至少10个连续异常探针的区域进行进一步分析。根据log2值来判断拷贝数状态(copy state,CN),CN=2为正常,CN=3为重复(duplication,dup),CN=1为缺失(deletion,del),当CN介于1~2或者2~3之间时代表存在嵌合缺失或者重复,根据CN的值来判断缺失或重复在癌组织标本中的比例。将检测出的CNV在DGV(http://dgv.tcag.ca/dgv/app/home)、Decipher (https://decipher.sanger. ac.uk/browser)、ClinVar (https://www.ncbi.nlm.nih.gov/clinvar/)中进行对比,以排除健康人群中的多态性变异。
结 果
一、标本数据质量检测
10例患者癌组织及癌旁组织标本的CNV均检测成功,SNP-QC≥15.0、MAPD≤0.25及Waviness-SD≤0.12(图2)。

图2 ChAS软件分析样本质量
二、10例子宫内膜癌患者癌组织与癌旁组织样本CNV分析
10例癌组织标本中,经过ChAS软件分析,有6例检测到了CNVs,其中5例患者癌组织标本仅检测到重复或嵌合重复,例如:8号患者癌组织标本中1号染色体长臂存在重复,8号染色体存在嵌合重复(图3),1例患者中既检测到了重复或嵌合重复也检测到了缺失及嵌合缺失。在10例癌旁组织中均未检测到100 Kb以上CNVs(表1)。
生活不会因为你是姑娘就对你笑脸相迎,想要出类拔萃,自身必须努力,你要学会用自己热爱的方式生活,不堕落,不浮夸,活成岁月静好的理想模样。
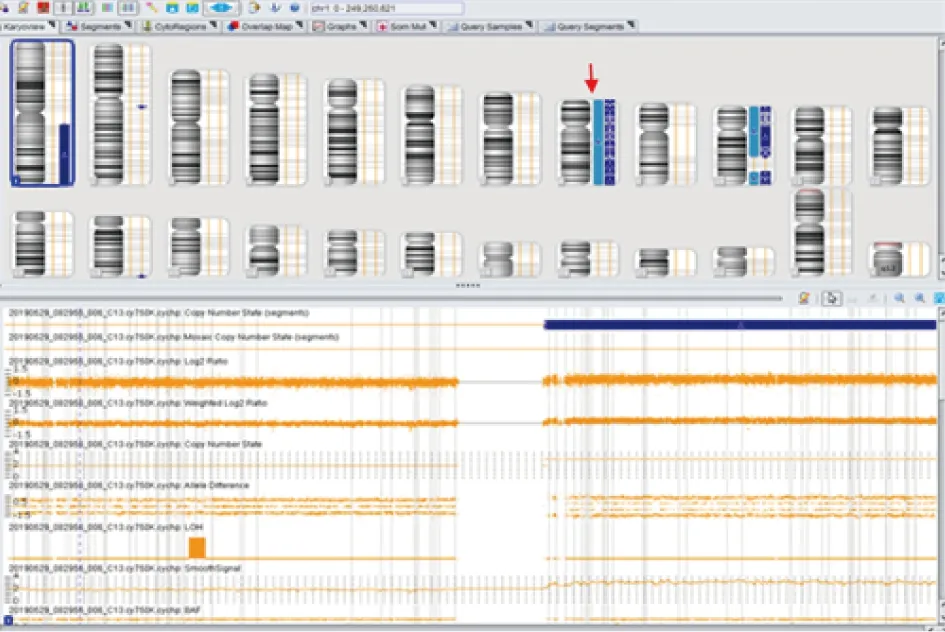
蓝色框表示1号染色体长臂存在重复;红色箭头所指为8号染色体存在嵌合重复。图3 ChAS软件分析8号患者癌组织中的CNVs
在癌组织中,CNVs范围为10~146 Mb,平均为(75.35±40.00) Mb,分布在1、4、6、8、10、13、14、16、17、19、22号染色体上,其中,1q21.1q44 dup 103 Mb及8p23.3q24.3 dup 146 Mb出现了2次;在6例患者的癌组织标本中共检测到20种CNVs,缺失及嵌合缺失有9种,重复及嵌合重复有11种;Decipher及ClinVar数据库分析这些CNVs的致病性,结果表明有9种CNYs是致病的,其余11种为可能致病(表2)。

表1 10例子宫内膜癌患者癌组织与癌旁组织的CNVs检出情况

表2 子宫内膜癌组织CNV类型及致病性
讨 论
本研究对10例子宫内膜癌患者的癌组织及癌旁组织标本进行了CNV检测分析。有6例癌组织标本检测到了CNVs,检出率为60%,其中,除1例癌组织标本仅检测到1种CNV外,其他5例均检测到2种以上CNVs。10例癌旁组织均未检测到CNVs。本研究的癌症组织样本中共发现20种CNVs,主要集中在8号和10号染色体上,分别占20%(4/20)与25%(5/20),其中,1q21.1q44 dup 103 Mb与8p23.3q24.3 dup 146 Mb比例较高,均出现2次。
我们对本研究中发现的20种 CNVs进行了致病性分析,发现其中11种为可能致病性变异,9种为致病性变异。Decipher及ClinVar数据库中已经报道的与这些CNVs片段长度相似的临床表型多为一些综合征表型,包括耳廓异常、先天性小头畸形、睑裂下垂、嘴角下倾等特殊面容;肾上腺发育不全、异位肛门、婴儿进食困难及先天性心脏病、全面发育迟缓等。但是关于这些CNVs与子宫内膜癌的发生发展及治疗预后情况却未见相关收录信息。
2011年,Karageorgi等[6]研究发现:谷胱甘肽巯基转移酶-T1(GST-T1)基因拷贝数变异可能会使子宫内膜癌的患病风险增加。2013年,Nature杂志报道称:子宫内膜癌的特色基因包括低拷贝数基因和高拷贝数基因,它们可能会影响子宫内膜癌患者的术后辅助治疗,可根据子宫内膜癌的基因组特征对其进行重新分类;并且建议临床医师对存在有CNVs的子宫内膜癌患者应考虑使用化疗而不是辅助放疗[4]。Moir-Meyer等[7]发现子宫内膜癌组织中存在罕见的种系缺失CNVs,这些CNVs分布于功能基因、CpG岛与sno/miRNAs区域,并对这些区域进行破坏,例如:病例组与对照组的sno/miRNA区域被这种罕见CNVs缺失造成的破坏比例高达30∶1。如果被罕见CNVs缺失破坏的区域还包括DNA修复基因,则可导致DNA修复基因调节异常而发生肿瘤[7]。当然,个别基因的缺失及失活也与子宫内膜癌的发生及预后相关,如ZFHX3基因失活或缺失不仅会影响子宫内膜癌的发生,还会影响患者的预后[8]。
子宫内膜癌组织的CNVs存在种族差异,有研究发现,尼格罗人携带高CNVs的比例显著高于高加索人(P<0.05),与携带高CNVs的高加索人比较,携带高CNVs的尼格罗人的子宫内膜癌的无进展生存率较差[9]。因此,通过对子宫内膜癌组织CNVs数据的深入探索及综合分析,可以获取更多相关的生物学信息,从而更好地了解其进展规律及恶化机制,为今后子宫内膜癌的防治及个体化治疗打下基础[10]。但目前国内外关于这方面的研究报道较少。
本研究的10例子宫内膜癌样本中,有6例样本检出了CNVs,分布在1、4、6、8、10、13、14、16、17、19、22号染色体上,主要集中在8号和10号染色体。共发现20种CNVs,其中重复及嵌合重复有11种,占55%,缺失及嵌合缺失有9种,占45%,这说明子宫内膜癌的细胞分子特性存在一定异质性,并不是所有癌细胞均存在CNVs,这与以外文献报道一致[11-14]。分子诊断可以对组织病理学进行补充,为一些疑难病例提供更精确的诊断,但应用到临床实践中的仍然较少[15]。在今后的子宫内膜癌的治疗中,是否可以根据癌组织的CNVs及嵌合情况来对患者进行更加精准的治疗,还需进一步研究。
本研究仅分析了10例子宫内膜癌患者的癌组织与癌旁组织的CNVs情况,由于标本量有限,尚不能完全说明子宫内膜癌组织的CNVs对该疾病治疗及预后的价值。虽然有一定缺陷,但本研究发现这些CNVs主要集中在8号和10号染色体上,这可能对今后子宫内膜癌的个体化治疗有一定的意义。今后我们将继续扩大样本量进行研究,并随访患者生存及预后情况,以揭示检测子宫内膜癌组织CNVs对患者进行精准治疗的价值。
