轻中度卵巢子宫内膜异位囊肿手术对IVF-ET结局的影响
2020-11-24刘梦瑶曹阳刘建新
刘梦瑶,曹阳,刘建新
(青岛大学附属医院生殖中心,青岛 266061)
卵巢子宫内膜异位症(Overian endometriosis,OEM)囊肿是由于子宫内膜组织在卵巢皮质内生长而引起的疾病[1],在育龄期妇女中发病率可达10%~15%,在不孕症患者中其发病率达40%~50%[2]。临床上对于OEM合并不孕症的治疗主要有药物、手术及体外受精-胚胎移植(IVF-ET)3种方式[3]。目前临床上尚无特效药物根治子宫内膜异位症,促性腺激素释放激素激动剂(GnRH-a)可通过使垂体达到去敏感状态来抑制卵巢活性使异位灶萎缩,但GnRH-a亦可造成卵巢过度抑制状态,其是否能改善卵母细胞质量及临床妊娠结局仍存在争议[4]。随着腔镜技术的推广,腹腔镜下囊肿剔除术已成为OEM囊肿的一线疗法,其不仅可明确诊断分期,亦可清除异位病灶、恢复盆腔正常解剖结构。但研究表明,手术仅可提高自然妊娠的几率,且术后异位囊肿存在复发的风险,手术操作亦可损伤正常的卵巢组织造成卵巢储备功能减退[5]。欧洲生殖胚胎学会建议合并OEM的不孕患者进行辅助生殖技术(ART)助孕,特别是合并输卵管因素、男方因素或其他治疗方式失败者[5]。但也有学者提出,IVF-ET对于OEM患者的卵泡发育、子宫内膜容受性等并无明显改善作用,且异位囊肿的存在会增加取卵操作的困难及感染的风险[6]。对于合并OEM选择IVF-ET助孕的患者,助孕前是否有必要行腹腔镜下囊肿剥除术目前存在争议。本研究收集335例OEM合并不孕症行IVF-ET助孕患者的临床资料,并以单纯输卵管因素行IVF-ET患者作为对照,探讨OEM合并不孕症患者助孕前手术与否对IVF-ET结局产生影响,旨在为临床治疗OEM导致的不孕症提供参考。
资料与方法
一、研究对象
选取2016年l月至2019年8月在青岛大学附属医院生殖中心因单侧OEM导致不孕并接受IVF-ET助孕治疗的335例患者为研究对象,根据助孕前是否行腹腔镜下OEM囊肿剥除术分为手术组(n=144)与OEM组(n=191),同时纳入同期因单纯输卵管因素在我院行IVF-ET助孕的276例患者作为对照组(n=276)。
具体纳入标准:(1)手术组:既往行腹腔镜下囊肿剥除术,术中腹腔镜探查可见卵巢内膜异位病灶且术后经过病理证实。r-AFS分期法均为I~Ⅲ期;病灶完全切除且在术后未行辅助治疗,1年内首次行IVF-ET术。(2)OEM组:OEM囊肿的诊断至少有两次超声记录且至少间隔两个月经周期,测量囊肿3条垂直径线取平均值为囊肿直径,且囊肿直径大于10 mm。(3)对照组:术前输卵管造影证实双侧输卵管不通。
排除标准:(1)年龄≥40岁或基础卵泡刺激素(FSH)水平>10 U/L;(2)同时合并有多囊卵巢综合征(PCOS)、甲状腺功能异常、肾上腺皮质肿瘤、高泌乳素血症等其他明确不孕因素;(3)合并其他性质的卵巢肿瘤或卵巢手术史;(4)合并染色体异常或遗传性疾病;(5)男性因素不育者;(6)存在宫腔粘连、子宫内膜息肉、粘膜下肌瘤等宫腔因素不孕者。
二、研究方法
1.促排卵治疗和胚胎移植:所有患者于月经第2天清晨抽取静脉血测量血清基础性激素水平,包括基础FSH、泌乳素(PRL)、黄体生成素(LH)、孕酮、睾酮(T)和雌二醇(E2),以及测量血清CA125,经阴道B超测量记录基础窦卵泡数(AFC)。根据患者年龄、基础性激素水平及卵巢超声特征等制定个性化促排卵方案,于月经周期第2~3天分别给予个体化促排卵,定期行阴道超声及激素水平检测监测卵泡发育,并根据卵泡发育情况调整促性腺激素(Gn)用量。当有2~3个优势卵泡直径≥18 mm时,于当晚21点肌肉注射人绒毛膜促性腺激素(HCG,珠海丽珠)6 000~8 000 U。注射HCG后34~36 h经阴道后穹隆超声引导下穿刺取卵。取卵前测量血清E2水平,并记录总Gn用量及天数。根据男方精液情况选择常规IVF或卵胞浆内单精子注射(ICSI)授精。若出现未获卵、卵巢过度刺激综合征(OHSS)高风险、无可移植胚胎、累积胚胎或患者合并其他不适合移植的疾病等情况,则本周期取消新鲜胚胎移植,冷冻胚胎择期行冻融胚胎移植(FET)。移植的新鲜胚胎均为优质胚胎。
2.妊娠判断及统计指标:胚胎移植后第35天行B超检查见宫内孕囊者定义为临床妊娠,孕囊个数定义为着床个数。收集所有患者的基本资料,包括年龄、AFC、不孕年限、CA125、基础体重指数(BMI),月经第2天血清基础内分泌激素水平:包括FSH、PRL、T、P、LH和E2,比较3组患者的总Gn用量及天数、取卵前血清E2水平、获卵总数、可移植胚胎数、优质胚胎数、受精率、优质胚胎率、囊胚形成率、鲜胚种植率、鲜胚临床妊娠率、鲜胚移植早期流产率、鲜胚分娩率。
三、统计学方法
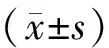
结 果
一、3组患者的基本情况
3组患者基础资料比较,不孕年限、BMI及基础LH、E2、T、P、PRL水平均无显著性差异(F=0.198~2.811,P>0.05);对照组年龄、基础FSH水平及CA125水平均显著低于手术组与OEM组(t=3.527~4.930,P<0.05);3组间AFC比较存在显著性差异(t=4.101~4.456,P<0.05)(表1)。
表1 三组患者基础资料比较 (-±s)
二、3组患者促排情况及IVF-ET结局比较
统计结果显示,总Gn用量对照组显著低于手术组与OEM组(t=4.002~5.004,P<0.05);取卵前E2水平、获卵总数、可移植胚胎数及优质胚胎数3组间比较均有显著性差异(t=2.682~9.140,P<0.05);对照组卵裂率显著高于其他两组,手术组受精率及优质胚胎率显著低于其他两组(χ2=3.939~14.689,P<0.05);3组患者总Gn天数、囊胚形成率、移植鲜胚数及鲜胚种植率、临床妊娠率、早期流产率、分娩率比较均无显著性差异(F=0.902,χ2=0.016~3.264,P>0.05)(表2)。
表2 三组患者促排卵情况及IVF-ET结局比较[(-±s),%]
三、3组患者的单侧卵巢AFC及获卵数比较
OEM组及手术组健侧卵巢AFC及获卵数均显著高于同组内患侧/术侧(t=3.014~4.335,P<0.05),OEM组患侧卵巢AFC及获卵数均显著高于手术组术侧(t=2.332 1、3.453,P<0.05);对照组单侧卵巢AFC与手术及OEM组健侧比较无显著性差异(t=1.679、2.557,P>0.05),而获卵数对照组单侧显著高于手术组健侧(t=5.389,P<0.05),与OEM组健侧比较无显著性差异(t=2.322,P>0.05)(表3)。
四、手术组与OEM组各临床因素对获卵数的影响
纳入年龄、OEM直径、BMI、基础FSH水平、取卵前E2水平、AFC、不孕年限、CA125水平共8项因素,采用多元线性回归分析其对获卵数的影响。结果显示,OEM组取卵前E2水平为预测获卵数的最佳指标,其次为年龄、AFC、基础FSH水平(t=-4.340~7.743,P<0.05),OEM直径、BMI、不孕年限及CA125水平对获卵数无显著影响(t=-2.255~0.745,P>0.05)(表4)。手术组获卵数与取卵前E2水平及AFC显著相关(t=7.932、3.329,P<0.05),其余指标对获卵数无显著影响(t=-1.553~1.611,P>0.05)(表5)。

表3 三组单侧卵巢窦卵泡数及获卵数比较(-±s)

表4 多元线性回归分析影响OEM组获卵数的相关因素
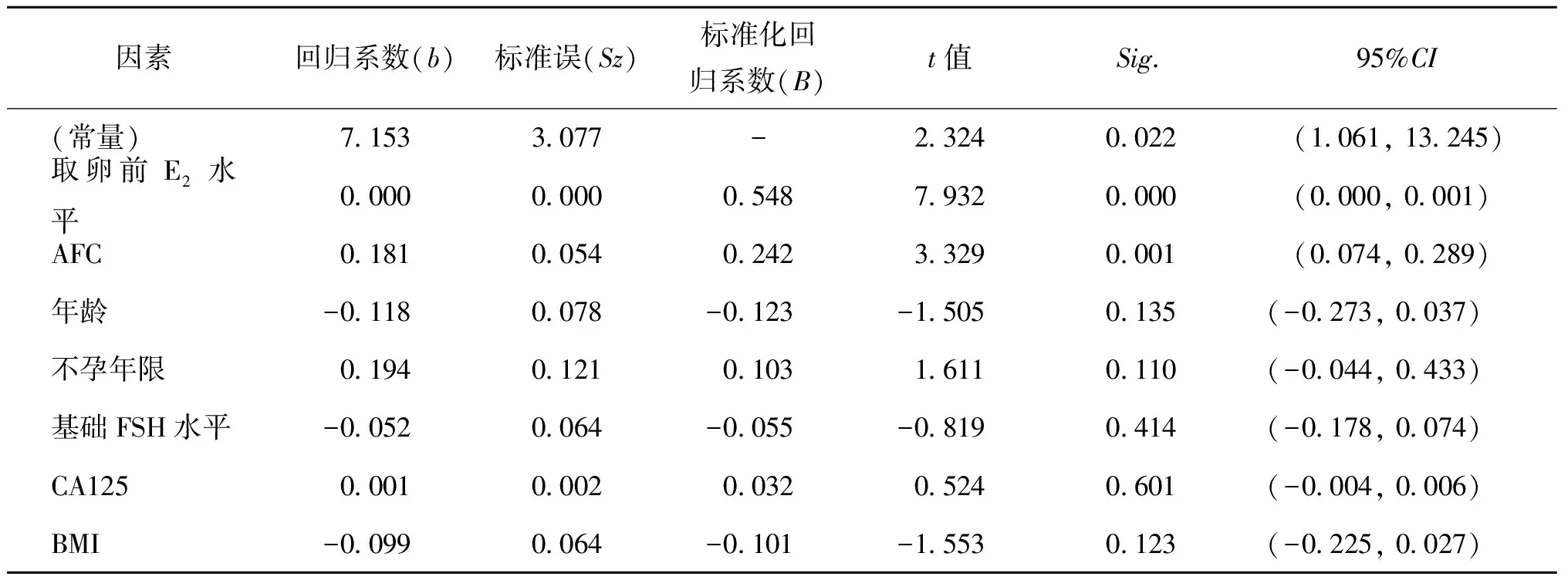
表5 多元线性回归分析影响手术组获卵数的相关因素
讨 论
OEM作为一种雌激素依赖的炎性疾病,可从多方面影响女性生殖功能。由于其发病机制及病理生理过程复杂多变,异位囊肿的存在是否会影响IVF-ET结局及助孕前是否需手术剔除异位囊肿病灶一直存在争议[7]。
OEM造成不孕症的机制尚未明确,现研究认为与其损伤卵母细胞及胚胎质量、造成卵泡早期闭锁、降低子宫内膜容受性、造成盆腔粘连等多因素有关[8]。本研究中,OEM组患者与对照组患者相比,其基础FSH水平偏高,而AFC偏低,说明合并OEM患者的卵巢储备明显低于单纯输卵管因素患者。并且OEM组患者患侧卵巢AFC明显低于健侧,进一步说明OEM的存在会对周围卵巢组织造成损伤。目前认为与异位病灶侵袭性生长对正常卵巢组织及血液供应造成机械性损害及异位囊肿内大量的细胞损伤因子诱发病灶周围卵巢组织反复炎性反应与纤维化形成有关。
腹腔镜下异位病灶剔除术是当前临床治疗OEM的一线疗法,亦是诊断OEM的金标准。2015年《子宫内膜异位症的诊治指南》建议OEM直径≥4 cm时应行手术治疗[9]。但研究表明术后患者仅自然受孕几率增加[10],术后2年异位病灶的复发率高达24.6%,复发后将更进一步加重对卵巢的损害[11],故对于高龄或合并其他因素需行IVF-ET助孕的OEM患者,助孕前是否需手术剔除异位病灶仍存在争议。本研究中纳入手术组患者按 r-AFS 分期法分期均为Ⅰ~Ⅲ期即轻中度OEM患者,手术组与OEM组患者基本情况无显著差异,但AFC、取卵前E2水平、获卵数、可移植胚胎数、优质胚胎数、受精率及优质胚胎率手术组均显著低于OEM组及对照组,且手术组术侧AFC及获卵数也显著低于OEM组患侧,提示对于轻中度OEM患者,助孕前手术剥除异位病灶并不能改善IVF-ET助孕结局,甚至增加卵巢储备及卵子质量降低的风险,与 Laursen等[10]研究结果相符。还有研究表明腹腔镜下OEM剥除术后,患者AFC及血清抗苗勒管激素(AMH)水平均较术前显著降低[12],再次提示了手术对卵巢储备的不良影响。手术的治疗效果与囊肿大小及位置、囊肿与周围组织的黏连程度及术者操作经验等多种因素有关,术后卵巢储备及反应的减退目前认为主要因手术操作时不可避免地剥离损伤正常卵巢组织造成卵泡丢失;同时电凝止血时对卵巢组织产生热损伤;术后卵巢血运供应受损;术后卵巢局部产生炎症反应及自身免疫反应对存留卵巢进一步损伤。本研究作为回顾性分析,未能将个体手术前后的卵巢储备及卵母细胞质量进行对比,有待于后续进一步研究加以探讨。
对于中重度内异症、高龄(>35岁)、合并严重男方因素、卵巢功能减退或输卵管异常的患者,现临床建议首先考虑IVF-ET[9]。OEM的存在是否会影响IVF-ET结局目前仍无定论,Hamdan等[13]行Meta分析指出,r-AFS分期Ⅰ~Ⅱ期的子宫内膜异位症患者IVF结局不受影响,但有学者提出OEM的存在会增加取卵操作的困难及感染的风险,同时存在囊肿扭转甚至癌变的可能;且IVF-ET术后发生流产、子痫前期、早产等远期产科并发症的几率明显高于其他因素患者[14-16]。本研究中与单纯输卵管因素患者相比,OEM组患者总Gn用量偏高,而取卵前E2水平、获卵数、卵裂率、可移植胚胎数及优质胚胎数均偏低,证明OEM的存在会降低周围卵巢组织对促排卵药物的反应性[17-18]。Opøien等[19]研究提示轻中度OEM的存在虽然会影响IVF-ET中卵巢的反应,但可获得与单纯输卵管因素IVF相近的妊娠结局。本研究中OEM组与对照组相比,受精率、囊胚形成率及鲜胚移植妊娠结局之间的差异无统计学意义,考虑与健侧卵巢的代偿作用、辅助生殖技术中ICSI弥补了OEM中卵母细胞透明带硬化造成的受精率下降、胚胎移植技术弥补了盆腔炎症微环境对胚胎的损害等原因有关。但本研究未能将单侧卵巢所获卵母细胞分别培养,也未进行囊胚及冻存胚胎移植结局统计,故对于轻中度OEM对子宫内膜容受性、IVF-ET总体妊娠结局及远期并发症的影响,需扩大样本量进一步研究。
关于OEM影响IVF-ET结局的相关因素一直是关注的热点,临床进行大量研究以期找到合适指标为助孕前评估异位囊肿对妊娠结局的影响提供参考。本研究对可能影响手术组与OEM组获卵数的因素进行多元线性回归分析,结果发现,手术组获卵数与取卵前E2水平及AFC明显相关;OEM组取卵前E2水平为预测获卵数的最佳指标,其次为年龄、AFC、基础FSH水平,OEM直径[20]、BMI、不孕年限及CA125水平对获卵数无明显影响。故而发现,无论是手术组还是OEM组,取卵前E2水平为预测获卵数的最佳指标,血清中E2来源于发育中的卵泡并随着卵泡发育水平升高,单个成熟卵泡取卵前血清E2水平可达1 100 pmol/L[21],但此指标仅适用于促排卵过程中的评估。对于轻中度OEM的不孕患者,卵巢储备是决定助孕结局的主要因素,助孕前需着重考虑患者AFC、年龄及基础FSH水平以综合评估其卵巢储备情况,从而评估手术的相对价值及必要性。若患者卵巢储备减退或合并其他IVF-ET指征,建议避免手术对卵巢的进一步损伤直接行IVF-ET治疗。
综上所述,轻中度OEM的存在会降低卵巢储备及卵巢对促排卵药物的反应性,继而影响IVF-ET结局。腹腔镜下OEM剔除术并不能明显改善轻中度OEM患者的助孕结局,反而可增加对卵巢储备的损害。故助孕前需综合评估患者年龄、卵巢储备情况等因素以衡量手术相对价值。
