介绍一种外泌体负染色的改良方法
2020-11-24首都医科大学100069金良韵姬曼孙竹林杨慧陈大兴赵君朋
首都医科大学(100069)金良韵 姬曼 孙竹林 杨慧 陈大兴 赵君朋
细胞外囊泡(extracellular vesicles,EVs)为磷脂双分子层的小囊泡,其直径范围在30nm~150nm之间,其在细胞膜上生成,后分泌到细胞外,其囊泡内包含有蛋白质、脂类等多种成分,作用主要是能够与附近及远距离细胞进行通讯联系[1]。细胞外囊泡是细胞间重要的信息传递器,因此可以被用作药物传递系统或疾病生物标志物[2]。外泌体介导的细胞间通讯主要通过以下三种方式:一是外泌体膜蛋白可以与靶细胞膜蛋白结合,进而激活靶细胞内的信号通路。二是在细胞外基质中,外泌体膜蛋白可以被蛋白酶剪切,从而激活细胞内的信号通路。三是外泌体膜可以与靶细胞膜直接融合,非选择性的释放其所含的蛋白质、mRNA以及microRNA。外泌体的提取可以分为以下几种:超速离心法、过滤离心、密度梯度离心法、免疫磁珠法、ps亲合法等提取方式。目前来说超速离心法是被应用最广泛的方法。本文用超速离心法对外泌体进行提取,所用的改良版外泌体负染色中加入冷冻超薄切片试剂中的甲基纤维素(MC),由于其能对外泌体膜起到支撑作用,所以期待能得到更佳的外泌体形态电镜图像。
1 材料与方法
1.1 试剂与仪器 收集正常小鼠血清样品,采用超速离心法提取外泌体。2%多聚甲醛(PFA)购置于英国阿法埃莎公司(Alfa Aesar),用0.1M PBS液配置,并于4℃冰箱保存。1%戊二醛(GA)购置于英国阿法埃莎公司(Alfa Aesar),用0.1M PBS液配置。醋酸双氧铀(SPI),用超纯水配成4%溶液,密闭、避光保存。2%甲基纤维素(MC)购于美国Sigma公司。200目方华膜加碳膜的铜网购自北京中镜科仪技术有限公司。日立-天美HT7700透射电子显微镜。
1.2 方法
1.2.1 醋酸双氧铀负染色方法 采用铜网悬浮法,进行外泌体的附着和染色方法。操作如下:①将新鲜提取外泌体固定在50~100μl的2%PFA中。②取沉淀5μl,在铜网上孵育20min。③将铜网倒扣在50μl醋酸双氧铀液滴上,孵育5min。④转移到100μl的双蒸水液滴中漂洗2min。⑤滤纸吸干、迅速烤干后,于透射电子显微镜下观察。

附图1 普通醋酸双氧铀染色的结果。a:低倍可见外泌体形态不规则,膜结构()有塌陷。标尺=500nm;b:高倍可见外泌体立体结构不明显,形态不规则,且外泌体膜()有塌陷。标尺=200nm
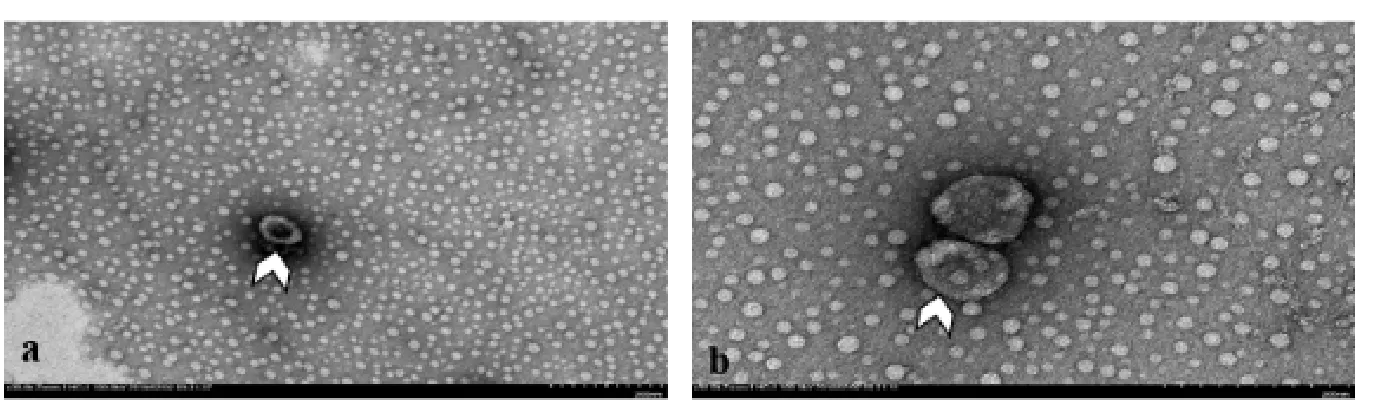
附图2 改良版负染色的结果。a:低倍可见外泌体形态基本规则,立体结构明显,膜结构()光滑饱满。标尺=200;b:高倍可见外泌体大小集中在80nm~120nm之间,主要是膜结构光滑、饱满,反差明显,观察效果佳。标尺=200nm
2 结果
2.1 普通醋酸双氧铀染色的结果 见附图1。
2.2 改良版负染色法的结果 见附图2。
3 讨论
用负染色的方法在透射电镜下观察外泌体的形态,是目前最可靠的方法,需要在透射电子显微镜下找到其符合外泌体形态特征的囊泡[3]。负染色方法的原理是利用高密度的、在透射电镜下不显示结构的重金属盐,将生物标本包围起来,以增强背景散射电子的水平,吸附了重金属盐的样品的超微结构在黑暗的背景上显示阴性反差[4]。而负染色既简单便捷、又节省试剂耗材,都是其优点,故而使其广泛应用在细菌、病毒、大分子结构的研究中,也是透射电子显微技术中一项重要的实验技术手段。
目前几种方法中醋酸双氧铀染色效果被认为是最佳,但是仍然有其局限性和不足,故本实验针对其不足补充了甲基纤维素(MC)和铀(UA)混合液进行双染的方法,对其膜结构进行优化染色。可见改良后的外泌体形态结构更完整,外泌体膜结构更光滑,立体结构也更明显。MC第一次在电子显微镜技术中常规使用在干燥过程中支持醛固定的冷冻超薄切片技术中。当重金属被包裹在薄膜中时,MC可以防止膜结构的崩塌,并能够出现显著均匀度对比。从早期的冷冻实验的结果来看,研究表明尤其在小的细胞器,如外泌体、内小体、自噬体的分离膜中起到支持和对比方面的作用[5]。在本实验中,笔者证实了含有醋酸双氧铀的MC膜在脂质结构的对比上提供了显著的改进,优于单独应用醋酸双氧铀的负染色。这种MC嵌入染色程序提供了吸附粒子的全面可视化,并限制了这些软生物结构的膜崩溃。MC和UA的双染方法有可能大大改善常规表征和定量的广泛的合成以及自然发生的膜结构。
本实验中需要注意的细节有:①应用甲基纤维素试剂时,应该在冰上操作。②笔者尽量用新鲜提取的外泌体样本,直接浸在PFA液体中,以及时固定膜结构,固定后可在4℃冰箱保存一周,越早做结构越好。③应避免对提出的外泌体样本进行反复-20℃或-80℃的冻融,而对囊泡的形态造成影响。④使用醋酸双氧铀时,注意避光处理,并且注意辐射危害并妥善处理染液。
虽然用负染色对外泌体进行形态鉴别是现在常用的手段,但也存在不足及有待改进。也可以用特异性抗体对外泌体进行标记,以区分提取过程中混入的微泡。或者用冷冻电子显微镜直接观察外泌体的形态结构,当然这种方法无需化学固定剂,也就避免了化学固定中的结构变化,故可以最大程度的保存生物活性[2]。所以,也期待着后续随着对外泌体的研究更加的深入,以便能更加明确外泌体的机制,对临床的应用提供更有价值的研究思路。
