基于网络药理学探讨独活-桑寄生治疗骨质疏松症的活性成分及生物学基础
2020-11-23周帅琪梁龙于杰魏戌冯敏山王尚全银河尹逊路陈明朱立国
周帅琪 梁龙 于杰 魏戌 冯敏山 王尚全 银河 尹逊路 陈明* 朱立国*
1.中国中医科学院望京医院,北京 100102 2.北京中医药大学,北京 100029 3.中医正骨技术北京市重点实验室,北京 100700
骨质疏松症(osteoporosis,OP)是骨的脆性因骨密度降低、骨微观结构退化而增加的多发于中老年人的全身性骨代谢疾病,其严重后果为日常活动中骨折危险性增高,导致骨质疏松性骨折[1]。临床表现以腰酸膝软、疼痛或全身骨痛为主。OP发病受年龄、性别、体质、营养、运动等多种因素的影响[2],治疗也具有多样性,中医药以其多成分多靶点多通路的特点,在OP的治疗中具有独特的优势。
OP属于中医“骨痿”“骨枯”“骨痹”等范畴,参考《中西医结合风湿免疫病学》《中医诊断学》和中医药防治骨质疏松症相关专家共识,可归纳常见证型为肝肾阴虚证、肾阴阳两虚证、脾肾阳虚证、肾虚血瘀证[3-4]。《黄帝内经》记载:“肾生骨髓,髓生肝”。《医经精义》云:“髓者肾精所生,精足则髓充,髓充者则骨强”。临床常用独活寄生汤进行治疗,取其补益肝肾、祛湿止痛之效,方中以独活和桑寄生为君药,独活,味辛、苦,性微温,归肾、膀胱经,具有祛风除湿,止痛,解表之功效,为治风湿痹痛的主药;桑寄生,味苦、甘,性平,归肝、肾经,具有祛风湿,补肝肾,强筋骨的功效,《本草求真》谓其为补肾补血要剂,两药合用,共奏补益肝肾,祛痹止痛之效。然而基础研究中关于独活寄生汤治疗OP的相关报道较为少见,其作用机制也尚未明确,故选取独活-桑寄生药对,分析其有效成分、作用靶点及潜在机制,为其临床推广应用提供科学依据,也为进一步探究独活寄生汤治疗OP的作用机制奠定基础。
网络药理学结合多学科知识和方法,具有系统性、整体性的特点。中药深入研究的过程,常因药物成分多、靶点及作用途径复杂,致使研究较为困难。网络药理学的优势为研究中药提供了新的方向,可从整体角度系统分析药物对疾病的干预和影响,揭示中药作用的物质基础和分子机制[5]。本研究使用网络药理学的方法,从分子水平探索独活-桑寄生治疗OP的作用机制,为进一步研究和临床推广应用提供参考。
1 数据获取和处理
1.1 中药成分及靶点筛选
本研究首先在TCMSP数据库(http://tcmspw.com/tcmsp.php)中输入中药名称“独活”“桑寄生”为检索词获取两种药物的化学成分,并通过BATMAN-TCM数据库(http://bionet.ncpsb.org/batman-tcm/)进行补充,将满足筛选条件:口服生物利用度(oral bioavailability,OB)≥30%、类药性(drug likeness,DL)≥0.18的结果保留即为独活和桑寄生的有效成分。将所得的有效成分通过SymMap数据库(https://www.symmap.org)获得其相应靶点,并利用Uniprot数据库(http://www.uniprot.org/)筛选物种为“homo sapiens”的靶点,即独活-桑寄生主要成分的预测靶点。综合可得到药物-成分-靶点关联数据。
1.2 OP相关靶点搜集
以“Osteoporosis”为关键词通过GeneCards数据库(https://www.genecards.org/)检索与骨质疏松症有关联的靶点。
1.3 中药作用疾病的潜在靶点预测
将上述获得的药物靶点和疾病靶点输入OmicShare云平台(http://www.omicshare. com)维恩图模块进行映射,筛选出独活-桑寄生与OP的共标靶点,此共标靶点即为本研究中药治疗疾病的潜在作用靶点。
1.4 数据网络构建
通过Cytoscape3.6.0软件中“Network Analyze”分析网络拓扑参数功能,将筛选得到的独活-桑寄生治疗OP的潜在作用靶点和2.1中药物-成分-靶点相关数据导入软件,并分析得到网络拓扑参数筛选核心成分和靶点。
1.5 GO富集分析
通过NCBI数据库(https://www.ncbi.nlm.nih.gov)获得独活-桑寄生治疗OP潜在靶点的Gene ID,并将此数据通过Ensembl基因组数据库(http://www.ensembl.org/index.html)转化为Ensembl Gene ID。在OmicShare云平台动态GO富集分析模块进行分析,将输出结果满足限定条件P<0.01,FDR<0.01的进行保留,并按照P值从小到大排序,选取前20个GO条目绘制成高级气泡图。
1.6 KEGG 通路富集分析
通过DAVID6.8数据库(https://david.ncifcrf.gov)对独活-桑寄生治疗Osteoporosis的潜在靶点进行KEGG通路富集分析,将输出结果满足限定条件P<0.01,FDR<0.01的进行保留,删除其中疾病相关信号通路后按照P值从小到大排序,选取前10条在OmicShare云平台高级气泡图模块绘制成图。
2 结果
2.1 中药作用疾病的潜在靶点预测
通过TCMSP数据库、BATMAN-TCM数据库检索到独活化合物96个,桑寄生化合物9个,限定条件下筛选出两味中药活性化合物共41个,共预测靶标355个。同时将检索得到的4 091个OP相关靶点进行维恩图映射,并取交集,得到138个中药治疗疾病的潜在作用靶点,见如图1。潜在靶点对应活性成分共39个,其所在药物和相应的潜在靶点如表1所示。
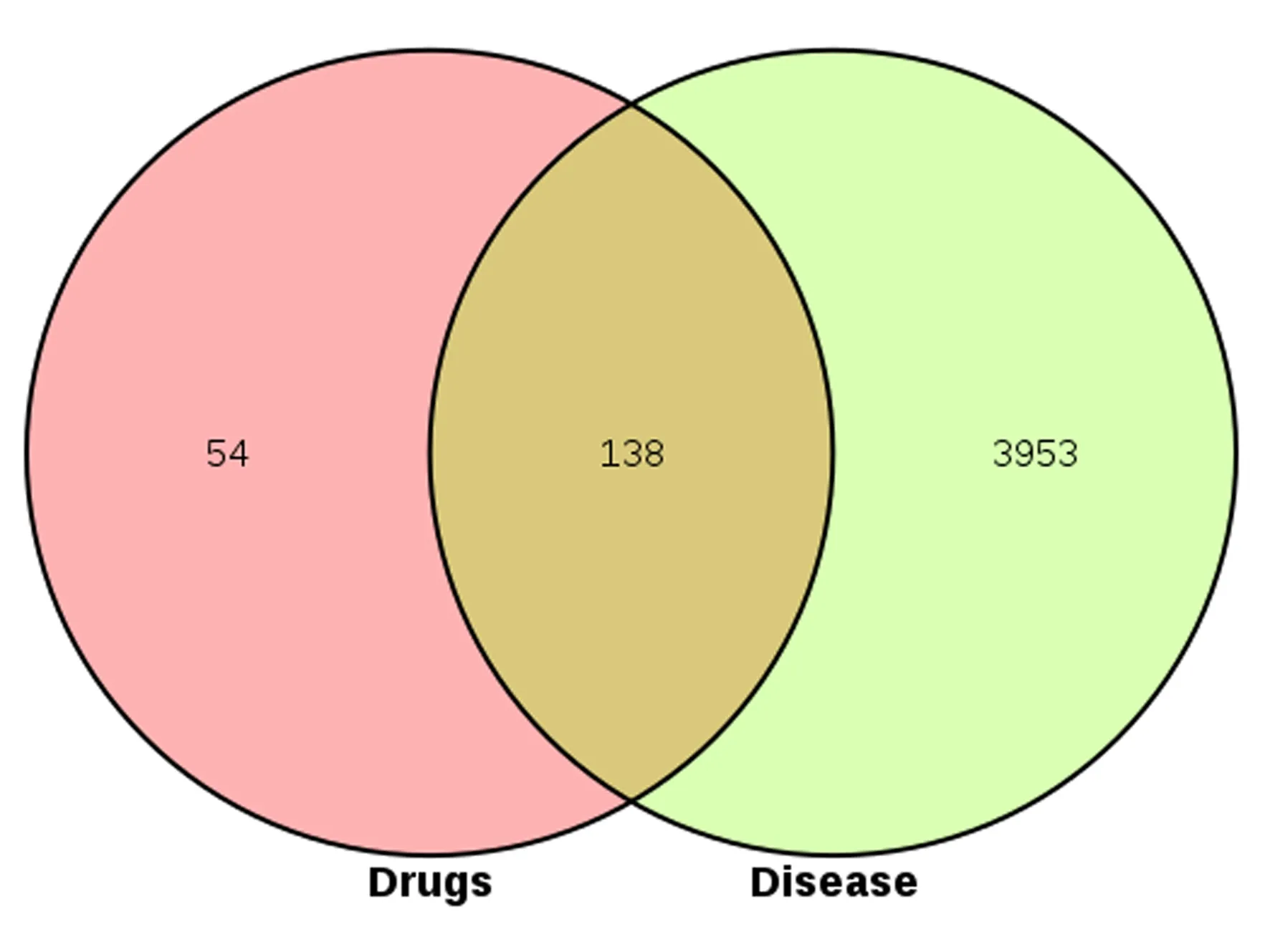
图1 独活-桑寄生和OP的靶点维恩图Fig.1 Target Venn diagram of angelica pubescens radix-loranthaceae and OP
2.2 网络分析结果
网络拓扑参数分析结果中参数节点连接度(degree)和介数中心性(Betweenness Centrality)的数值可表示其在网络中的重要性。本研究筛选节点连接度>均值(7.667)且介数中心性>均值(0.031)的核心成分共3个,分别为Quercetin(槲皮素)、Osthol(蛇床子素)、Psoralen(补骨脂素);筛选节点连接度>均值(1.884)且介数中心性>均值(0.003)的核心靶点共24个,具体信息如表2所示。其中前列腺素内过氧化物合酶2(PTGS2)、前列腺素内过氧化物合酶1(PTGS1)、雌激素受体α(ESR1)、β-2肾上腺素能受体(ADRB2)的关键参数较其他潜在靶点更高,可能为独活-桑寄生治疗OP的关键靶点。根据中药-活性成分-潜在靶点数据构建的PPI网络见如图2,共有179个节点、299条线,其中黄色菱形代表中药,蓝色正方形代表潜在靶点,绿色圆形代表独活-桑寄生的活性成分,节点大小与节点连接度成正比。
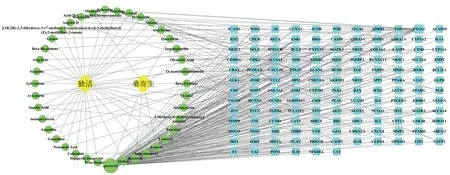
图2 独活-桑寄生治疗OP的中药-活性成分-潜在靶点网络Fig.2 Traditional Chinese medicine-active ingredients-potential target network of angelica pubescens radix-loranthaceae for OP therapy

表1 独活-桑寄生治疗OP的活性成分及相应靶点Table 1 Active components and corresponding targets of angelica pubescens radix-loranthaceae therapy for OP
2.3 GO富集分析和KEGG通路富集
GO富集分析结果以P<0.01,FDR<0.01为筛选条件,可得到生物过程(biological process,BP)2 509条,包括对含氧化合物的反应(response to oxygen-containing compound)、对有机物的反应(response to organic substance)、细胞对化学刺激的反应(cellular response to chemical stimulus)等;分子功能(molecular function,MF)193条,包括对酶结合(enzyme binding)、同一蛋白结合(identical protein binding)、信号受体结合(signaling receptor binding)、蛋白酶结合(protease binding)、细胞因子受体结合(cytokine receptor binding)等;细胞组成(cell composition,CC)113条,包括膜筏(membrane raft)、膜微区(membrane microdomain)、膜区(membrane region)等。GO富集结果制作的高级气泡图中气泡越大代表富集在该条目上的基因个数越多;气泡的颜色越红,表示该条目的P值越小(见图3~5)。KEGG通路富集筛选可得到12条KEGG 通路富集结果,包括肿瘤坏死因子信号通路(TNF signaling pathway)、低氧诱导因子-1信号通路(HIF-1 signaling pathway)、PI3K-Akt信号通路(PI3K-Akt signaling pathway)等。选取前10条绘制成高级气泡图(见图6)。
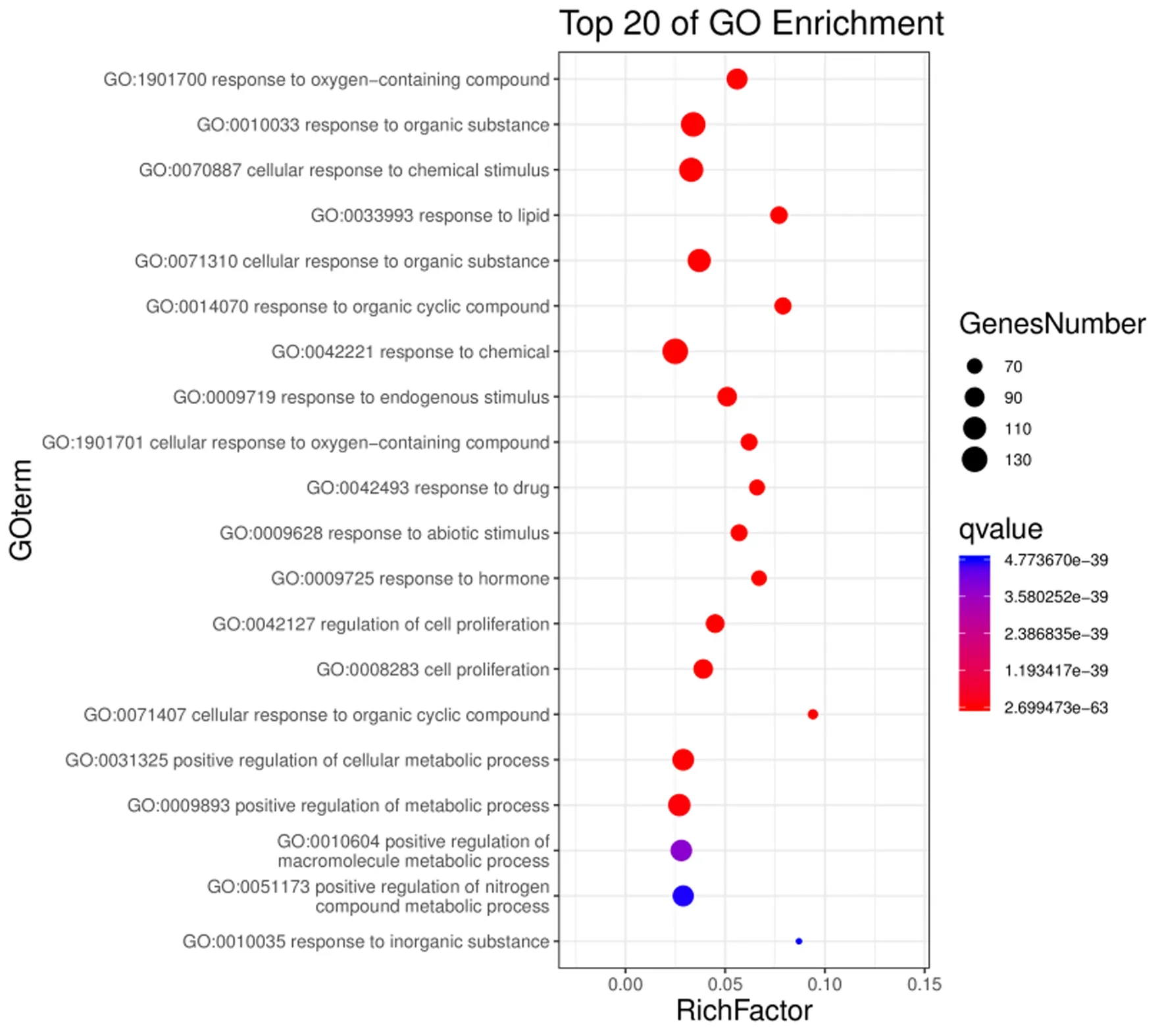
图3 独活-桑寄生治疗OP GO生物过程富集气泡图Fig.3 Bubble chart of GO BP enrichment in the treatment of osteoporosis with angelica pubescens radix-loranthaceae
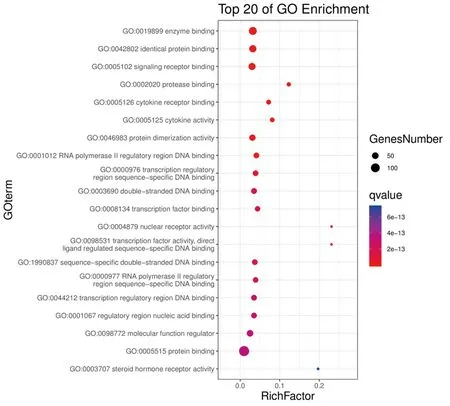
图4 独活-桑寄生治疗OP GO分子功能富集气泡图Fig.4 Bubble chart of GO MF enrichment in the treatment of OP with angelica pubescens radix-loranthaceae
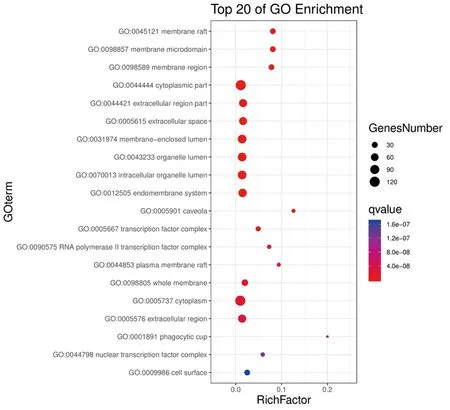
图5 独活-桑寄生治疗OP GO细胞组成富集气泡图Fig.5 Bubble chart of GO CC enrichment in the treatment of OP with angelica pubescens radix-loranthaceae
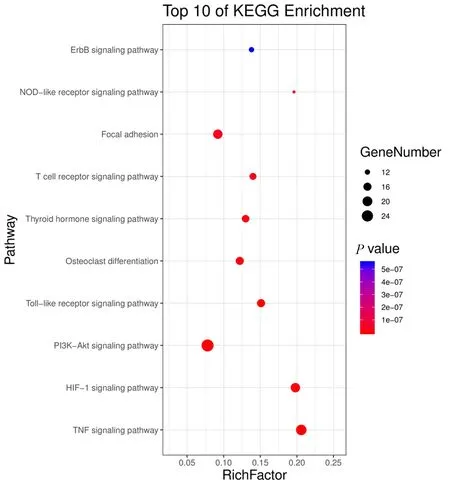
图6 独活-桑寄生治疗OP KEGG通路富集的气泡图Fig.6 Bubble chart of enrichment of KEGG pathway in the treatment of OP with angelica pubescens radix-loranthaceae
3 讨论
骨质疏松症的发病与体内成骨细胞的骨形成和破骨细胞的骨溶解、骨吸收间动态平衡的破坏密切相关[6-7]。研究表明,炎症是导致骨质疏松症的直接因素[8],NF-κB 和JNK的激活,可增强破骨细胞的增殖分化能力[9-10];TNF-α也可导致骨质疏松症,其途径是通过刺激骨髓间充质干细胞诱导形成破骨细胞[11]。氧化应激也可打破成骨细胞和破骨细胞的动态平衡,造成骨质疏松的发生。Li等[12]使用地塞米松处理成骨前体细胞 MC3T3-E 细胞后,发现细胞中 ROS 水平和成骨细胞的凋亡率均显著升高,继而导致骨质疏松的发生。
3.1 核心成分和OP
本研究筛选出核心成分为槲皮素、蛇床子素和补骨脂素。槲皮素是一种多羟基黄酮类化合物,具有抗炎、抗氧化的作用,研究表明[13-14]槲皮素可通过提高巨噬细胞的吞噬功能、影响细胞因子和炎症介质的分泌,达到抗炎的作用。也有研究表明,槲皮素还可通过抑制脂质过氧化、清除ROS,达到减轻氧化应激损伤的作用[15-16]。机体内炎症反应和氧化应激之间存在相互作用,相互影响,槲皮素对其均具有调节作用,进而缓解骨质疏松的发展。郑红等[17]研究发现,槲皮素可通过升高骨形态发生蛋白2(BMP2)的表达,促进成骨细胞分化,从而缓解OP。郝芳卉等[18]、张宇等[19]实验研究表明蛇床子素可通过抑制TNF-α和TLR4/NF-κB 通路的表达,抑制炎性反应。蛇床子素也可通过抑制NF-κB 信号通路的表达,达到下调活化T细胞核因子(NFATc1)等相关转录因子的表达,从而抑制破骨细胞的分化成熟;同时可通过作用于Wnt/β-catenin、内质网应激等信号通路,促进成骨细胞的增殖和分化[20-21]。补骨脂素具有抗炎和抗氧化的作用,研究表明,补骨脂素能显著抑制hPDLCs炎症因子的表达,同时对H2O2诱导的细胞损伤具有保护作用[22-23]。黄奎等[24-25]通过检测小鼠骨质疏松状态下血清I型胶原羧基末端肽水平和股骨生物力学性能,提示补骨脂素可抑制骨吸收,降低骨转化率。
3.2 关键靶点和OP
本研究筛选的关键靶点包括PTGS2、PTGS1、ESR1、ADRB2等。PTGS2和PTGS1分别为PTGS的两种同工酶,具有抗炎和抗氧化的作用。目前研究发现[26],PTGS2参与各种炎性毛细血管后微静脉的通透性、白细胞的趋化作用、T淋巴细胞产生。汤雁利等[27]研究发现康复新可通过降低PTGS2的表达,在巨噬细胞炎症反应中起到抗炎作用。PTGS1在炎症、关节炎疾病和癌症的病理生理进程中起着关键作用[28]。研究表明,药物抑制或基因沉默PTGS1的表达可降低LPS诱导的炎症反应,其机制可能通过负调控NF-κB信号通路起作用[29-30]。ESR1是雌激素受体(ESR)中的一种,存在于成骨细胞、破骨细胞和骨细胞中,雌激素通过与ESR1结合发挥作用。Fatima等[31]研究发现,与野生型小鼠相比,在ESR1敲除雌性小鼠的腹股沟和性腺白色脂肪组织中,促炎细胞因子血管内皮生长因子A(VEGFA)[32-33]的表达降低,提示E2 / ESR1在增强血管生成,减少炎症等功能中具有重要意义。ADRB2表达的β2肾上腺素受体(β2-AR)广泛存在于免疫细胞中。研究发现,在人和鼠的树突状细胞中,刺激 β2-AR 能够激活 NOD2 信号,进而促进 T 细胞分化,并调控相关细胞因子的分泌和炎症反应[34]。
4 结论
基于网络药理学,可预测得到独活-桑寄生中有效成分槲皮素、蛇床子素和补骨脂素等,通过作用于PTGS2、PTGS1、ESR1、ADRB2等靶点,从而影响含氧化合物的反应、对有机物的反应、细胞对化学刺激的反应等生物过程和肿瘤坏死因子、低氧诱导因子-1、PI3K-Akt等信号通路,达到抗炎和抗氧化的作用,进而治疗OP。后期可通过实验对其进行验证,完善基于网络药理学的预测,为明晰其作用机制和药物的推广应用提供更高等级的循证证据。
