生育三烯酚通过激活Wnt/β-catenin信号减少激素诱导骨质疏松大鼠骨量流失
2020-11-23陈光华黄贵芝林瀚吴新诱谭小艳陈周韬
陈光华 黄贵芝 林瀚 吴新诱 谭小艳 陈周韬
广东医科大学附属医院,广东 湛江 524001
骨质疏松是一种以骨量减少、骨微结构受损、骨脆性增加、骨折风险增加为特征的代谢性骨病。据估计,在全世界老年妇女中,与骨质疏松有关的骨折发病率约为40%,在男子中约为13%[1]。糖皮质激素由于其抗炎和免疫抑制作用,在临床上得到了广泛的应用。激素治疗期间骨保护素与核因子受体激活剂κB配体比值的变化导致前3~6个月骨吸收增加,出现骨质疏松的不良反应,骨折风险也明显增加[2]。糖皮质激素引起的骨质疏松(glucocorticoid induced osteoporosis,GIOP)在继发性骨质疏松中居首位。有一些证据显示氧化应激与绝经后骨密度丧失之间的相关性;绝经期雌激素缺乏会增加氧化应激和骨质流失[3]。生育三烯酚 (tocotrienols,TTS)是维生素E的一个亚组,具有4种异构体α、β、γ和δ,在过去的10年中,由于其强大的抗氧化和抗炎特性[4],在包括骨质疏松症在内的慢性病的治疗上获得了极大的关注[5]。有研究表明抗氧化剂对降低大鼠氧化应激和血管细胞黏附分子-1的生成,进一步研究发现抗氧化剂的抗氧化能力可以有效降低氧化应激[6]。由于氧化应激在OP中发挥重要作用,抗氧化剂具有抗氧化作用,然而,其对GIOP的研究目前有限。因此,本研究旨在探讨生育三烯酚对GIOP诱导的骨质疏松大鼠的影响并探索可能的机制。
1 材料和方法
1.1 实验动物和试剂
12周龄雌性SD大鼠30只,体质量(230±15) g,购自上海实验动物中心。生育三烯酚(维克奇;批号: 20190021)。抗酒石酸酸性磷酸酶(TRACP)、Ⅰ型胶原交联羧基末端肽(CTX-I)、碱性磷酸酶(ALP)检测试剂盒和骨钙素(OC)酶联免疫吸附分析(ELISA)试剂盒购自中国上海源业生物技术有限公司。
1.2 实验分组和治疗
动物分组造模,自适应喂养雄性SD大鼠1周。将大鼠随机分为3组,每组10只:对照组(CON组),肌肉注射生理盐水0.1 mL;地塞米松组(DEX组)10只,肌肉注射地塞米松溶液0.1 mL,1 mg/kg(每周2次);连续干预3个月建立GIOP大鼠模型[7]。地塞米松+生育三烯酚组(DEX+TTS组)10例,给予地塞米松溶液0.1 mL,每周2次;同时给予2 mg生育三烯酚灌胃,而其他组给予相同剂量的生理盐水灌胃治疗,直至实验结束。处死前集外周血清和双侧股骨。双侧股骨用生理盐水纱布包裹,置于-20 ℃的冰箱中。
1.3 检测指标
将左侧股骨在室温下解冻并固定在样品架中,使用SCANCOuCT80进行微计算机断层扫描(micro computed tomography,Micro-CT)扫描。该扫描仪的电压为50 kvp,电流为200μA,分辨率为15 μm/像素。骨微结构参数包括骨密度(BMD)、组织骨密度(TMD)、骨小梁数目(Tb.N)、骨小梁厚度(Tb.Th)、骨体积/总体积(BV/TV)、相对骨表面(BS/TV)、骨小梁分离度(TBsp)和连接密度(Conn.D),通过使用内置软件进行定量分析来确定连接密度(connection density,Conn.D)。
待影像学检测完毕后,进行三点弯曲实验。在进行测试时,股骨水平放置在机器的表面上,探头慢慢地放下。加载方向垂直于实验台,作用在骨的中心轴上,加载速度为2 mm/min。通过与试验机连接的计算机专用软件自动记录载荷-位移曲线,得到最大载荷和弹性模量。
将股骨均匀液氮中冷冻并在RIPA缓冲液裂解,然后等份装载(20 mg蛋白质),使用SDS-PAGE(4%堆积,12%流动凝胶在120 V时90~110 min)分离蛋白质。将蛋白质在100 V下转移至0.2 mm的聚偏二氟乙烯膜(目录号162e0177,Bio-Rad实验室,赫拉克勒斯,加利福尼亚)上60 min。使用了以下一抗: BMP-2(1∶2000,Cell Signalling),b-catenin(1∶750,Santa Cruz BT),OPG(1∶500,Santa Cruz BT)和RANKL(1∶500,Santa Cruz BT),然后进行适当处理二抗。化学发光HRP底物检测抗原抗体复合物,并使用LI-COR C-Digit印迹扫描仪进行可视化,并使用相关的Image Studio 5.2软件(LI-COR Biosciences,NE,美国)进行光密度分析。Ponceau S(Biorad)用于控制总蛋白含量,β-actin作内部对照。
随后使用试剂盒检测大鼠血清TRACP、CTX-I、ALP和OC水平,并严格按照生产厂家在试剂盒上的说明进行操作。ELISA试剂盒检测血清TRACP、CTX-I、ALP和OC水平。
1.4 统计学分析
2 结果
2.1 大鼠体重
实验期间未发现大鼠死亡;治疗12周后,大鼠的体重发生变化,DEX组大鼠体重[(436.11±7.87) g]明显低于CON组[(356.44±8.98) g](P<0.05);而DEX+TTS组[(371.29±8.66) g]与DEX组相比,体重无显著差异(P>0.05)。
2.2 Micro-CT分析结果
股骨的二维矢状位图像见图1,股骨的微观参数见表1。DEX组左侧股骨BMD、TMD、Conn.D、Tb.N、Tb.Th、Tb.p、BS/TV较对照组明显降低(P<0.05)。DEX+TTS组左侧股骨BMD、Conn.D、Tb.Th均明显高于DEX组(P<0.05),DEX+TTS组左侧股骨BMD、Conn.D、Tb.Th明显高于DEX组(P<0.05)。
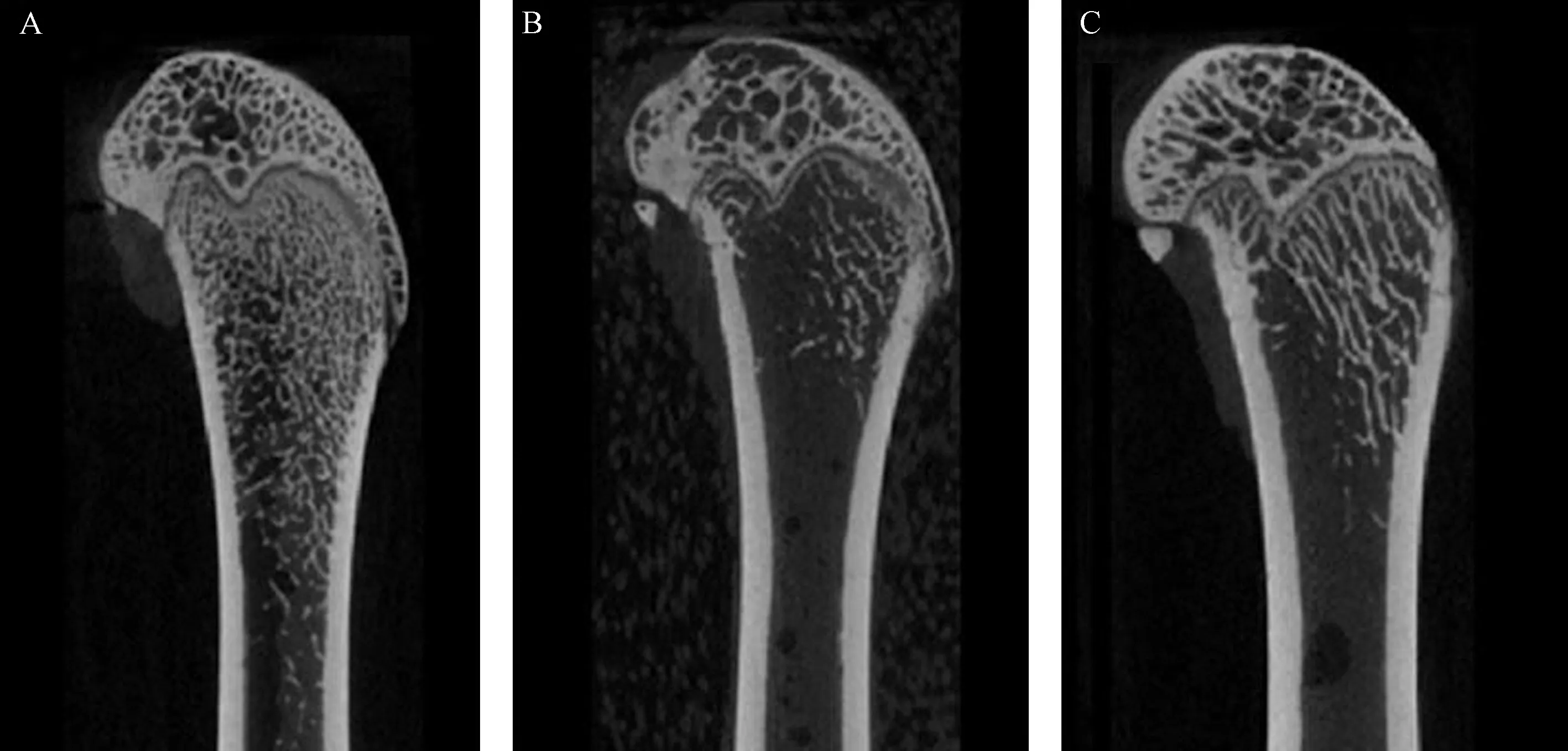
图1 各组大鼠治疗12周后左股骨的Micro-CT二维矢状位图 A:CON组,B:DEX组,C:DEX +TTS组Fig.1 Two-dimensional sagittal images of the left femur in micro-CT after 12 weeks of treatment in each group of rats. A: Con group, B: DEX group, C: DEX+TTS group.
表1 各组大鼠左股骨的Micro-CT检测结果Table 1 Micro-CT results of the left femur of rats in each group
2.3 股骨的生物力学变化
股骨三点弯曲试验表明,DEX+TTS组的最大载荷和弹性模量均高于DEX组,两组间差异有统计学意义(P<0.05)(表2),DEX+TTS组的最大载荷和弹性模量均高于DEX组(P<0.05)。

表2 各组大鼠右股骨的三点弯曲试验结果
2.4 血清ALP、OC、TRACP和CTX-I的变化
与CON组比较,DEX组血清骨形成指标(ALP、OC)显著降低(P<0.05),骨吸收指标TRACP、CTX-I显著升高(P<0.05)。与DEX组比较,DEX+TTS组血清骨形成指标ALP和OC显著升高(P<0.05),骨吸收指标TRACP和CTX-I显著降低(P<0.05)。DEX+TTS组血清ALP和OC显著高于DEX组(P<0.05),而骨吸收指标TRACP和CTX-I则显著低于DEX组(P<0.05),详见表3。

表3 各组大鼠的ALP、CTX-1、OC和ACP结果Table 3 Results of ALP, CTX-I, OC, and ACP of rats in each group
2.5 WB检测结果
股骨BMP-2、OPG和RANKL的表达如图2所示,和CON比较,DEX组大鼠的BMP-2和OPG显著降低,而RANKL表达明显增加;经过TTS干预后,DEX+TTS组大鼠BMP-2和OPG显著增加,而RANKL表达明显降低,比较差异有统计学意义(P<0.05)。
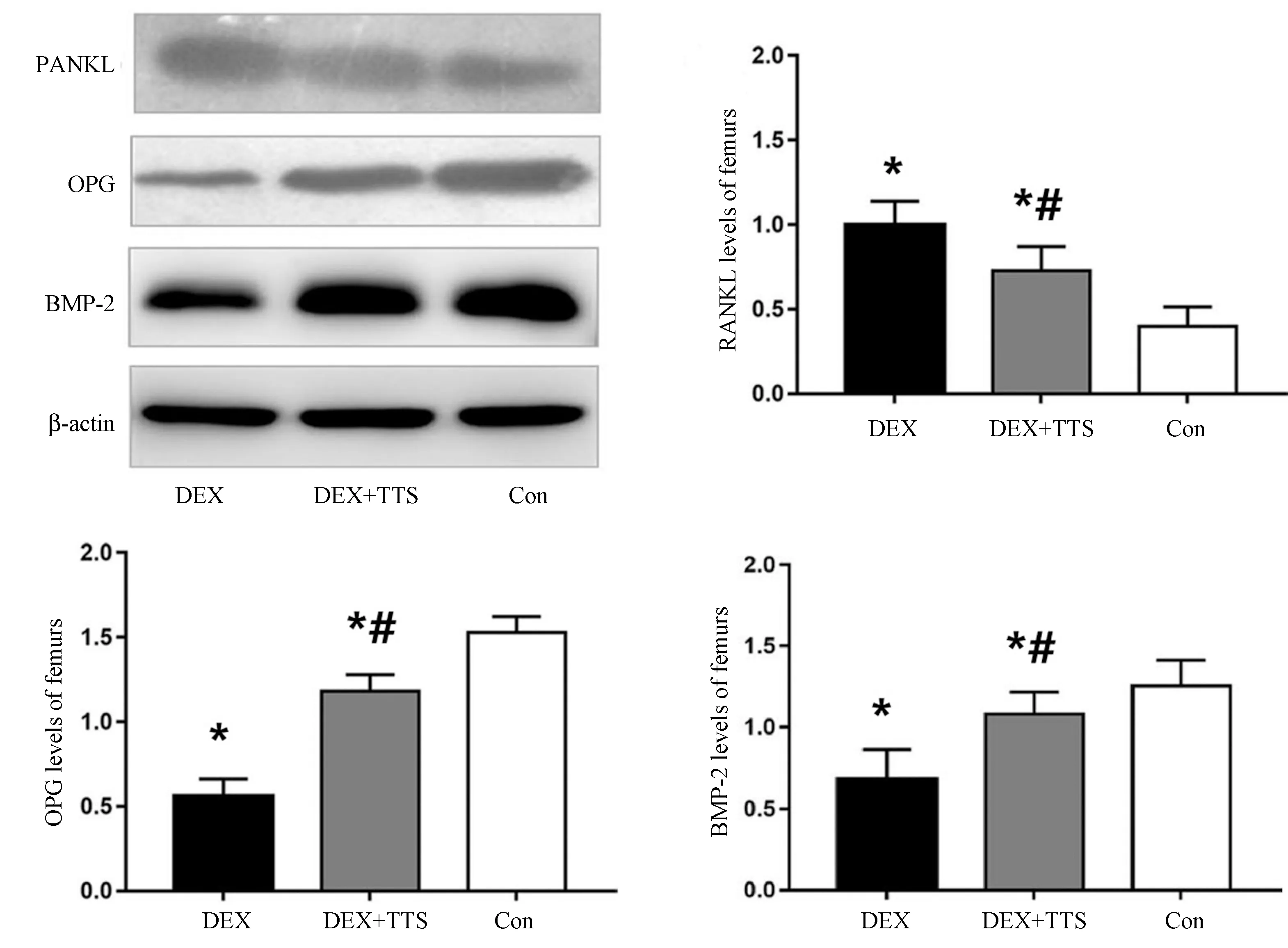
图2 蛋白质印迹定量检测BMP-2、OPG和RANKL蛋白的表达Fig.2 The protein expressions of BMP-2, OPG, and RANKL with quantitative Western blotting.注:与CON组比较,*P<0.05;与DEX组比较,#P<0.05。
3 讨论
骨质疏松症是一种发病率较高的骨代谢性疾病。GIOP在继发性骨质疏松中首位。研究表明,糖皮质激素治疗开始3个月内,脊椎骨折的风险显著增加,12个月时达到高峰。在连续接受GCS治疗的患者中,骨折风险与每日口服GCS剂量密切相关[8]。因此,骨质疏松症越来越受到研究者的关注。
越来越多的证据表明,过多的氧化应激对骨代谢(骨形成<骨吸收)[9]、微结构退变和骨丢失有不利影响,显著增加了骨脆性和骨折易感性[10]。一半的绝经后妇女将经历骨质疏松症导致的骨折[10]。根据世界卫生组织,估计在美国大约有2 200万妇女出现低骨量(称为骨量减少症)和800万妇女有严重的骨质丢失(称为骨质疏松症)[11]。尽管抗骨质疏松症疗法(例如激素疗法、双膦酸盐、甲状旁腺激素)的使用已经被广泛接受,它们在长期使用后的遗传副作用引起了一些关注[11]。因此,寻找替代的天然化合物来缓解绝经后妇女骨恶化和骨丢失的进展已成为一个高度公共卫生优先事项。研究表明,TTS保护成骨细胞免受脂质过氧化和抑制破骨细胞分化,破骨细胞成熟和骨吸收活性通过抑制核因子κB(NF-kB)和细胞外信号调节激酶的激活[12]。这些结果表明TTS可能在抗骨质疏松症领域有着独特的影响。
本研究中使用GCs制备骨质疏松模型,而GCs对大鼠骨量的影响依赖于大鼠的年龄[13]和GC给药的剂量方案[14]。本研究发现DEX组大鼠的体重显著低于CON组。本研究结果与先前研究[14-15]的结果类似,已知用地塞米松治疗成年雌性大鼠(大约3个月)可在治疗期间诱导体重和食物摄入显著减少。在本研究中,使用Micro-CT发现DEX组大鼠股骨的骨密度显著下降,表明建模是成功的。用TTS治疗GIOP大鼠后,BV/TV、Tb.N、Tb.Th和Conn.D与DEX组相比呈增加趋势,表明骨小梁的微观结构得到改善。骨生物力学中的骨结构力学指标测试是了解骨质疏松性骨折风险的最直接方法,它也是骨强度、骨骼结构和骨量的综合表现。然而,观察骨组织形态学和单独测量骨密度不能完全反映骨质量。使用机械性质的干预效果的评估是治疗骨质疏松症的其他方法不可替代的。在本研究中,三点弯曲试验表明,DEX组的最大载荷和弹性模量显著低于对照组,TTS治疗可显著提高大鼠骨组织的抗折强度。这些发现与先前研究的结果相似,即缺乏GLP-1受体的大鼠的骨生物力学指标显著下降[16]。血清CTX-I是骨骼中I型胶原的降解产物,检测血清CTX-I含量可以特异性地反映破骨细胞的吸收活性。TRACP主要由破骨细胞释放的非胶原蛋白产生,破骨细胞与胶原代谢物一起分泌在细胞外。因此,TRACP和CTX-1水平与骨吸收呈正相关。成骨细胞可以分泌骨特异性ALP,ALP是总ALP的重要组成部分,可以反映骨形成的状态。OC是骨基质中最丰富的标志物,其由成骨细胞释放到细胞外,反映骨形成的状态。此外,骨形成标志物包括OC、ALP和胶原蛋白1的表达也显著增加。本研究的结果表明TTS可增加成骨细胞活性来促进GIOP大鼠的骨形成来保护骨组织。
经典的Wnt/β-catenin信号传导途径是众所周知的合成代谢级联反应,可促进成骨细胞的增殖,成骨细胞的分化以及成骨细胞产生骨保护素(OPG)的作用[17]。OPG是核因子κB配体(RANKL)受体激活剂的诱饵受体,RANKL是破骨细胞生成的关键激活剂[17]。因此,激活经典的Wnt/β-catenin信号传导途径可导致骨骼中OPG/RANKL比率增加,并使平衡朝成骨细胞生成倾斜,最终转移骨骼更新,有利于骨骼形成而不是骨骼吸收[17]。本研究通过WB检测骨组织BMP-2、OPG和RANKL的表达,结果发现TTS治疗后的大鼠骨组织BMP-2和OPG表达显著增加,而RANKL的表达显著降低,这表明TTS治疗后可以激活Wnt/β-catenin信号来促进成骨;OC、ALP和胶原蛋白1水平显著增加更好地体现这点。
本研究有其局限性,首先本研究TTS剂量比较单一,需要考虑剂量对结果的影响;其次,本研究使用的激素诱导的骨质疏松模型,是否适合其他因素诱导的骨质疏松症模型就不得而知;最后就是研究设计的时间较短,大鼠数量也较少。
总之,TTS可以通过减少骨吸收和促进骨形成及激活Wnt/β-catenin信号来改善骨密度、骨微观结构和骨强度以及治疗GIOP。
