人参皂苷酶III型转化制备人参稀有皂苷Gyp17和Gyp75
2020-11-23庄子瑜刘春莹李秋宏李鹏飞徐龙权鱼红闪
庄子瑜,刘春莹,李秋宏,李鹏飞,徐龙权,鱼红闪*
1(大连大学 生命科学与技术学院,辽宁 大连,116622)2(大连工业大学 生物工程学院,辽宁 大连,116034) 3(大连市检验检测认证技术服务中心,辽宁 大连,116021)
人参的主要活性成分为皂苷,目前从人参中已经发现超过150种人参皂苷[1],其中最主要的皂苷是Rb1,其质量分数分别占人参总皂苷的20%、西洋参总皂苷的38%和三七总皂苷的23%[2]。人参皂苷Rb1具有抗氧化、抗心率失常、保护神经、降血糖、提高免疫力和抗癌等作用[3~10]。很多研究表明,人参皂苷活性与皂苷分子糖基数量密切相关,皂苷糖基数量越多,其活性越低;而糖基较少的稀有人参皂苷则具有更高的生理活性[11-14]。人参皂苷Rb1分子带3-O-Glc-Glc-糖基和20-O-Glc-Glc-糖基等4个糖基,因此,Rb1药理活性低于带3个糖基的稀有皂苷Gyp17,更低于带2个糖基的稀有皂苷Gyp75[3,15]。然而,白参中几乎不含稀有皂苷Gyp17和Gyp75[3,15];绞股蓝中含有少量的稀有皂苷Gyp17和Gyp75,但从中分离稀有皂苷Gyp17和Gyp75,操作繁琐且收率低[16]。因此,利用人参中含量高的Rb1皂苷,通过酶转化制备Gyp17和Gyp75稀有皂苷,对开发人参成分的保健食品、化妆品和药物具有重要意义。
为了利用人参中含量高的低活性Rb1皂苷得到高活性稀有皂苷,本课题组利用黑曲霉的人参皂苷酶I型,对Rb1等人参二醇类皂苷进行酶转化,其主要产物为人参稀有皂苷C-K和少量F2,不产Gyp17和Gyp75稀有皂苷[17];利用从微生物中得到的α-L-鼠李糖苷酶,尝试酶转化绞股蓝皂苷,该酶只能将绞股蓝皂苷-5转化为人参皂苷Rd,不产Gyp17和Gyp75稀有皂苷[17]。本课题组又与韩国林完泽教授团队合作,从Terrabacterginsenosidimutans中得到人参皂苷酶基因(bgpA:1 947 bp),在Escherichiacoli中克隆表达,得到转基因酶,其分子质量为72 kDa;该酶能水解Rb1和Rb2等人参二醇皂苷的3-O-葡萄糖基,转化为Gyp17和Gyp75、C-O和C-Y等稀有皂苷,将其命名为人参皂苷酶III型[18-20]。
本文利用上述E.coli克隆表达的人参皂苷酶III型,以人参中含量高的皂苷Rb1为底物,酶转化高效制备稀有皂苷Gyp17和Gyp75,为人参成分的保健食品、化妆品和药物提供新原料稀有人参皂苷,也为其产业化提供依据。
1 材料与方法
1.1 实验材料
人参皂苷Rb1、人参皂苷标准品C-Mc1和C-Mc,大连三参生物科技有限公司;薄层色谱(tthin-layer chromatography,TLC)硅胶板Silica gel 60-F254,德国Merck 公司;AB-8大孔树脂、D-280大孔树脂,天津南开大学试剂厂;Shimadzu CS-930薄层扫描仪,日本Shimadzu公司。Waters 2695 高效液相色谱分析仪,Waters 2996二极管阵列检测器及Empower 色谱工作站,美国Waters 公司;Unitary C18色谱柱(250 mm×4.6 mm,5 μm),华谱创新科技有限公司。
T.ginsenosidimutans的bgpA基因在E.coli细胞克隆表达得到的人参皂苷酶III型的酶原体冻干粉[17-18],本实验室保存。
1.2 实验方法
1.2.1 克隆酶原体的处理及酶液制备
人参皂苷酶III型基因(bgpA)在E.coli细胞表达得到200 mg人参皂苷酶III型克隆酶原体冻干品粉末,将其与14.4 g尿素、10 μL巯基乙醇和0.02 mol/L、pH 7.0的30 mL磷酸缓冲液混合,在室温下振荡2 h、使固体酶回复酶蛋白空间结构,再加入1.2 L(含有体积分数5%甘油、0.5 g/L聚乙二醇、体积分数0.003 7%巯基乙醇、0.08 g/L NaCl)0.02 mol/L、pH 7.0的磷酸缓冲液混合均匀,即为人参皂苷酶III型酶液,在4 ℃保存待用。
1.2.2 pH和温度的确定
用pH为5.0、6.0、7.0、7.5和8.0的0.06 mol/L磷酸缓冲液和pH为5.0、6.0、7.0和7.5的0.06 mol/L和醋酸缓冲液,分别配制成10 g/L人参皂苷Rb1溶液,分别取0.1 mL与等体积酶液混合,37 ℃反应3 h,分别加入0.2 mL饱和正丁醇水溶液终止反应;取上层饱和正丁醇水层,用TLC方法检测Rb1皂苷转化,确定最佳pH。
用pH 7.0或7.5的0.02 mol/L的磷酸缓冲液配制成10 g/L人参皂苷Rb1溶液,取0.1 mL分别与等体积酶液混合,分别在37、45、50和65 ℃反应6 h,再分别加入0.2 mL饱和正丁醇水溶液终止反应,取上层饱和正丁醇水层,用TLC方法检测Rb1皂苷转化情况,确定最佳温度。
1.2.3 底物质量浓度和反应时间的确定
取0.1 mL的pH 7.0 0.02 mol/L磷酸盐缓冲液分别配制成质量浓度为10、20、50和100 g/L的底物Rb1溶液,分别与等体积酶液混合(最终Rb1质量浓度分别为5、10、25和50 g/L),37 ℃反应24 h,再分别加入0.2 mL饱和正丁醇水溶液终止反应,用TLC检测Rb1皂苷转化情况,确定最佳底物质量浓度。
6 g/L Rb1的0.02 mmol/L pH 7.0磷酸缓冲液与等体积酶液混合,在37 ℃分别反应3、12、24、42和60 h,按不同反应时间取0.1 mL反应液,分别加入0.2 mL饱和正丁醇水溶液终止反应,通过TLC或高效液相色谱仪(high performance liquid chromatography,HPLC)检测Rb1转化情况,确定最佳反应时间。
1.2.4 酶转化制备稀有皂苷Gyp17和Gyp75
稀有皂苷Gyp17的制备:40 g/L人参皂苷Rb1(溶于0.02 mol/L、pH 7.0的磷酸缓冲液)与等体积酶液混合(最终Rb1质量浓度为20 g/L),37 ℃搅拌反应24 h;经TLC检测,人参皂苷Rb1完全转化为Gyp75;然后用人参皂苷Rb1质量的25倍体积的AB-8大孔树脂柱(固液比为1 g∶25 mL)反复吸附皂苷,用6倍柱体积的去离子水洗去糖类、蛋白等杂质;再用6倍柱体积的80%(体积分数)乙醇洗脱皂苷;其洗脱液再经AB-8大孔树脂柱等体积的大孔离子树脂D-280柱脱色,其D-280柱中再加少量的80%(体积分数)乙醇洗脱残留的皂苷。其乙醇洗脱液通过过滤、减压浓缩至20 mL,冷却沉淀产物,过滤,沉淀物用少量冰冷的50%(体积分数)乙醇洗涤,减压干燥得产物皂苷Gyp17;其母液在常温下自然挥发(经常摇晃)沉淀产物,并重复多次,收集沉淀物,即得到Gyp17单体。
稀有皂苷Gyp75的制备:10 g/L人参皂苷Rb1(溶于0.02 mol/L、pH 7.0的磷酸缓冲液)与等体积酶液混合,37 ℃搅拌反应60 h;然后上样于人参皂苷Rb1质量的25倍体积的AB-8大孔树脂柱(固液比为1 g∶25 mL),反复吸附皂苷,用6倍柱体积的去离子水洗去糖类、蛋白等杂质;再用6倍柱体积的80%(体积分数)乙醇洗脱皂苷;其洗脱液再经AB-8大孔树脂柱等体积的大孔离子树脂D-280柱脱色,其D-280柱中再加少量的80%(体积分数)乙醇洗脱残留的皂苷。其乙醇洗脱液,过滤,减压浓缩,干燥得Gyp17和Gyp75混合皂苷;其产物用硅胶柱法分离,得到Gyp17和Gyp75单体。
硅胶柱层析法:将分离所得Gyp17和Gyp75混合皂苷用甲醇和少量氯仿溶解,加入2.5倍样品质量的80~100目硅胶不断搅拌,再经水浴蒸干,即为样品胶。装硅胶柱,取20倍Gyp17和Gyp75混合皂苷样品质量的300~400目硅胶作为分离胶慢慢装入玻璃柱内,铺放均匀,抽真空,上层放2~3 mm脱脂棉,其脱脂棉商标放入上述样品胶。其硅胶柱先用纯氯仿通柱,接着用少量的氯仿与甲醇体积比分别为9.5∶0.5、9∶1、8.5∶1.5和8∶2的洗脱液通柱。然后用氯仿、甲醇和水的体积比为7∶3∶0.1的洗脱液,逐步洗脱硅胶柱上的皂苷,每瓶收集80~150 mL,洗脱至没有Gyp75皂苷为止,TLC检测,分别合并Gyp17和Gyp75皂苷瓶,减压浓缩,蒸干,分别得到Gyp17和Gyp75皂苷的白色粉末。
1.2.5 TLC方法测定人参皂苷含量
用毛细管吸取人参皂苷标准品或样品溶液,在TLC板上点样、吹干,放入盛有展开剂的层析缸中封口展开,展开剂为氯仿-甲醇-水(体积比7∶3∶0.5)。展开结束后,用体积分数10% H2SO4溶液加热110 ℃显色。利用Shimadzu CS-930 薄层扫描仪,扫描TLC板上的人参皂苷斑点,测定各人参皂苷的含量比例。
1.2.6 HPLC方法测定皂苷
流动相为乙腈-水;洗脱程序:0~20 min,20%乙腈(等梯度);20~31 min,20%~32%乙腈(线性梯度);31~40 min,32%~43%乙腈(线性梯度);40~70 min,43%~100%乙腈(线性梯度);进样量10 μL;柱温35 ℃;体积流量0.6 mL/min;检测波长203 nm;柱效78 000 塔板/m。
2 结果与分析
2.1 人参皂苷酶III型与人参皂苷Rb1的反应
为了解T.ginsenosidimutans人参皂苷酶III型基因(bgpA)在E.coli细胞表达得到的转基因人参皂苷酶III型与人参皂苷Rb1的反应产物,取0.2 mL 20 g/L的Rb1溶液与等体积的该酶混合(最终Rb1质量浓度为10 g/L),准备3份,37 ℃分别反应6、16和48 h;分别加入0.4 mL饱和正丁醇水溶液终止反应,离心,分别取0.1 mL正丁醇层,吹干,分别溶解于1 mL甲醇中,用HPLC方法测定反应液中的皂苷,如图1-a所示。
由图1-a可知,10 g/L的人参皂苷Rb1酶反应6 h,40%以上的Rb1转化为Gyp17;反应16 h,大部分Rb1转化为Gyp17和Gyp75皂苷;当反应40 h时,Rb1皂苷全部水解成Gyp17和Gyp75皂苷,说明该人参皂苷酶III型的反应过程为:先水解人参皂苷Rb1的3-O-末端D-葡萄糖基生成稀有皂苷Gyp17;进一步水解Gyp17的3-O-D-葡萄糖基生成稀有皂苷Gyp75,如图1-b所示。

a-不同酶反应时间人参皂苷Rb1的酶解产物的HPLC图;b-人参皂苷酶III型水解Rb1反应式图1 人参皂苷酶III型水解Rb1的反应Fig.1 Ginsenoside Rb1 hydrolysis by cloning ginsenosidase type-III注:1-Rb1反应6 h的酶解产物;2-Rb1反应16 h的酶解产物;3-Rb1反应40 h的酶解产物
2.2 pH和温度对酶反应的影响
用pH 5.0、6.0、7.0、7.5和8.0的0.05 mol/L磷酸缓冲液,pH 5.0、6.0、7.0和7.5的0.05 mol/L醋酸缓冲液,分别配制成10 g/L人参皂苷Rb1溶液,取0.1 mL分别与等体积酶液混合,37 ℃反应12 h后,分别加入0.2 mL饱和正丁醇水溶液终止反应,取上层饱和正丁醇水层用TLC检测,结果如图2所示。展开剂:氯仿、甲醇和水体积比为7∶3∶0.5,以体积分数10% H2SO4溶液为显色剂在110 ℃显色。
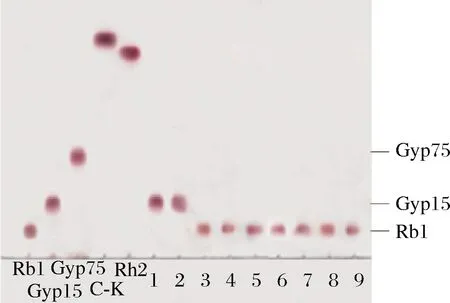
Rb1、Gyp17、Gyp75、C-K和Rh2,人参皂苷标准品;1~5,分别为pH7.5、7.0、5.0、6.0和8.0的磷酸缓冲液反应产物;6~9,分别为pH 5.0、6.0、7.0和7.5的醋酸缓冲液反应产物图2 不同pH缓冲液对Rb1酶反应影响的TLC图Fig.2 Different pH effects on Rb1 enzyme reaction by TLC
由图2可知,该酶转化Rb1皂苷只有在pH 7.0和7.5的磷酸缓冲液中反应;而在pH 5.0、6.0和8.0的磷酸缓冲液或pH 5.0、6.0、7.0和7.5的醋酸缓冲液中,该酶几乎不水解人参皂苷Rb1。因此,该酶水解Rb1 的最佳pH为7.0和7.5的磷酸缓冲液。
温度的影响:用pH 7.0或7.5的0.02 mol/L的磷酸缓冲液配制成10 g/L人参皂苷Rb1溶液,其0.1 mL分别与等体积酶液混合,在37、45、50和65 ℃分别反应6 h,分别加入0.2 mL饱和正丁醇水溶液终止反应,取上层饱和正丁醇水层用TLC检测,结果如图3所示。展开剂:氯仿、甲醇和水体积比为7∶3∶0.5,以体积分数10% H2SO4溶液为显色剂在110 ℃显色。
由图3可知,该酶在37和45 ℃时,水解Rb1皂苷较好;在50和60 ℃时Rb1的水解反应较差,因此,其最佳反应温度为37和45 ℃。

Rb1、Gyp17、Gyp75、C-K和Rh2,人参皂苷标准品;5 g/L Rb1在pH 7.0、不同温度下分别反应6 h:1-37 ℃反应产物;2-45 ℃反应产物;3-反应50 ℃反应产物;4-60 ℃反应产物图3 不同温度对Rb1酶反应影响的TLC图Fig.3 Enzymatic reaction in different temperature by TLC
总之,通过E.coli克隆表达的人参皂苷酶III型水解Rb1皂苷的最佳温度为37和45 ℃,最佳pH为7.0和7.5的磷酸缓冲液。
2.3 底物质量浓度与时间对酶反应的影响
底物浓度对酶反应的影响:分别取0.1 mL的10、20、50和100 g/L的底物Rb1的pH 7.0、0.02 mol/L磷盐缓冲液与等体积酶液混合(最终Rb1质量浓度为5、10、25和50 g/L),37 ℃反应24 h,再分别加入0.2 mL饱和正丁醇水溶液终止反应,取上层饱和正丁醇水层用TLC检测,结果如图4所示。展开剂:氯仿、甲醇和水体积比为7∶3∶0.5,以体积分数10% H2SO4溶液在110 ℃显色。

Rb1、Gyp17、Gyp75、C-K和Rh2,人参皂苷标准品;不同浓度的Rb1与酶液在37 ℃下反应24 h的产物:1-50 g/LRb1的反应产物;2-10 g/L Rb1的反应产物;3-25 g/L Rb1的反应产物;4-50 g/L Rb1的反应产物图4 不同Rb1底物质量浓度对酶反应影响TLC图Fig.4 Effect of Rb1 concentration on enzymatic reaction by TLC
由图4可知,5 g/L的Rb1皂苷酶反应24 h,Rb1几乎全部转化为稀有皂苷Gyp17 和Gyp75;10和25 g/L的Rb1皂苷酶反应24 h,Rb1几乎全部转化为稀有皂苷Gyp17;50 g/L的Rb1皂苷酶反应24 h,部分Rb1皂苷转化为Gyp17。因此,从Rb1皂苷制备Gyp17,10和25 g/L的Rb1皂苷,酶反应24 h即可;要制备Gyp75皂苷,5 g/L的Rb1皂苷,酶转化时间需超过24 h。
反应时间对酶反应的影响:6 g/L Rb1的0.02 mmol/L pH 7.0磷酸缓冲液与同体积酶液混合(最终Rb1质量浓度为3 g/L),在37 ℃下分别反应3、12、24、42和60 h,按不同时间分别取0.1 mL反应液,加入0.2 mL饱和正丁醇水溶液终止反应,取上层饱和正丁醇水层用TLC检测,结果如图5所示。展开剂:氯仿、甲醇和水体积比为7∶3∶0.5,以体积分数10% H2SO4为显色剂溶液在110 ℃显色。
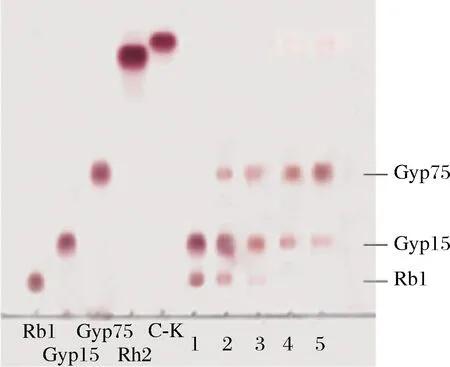
Rb1、Gyp17、Gyp75、C-K和Rh2,人参皂苷标准品;1-Rb1反应3 h酶反应产物;2-12 h酶反应产物;3-24 h酶反应产物;4-42 h酶反应产物;5-60 h酶反应产物图5 反应时间对Rb1皂苷酶反应的影响TLC图Fig.5 Reaction time effect on ginsenoside Rb1 enzyme reaction by TLC
由图5可知,3 g/L的Rb1酶反应3和6 h,部分Rb1水解成Gyp17;反应24 h,Rb1几乎全部反应成Gyp17和少量的Gyp75;反应42 h,逐渐增加产物Gyp75;反应60 h,主要产物为Gyp75。
根据上述结果,以Rb1酶转化制备Gyp17,10和25 g/L的Rb1 37 ℃酶反应24 h为最佳条件;要从Rb1酶转化制备Gyp75,5 g/L的Rb1 37 ℃酶反应时间超过40 h。按此条件,制备如下Gyp17和Gyp75单体皂苷。
2.4 酶转化制备Gyp17和Gyp75
Gyp17皂苷的制备:在250 mL三角瓶中加入4 g Rb1(3.6 mmol/L)和100 mL 0.02 mol/L pH 7.0的磷酸钠盐缓冲液混合,再加入100 mL酶液混和均匀(最终Rb1质量浓度为20 g/L),封口,37 ℃摇床反应24 h,经TLC检测,人参皂苷Rb1完全转化为Gyp75;然后在直径30 mm的150 mL 大孔树脂AB-8柱上反复吸附皂苷,用900 mL去离子水洗去糖类、蛋白等杂质;用900 mL的80%(体积分数)乙醇洗脱AB-8,经TLC检测无皂苷为止;其洗脱液再经直径30 mm的150 mL 大孔离子树脂D-280柱脱色,其D-280柱中再加200 mL的80%(体积分数)乙醇洗脱残留的皂苷;其乙醇洗脱液,过滤、减压浓缩至20 mL,冷却沉淀产物,过滤,沉淀物用少量冰冷的50%(体积分数)乙醇洗冻,减压干燥得产物皂苷Gyp17;其母液在常温下自然挥发(经常摇晃)沉淀产物,重复几次收集沉淀干燥得Gyp17;共得到3.1 g稀有皂苷Gyp17(3.27 mmol/L)单体。与标准品Gyp17皂苷相比,经HPLC检测(图6),所得到Gyp17皂苷单体纯度超过90%;Gyp17理论的摩尔得率为90.8%。

图6 由Rb1酶转化制备的稀有皂苷Gyp17和Gyp75单体HPLC图Fig.6 The HPLC of ginsenoside Gyp17 and Gyp75 from Rb1 by enzyme reaction
Gyp75皂苷的制备:取4 g Rb1(3.6 mmol/L)溶于400 mL 0.02 mol/L pH 7.0的磷酸钠盐缓冲液中,分成4份放入250 mL三角瓶中,分别加入100 mL酶液(最终Rb1质量浓度为50 g/L),封口,在37 ℃摇床反应60 h,合并反应液,经TLC和HPLC检测,反应产物中Gyp17和Gyp75峰面积比为19∶81。合并的反应液,在直径30 mm的150 mL 大孔树脂AB-8柱上反复吸附皂苷,用900 mL去离子水洗去糖类、蛋白等杂质;用900 mL的80%(体积分数)乙醇洗脱AB-8,经TLC检测无皂苷为止;其洗脱液再经直径30 mm的150 mL大孔离子树脂D-280柱脱色,其D-280柱中再加200 mL的80%(体积分数)乙醇洗脱残留的皂苷;其乙醇洗脱液,过滤、减压浓缩、干燥得2.7 g Gyp17和Gyp75混合皂苷;其产物用硅胶柱法分离的Gyp17得Gyp75单体。
将所得的2.7 g混合皂苷产物,用甲醇和少量氯仿溶解,加入6.5 g 80~100目硅胶,在水浴中搅拌干燥得样品胶,放入预先准备好的60 g 300~400目硅胶柱的上部,用纯氯仿、含少量甲醇的氯仿通开硅胶柱,然后用氯仿∶甲醇∶水体积比为7∶3∶0.1的洗脱液洗脱硅胶柱上所吸附的皂苷,每瓶收集80 mL洗脱液,一直洗脱完Gyp75。所收集的洗脱液瓶经TLC检测,分别合并Gyp75洗脱液瓶和Gyp17洗脱液,浓缩,蒸干,分别得到2.1 g Gyp75单体(2.67 mmol/L)和0.45 g Gyp17单体(0.47 mmol/L);经HPLC检测(图6),所得到Gyp75和Gyp17皂苷单体纯度均为90%;Gyp75的Gyp17的摩尔得率分别为74.2%和13.1%。由此,由低活性人参皂苷Rb1成功地制备了人参稀有皂苷Gyp17和Gyp75单体。
3 结论
T.ginsenosidimutans的bgpA基因,在E.coli细胞表达得到的人参皂苷酶III型,能水解人参皂苷Rb1的3-O-末端D-葡萄糖基生成稀有皂苷Gyp17;进一步水解Gyp17的3-O-D-葡萄糖基生成稀有皂苷Gyp75。该酶水解Rb1皂苷最佳温度为37和45 ℃,最佳pH为7.0和7.5的磷酸缓冲液。从Rb1酶转化制备Gyp17的最佳反应条件是在10和25 g/L Rb1皂苷的pH 7.0和7.5的磷酸缓冲液中37 ℃酶反应24 h;若要制备Gyp75,5 g/L Rb1在37 ℃酶反应时间超过40 h。
将20 g/L 的人参皂苷Rb1在37 ℃酶应24 h,从4 g Rb1制备了3.1 g稀有皂苷Gyp17,其摩尔得率为90.8%。将5 g/L的人参皂苷Rb1 37 ℃酶反应60 h,从4 g Rb1制备了2.1 g的Gyp75和Gyp17单体和0.45 g的Gyp17单体;Gyp75的摩尔得率分别为74.2%和13.1%。
由此,利用转基因人参皂苷酶III型,从人参皂苷Rb1成功地制备了稀有皂苷Gyp75和Gyp17单体,为其产业化提供了依据。
