枯草芽孢杆菌Nr.5和底物添加促进酱油中吡嗪类物质合成
2020-11-23张丽杰张怀志徐岩
张丽杰,张怀志,徐岩*
1(工业生物技术教育部重点实验室(江南大学),江苏 无锡,214122) 2(江南大学 生物工程学院,江苏 无锡,214122)
酱油是以黄豆(豆粕)和面粉(烤小麦)为主要原料,经微生物发酵形成的香气浓郁、富含营养的一类基础调味品,被广泛用于亚洲人民的食物烹饪[1-3]。吡嗪是一类在1,4位含氮的六元杂环化合物,通常以极低的阈值呈现焙烤、坚果香气,是酱油中一类重要的风味化合物[4-6]。目前为止,在酱油中被检测出的吡嗪化合物有47种,其中,有14种吡嗪在酱油中被认定为有香气贡献,占吡嗪种类的30%[7]。我国酱油制作工艺及香气独特,研究者在我国酱油中共发现了12种具有风味贡献的吡嗪化合物,分别为2-甲基吡嗪、2,5-二甲基吡嗪(2,5-dimethylpyrazine, 2,5-DMP)、2,6-二甲基吡嗪(2,6-dimethylpyrazine, 2,6-DMP)、2,3,5-三甲基吡嗪(2,3,5-trimethylpyrazine, 2,3,5-TMP)、2-乙基-6-甲基吡嗪、2-乙基-3,5-二甲基吡嗪(2-ethyl-3,5-dimethylpyrazine, 3,5-EDMP)、2-乙基-3,6-二甲基吡嗪(2-ethyl-3,6-dimethylpyrazine, 3,6-EDMP)、2,3-二乙基-5-甲基吡嗪、2-异戊基-6-甲基吡嗪、2-异戊基-3,6-二甲基吡嗪、2-乙烯基吡嗪及2-乙烯基-6-甲基吡嗪[1, 8-10](图1)。除风味贡献,一些吡嗪化合物还被证明具有健康及药用价值[11-12]。在酱油品质提升计划中,如何理性提高酱油中吡嗪化合物的种类及浓度一直是研究者面对的共性问题。
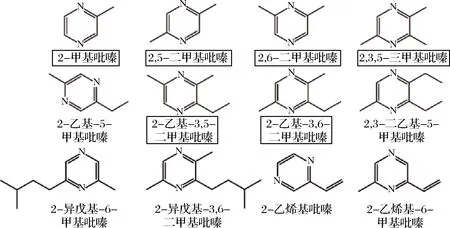
图1 中国酱油中具有风味贡献的吡嗪化合物结构Fig.1 Fla or contribution pyrazines in Chinese soy sauce注:方框圈出的吡嗪为本研究通过发酵剂及底物添加实现质量浓度提升的吡嗪化合物
吡嗪化合物结构复杂且合成途径多样,目前仅有少数吡嗪化合物合成途径得到解析[4]。2010年,JEROEN等[13-14]通过基因敲出手段,推测出2,3,5,6-四甲基吡嗪(2,3,5,6-tetramethylpyrazine, 2,3,5,6-TTMP)的微生物合成途径。2019~2020年,本课题组通过微生物筛选、基因敲除与回补、多组合同位素示踪等技术,相继解析出了2,5-DMP、2,3,5-TMP、3,5-EDMP及3,6-EDMP的微生物合成机制[15-16]。通过对已解析的吡嗪微生物合成机制进行分析,发现如上烷基吡嗪的合成微生物为枯草芽孢杆菌(Bacillussubtilis),合成底物为廉价可得的L-苏氨酸和/或D-葡萄糖。枯草芽孢杆菌为生物安全菌株, 且天然存在于酱油发酵体系[2, 17]。因此,将高产吡嗪的枯草芽孢杆菌作为发酵剂加入到酱油发酵体系,并合理添加发酵底物,将有潜力实现酱油中吡嗪种类及浓度的有效提升。
本研究前期筛选得到了1株来源于传统发酵食品的、可合成7种烷基吡嗪的枯草芽孢杆菌。在此基础上,构建模拟酱油发酵体系,分析加入发酵剂及发酵底物L-苏氨酸及D-葡萄糖对吡嗪化合物种类及含量的影响。在模拟酱油发酵体系中,同时加入高产吡嗪的B.subtilisNr.5及发酵底物,可有效促进酱油中吡嗪化合物种类及浓度的提升。本研究有助于解析酱油发酵体系中烷基吡嗪的来源,首次为酱油中吡嗪化合物的高效合成提供新的思路。
1 材料与方法
1.1 材料与试剂
理化试剂:L-苏氨酸、D-葡萄糖、盐酸、NaCl,国药集团化学试剂有限公司;酵母粉(OXID)、蛋白胨(OXID),江苏博美达试剂公司;磺基水杨酸、乙腈、甲酸,上海Thermo Fisher试剂公司;2,3,5-TMP、2,3,5,6-TTMP、3,5-EDMP、3,6-EDMP、2,3-二甲基吡嗪(2,3-dimethylpyrazine, 2,3-DMP)、2,5-DMP、2,6-DMP、2-甲基-3-甲硫基吡嗪、2-甲基吡嗪、2-乙基-5-甲基吡嗪、2,3-二乙基-5-甲基吡嗪,Sigma-Aldrich公司。
B.subtilisNr.5为实验室前期筛选及保藏菌株[16]。
LB培养基(g/L):酵母粉5、蛋白胨 10、NaCl 10;若固体培养基则另加入琼脂 20 g、pH 7.2~7.4,121 ℃灭菌30 min。
YPDM液体培养基(g/L):酵母粉10、蛋白胨 10,pH 7.2~7.4,115 ℃灭菌30 min。
Y-G培养基:酵母粉11.11 g、蛋白胨 11.11 g、蒸馏水 1 L,pH 7.2~7.4,分装45 mL至250 mL三角瓶中,115 ℃灭菌30 min。配制母液质量浓度为50 g/L的D-葡萄糖,无菌条件下采用0.22 μm水系滤头过滤后,按5 mL的量进行添加,使D-葡萄糖的终质量浓度为5 g/L。
Y-T培养基:酵母粉11.11 g、蛋白胨 11.11 g、蒸馏水 1 L,pH 7.2~7.4,分装45 mL至250 mL三角瓶中,115 ℃灭菌30 min。配制母液质量浓度为100 g/L的L-苏氨酸,无菌条件下采用0.22 μm水系滤头过滤后,按5 mL的量进行添加,使L-苏氨酸的终质量浓度为10 g/L。
Y-GT培养基:酵母粉11.11 g、蛋白胨 11.11 g、蒸馏水 1 L,pH 7.2~7.4,分装45 mL至250 mL三角瓶中,115 ℃灭菌30 min。参考上述溶液配制,使培养基中外源添加底物D-葡萄糖和L-苏氨酸的终质量浓度分别为5和10 g/L。
1.2 仪器与设备
超净工作台(SW-CJ-1FD),苏州净化有限公司;高速冷冻离心机(5804R),德国Eppendorf公司;液相色谱-质谱联用仪(Waters UPLC/XE O TQ),美国Waters公司;气相色谱-质谱联用仪(Thermo ScientificTMTrace 1300/ISQ LT),美国Thermo Fisher公司;恒温调速回转式摇床(DKY-2),上海杜科自动化设备有限公司;分析天平(ME204E)、pH计(FE28),瑞士Mettler Toledo公司;高压湿热自动灭菌锅(SX-700)、日本Tomy Digital Biology公司。
1.3 实验方法
1.3.1 微生物批次培养
将B.subtilisNr.5在LB平板上进行活化,37 ℃过夜培养,挑取单菌落至LB试管中,37 ℃,200 r/min摇床培养12 h获取种子液。将活化的种子液按体积分数1%的添加量分别转接至Y-G、Y-T和Y-GT的液体培养基中,同时设置了一组不接菌的对照组,以消除培养基和培养过程对目标产物吡嗪含量的影响。批次发酵实验在500 mL锥形瓶中进行,装液量为100 mL, 37 ℃下200 r/min培养48 h,期间分别在0、6、10、20、31和48 h进行取样,取样体积为6 mL,对其进行细胞生长密度(OD600 nm)的测定。样品经离心14 000 r/min, 5 min后获取上清液置于-20 ℃,后续进行吡嗪浓度检测。上述发酵组别的样品均一式三份。
1.3.2 酱油模拟发酵
参考文献[18]中的方法进行酱油制曲。称取50 g成曲,分装至500 mL锥形瓶中,加入200 mL 180 g/L的盐水进行发酵。具体操作方法如下:首先,将B.subtilisNr.5在LB平板上进行活化,37 ℃过夜培养,挑取单菌落至LB试管中,37 ℃,200 r/min摇床培养获取种子液,测定菌液OD600 nm,待菌液OD值为4.0时,将活化的菌液用生理盐水清洗2遍后,按体积分数1%的添加量分别转接至上述酱油固态发酵培养体系B和C组。同时将等体积生理盐水加至对照组A中。A、B和C组固态发酵培养基均放置于37 ℃细菌培养箱中培养7 d。随后将过滤除菌的外源添加化合物按曲料干质量(50 g)的百分比相应添加至C组,具体见表1,上述发酵组别的样品均一式三份,发酵30 d,每5 d手动摇动1 min。样品A、B和C组发酵30 d后进行取样待测。

表1 酱油发酵模拟体系Table 1 Simulation system of soy sauce fermentation
1.3.3 吡嗪化合物的定量分析
1.3.3.1 2,3,5-TMP、2,3,5,6-TTMP、3,5-EDMP及3,6-EDMP的定量分析
样品预处理方法:批次发酵样品:发酵液离心,14 000 r/min,5 min后取上清液。将上清液按体积比1∶ 1与乙腈溶液混合,冰浴超声振荡20 min,于4 ℃ 12 000 r/min条件下离心30 min,获取上清液加入进样瓶中,进行LC-MS定量分析。酱油模拟发酵样品:酱油模拟发酵液经4层滤纸过滤后,将溶液离心,14 000 r/min, 5 min后得到上清液。上清液直接加到进样瓶中进行GC-MS半定量分析;将上清液按如上方法进行萃取处理,进行LC-MS定量分析。
本研究采用液相色谱-质谱联用仪对发酵液中吡嗪进行定量分析。首先,采用正离子模式下Daughters扫描方式获取4种吡嗪标准品的保留时间和质谱信息。随后,通过设定如下的离子对:109→67 (2,5-DMP)、123→81 (2,3,5-TMP)、137→96 (2,3,5,6-TTMP)、137→122 (3,5-EDMP)、137→122 (3,6-EDMP),采用多反应检测模式(multiple reaction monitoring,MRM)对以上4种化合物进行检测。具体仪器参数如下:使用Waters BEH C18(100 mm × 2.1 mm, 1.7 μm)色谱柱,流动相A为体积分数0.1%的甲酸水溶液,流动相B为含体积分数0.1%甲酸的乙腈溶液。设定流动相的初始浓度为95% A;0.1~25 min,95% A~70% A;总计运行25 min,流速设定为0.15 mL/min,进样量为5 μL。质谱采集方法及参数设置:采用二级质谱,正离子模式,毛细管电压3.05 k , 脱气速度800 L/h,脱气温度350 ℃,锥孔气流30 L/h,锥孔电压31 ,碰撞电压19 ,数据收集时间0.2 s,质荷比(m/z)40~400。
本研究通过构建一系列不同浓度梯度的吡嗪混合标准溶液,即二甲基吡嗪(包括2,3-DMP、2,5-DMP及2,6-DMP)、2,3,5-TMP、TTMP、3,5(6)-EDMP。二甲基吡嗪(2,5-DMP为代表)的标准品质量浓度分别设置为0.1、1、10、50、100、500和800 μg/L以及1、2、5、10和20 mg/L共12个浓度梯度;TMP的标准品质量浓度分别设置为 0.1、0.5、1、10、50、100、200、500、800、1 000、2 000和5 000 μg/L共12个浓度梯度;TTMP的标准品质量浓度分别设置为0.1、0.2、0.5、0.8、1、10、20、40、50、80、100和200 μg/L共12个浓度梯度;3,5(6)-EDMP的标准品质量浓度分别设置为 0.1、0.5、1、10、20、50、80、100、200、500、800和1 000 μg/L共12个浓度梯度;外标法实现对烷基吡嗪的定量。
1.3.3.2 2,3-DMP、2,5-DMP及2,6-DMP的定量分析
如上利用液相色谱检测方法无法实现2,3-DMP、2,5-DMP及2,6-DMP的有效分离,因此,需配合高效气相、质谱对以上3种化合物进行定量。样品预处理:将发酵样品离心,14 000 r/min, 5 min后得到上清液。5 mL样品中加入5 μL 0.09 g/L的2-甲基-3-甲硫基吡嗪作为内标。本研究利用气相色谱-质谱联用仪,色谱柱型号为DB-WAX (60 m×0.25 mm, 0.25 μm),柱载气为He,流速为1.2 mL/min,不分流;升温程序:50 ℃保持2 min,随后以3 ℃/min上升到110 ℃,保持5 min,随后以6 ℃/min升温至230 ℃,保持8 min。质谱条件如下:电离能70 e ;质谱传输线温度230 ℃;离子源温度260 ℃;进样口温度230 ℃;扫描时间0.1 s;质谱扫描范围25~350 amu。首先,基于全扫模式(Full scan),计算2,3-DMP、2,5-DMP及2,6-DMP的峰面积比值;其次,利用液质联用仪,得到二甲基吡嗪的总浓度;最后,利用二甲基吡嗪总浓度及2,3-DMP、2,5-DMP及2,6-DMP的峰面积比值,计算得到2,3-DMP、2,5-DMP及2,6-DMP的浓度。例如二甲基吡嗪总浓度为M,2,3-DMP峰面积为A1, 2,5-DMP峰面积为A2, 2,5-DMP峰面积为A3。则2,3-DMP浓度按公式(1)计算:
(1)
1.3.4 模拟酱油样品中风味化合物的半定量分析
风味化合物半定量分析时的样品预处理及样品检测方法与2,3-DMP、2,5-DMP及2,6-DMP的检测方法一致。2-甲基-3-甲硫基吡嗪作为内标化合物的浓度已知(终质量浓度为0.90 μg/L),根据目标化合物峰面积(Ai)与内标化合物峰面积(Ac)的比值,按公式(2)计算目标化合物相对浓度ci:
(2)
1.3.5 酱油理化指标检测
氨基酸浓度的测定:将发酵30 d模拟酱油发酵样品取样1 mL,14 000 r/min 离心 5 min后取上清液。按体积比1∶1将上清液与体积分数10%磺基水杨酸混匀,4 ℃静置4 h后置于12 000 r/min条件下,离心10 min,重复以上步骤2次。吸取上清液1 mL,加入不同体积的0.02 mol/L HCl溶液,将萃取上清液分别稀释20、30、50倍。稀释后样品过0.22 μm水相滤头至进样瓶中待测。氨基酸分析采用OPA-FMOC柱前衍生的方法,采用高效液相色谱仪系统,搭配Diamonsil C18(250 mm × 4.6 mm, 5 μm)色谱柱。pH测定:直接利用pH计测定酱油发酵样品上清液pH。模拟酱油样品的氨氮浓度及总酸水平按照国标法测定,分别为GB 5009.235—2016《食品安全国家标准 食品中氨基酸态氮的测定》及GB/T 12456—2008《食品中总酸的测定》。
2 结果与分析
2.1 B.subtilis Nr. 5具有多种吡嗪合成能力
在微生物发酵过程中,吡嗪化合物属于次级代谢产物,化合物质量浓度通常较低(ng/L~μg/L),难以实现精准定性定量[19]。本研究首先优化7种吡嗪检测方法,包括5种在酱油中有风味价值的吡嗪化合物,即2,5-DMP、2,6-DMP、2,3,5-TMP、3,5-EDMP及3,6-EDMP,另外加上1种2,5(6)-DMP的同分异构体—2,3-DMP,及已被证明可以由B.subtilis合成的吡嗪化合物—2,3,5,6-TTMP。高效液相色谱-质谱联用仪是公认的可精准实现化合物定性定量的检测设备。如图2-a所示,经过检测方法优化,本研究可实现二甲基吡嗪(包括2,3/2,5/2,6-DMP)、2,3,5-TMP、2,3,5,6-TTMP、3,5-EDMP及3,6-EDMP有效分离。然而,2,3-DMP、2,5-DMP及2,6-DMP作为同分异构体,具有相似的物化性质,无法利用液质进行有效分离。本研究继续研究优化高效气相色谱-质谱联用仪检测方法,可实现3种二甲基吡嗪有效分离(图2-b)。最终,本研究同时实现了7种烷基吡嗪的精准定性定量。
本课题组前期筛选得到1株可高产3,5-EDMP及3,6-EDMP的菌株,根据分子生物学及生理生化分析,鉴定并命名为B.subtilisNr.5[16],本研究继续探究B.subtilisNr. 5的吡嗪合成能力,检测B.subtilisNr. 5在基础营养培养基中及添加了D-葡萄糖及L-苏氨酸(已解析的烷基吡嗪合成底物)的培养基的吡嗪合成能力。如图3所示,未接种B.subtilisNr. 5的各培养基中均未检出吡嗪化合物,表明在常温常压下,吡嗪化合物的合成必须有微生物参与。D-葡萄糖及L-苏氨酸的添加未对微生物的生长产生影响(图3-a)。值得注意的是,B.subtilisNr. 5在发酵20~30 h时,达到最高细胞浓度,随后细胞浓度缓慢下降。与此同时,大部分吡嗪在20 h后开始大量合成。如上结果与吡嗪化合物为次级代谢产物,微生物发酵提供吡嗪化合物合成必要前体的前期结论一致[15]。
如图3-b~3-f所示,培养基中添加D-葡萄糖可有效促进B.subtilisNr. 5合成2,3,5,6-TTMP。培养基中添加L-苏氨酸可有效促进菌株合成2,5-DMP及3,6-EDMP(图4)。在同时添加了L-苏氨酸及D-葡萄糖的培养基中,7种目标烷基吡嗪合成均得到显著提高,其中2,5-DMP及2,3,5-TMP最高质量浓度均达到100 mg/L以上。结果表明,B.subtilisNr. 5在添加D-葡萄糖及L-苏氨酸条件下,可以至少合成2,3-DMP、2,5-DMP、2,6-DMP、2,3,5-TMP、2,3,5,6-TTMP、3,5-EDMP及3,6-EDMP共7种吡嗪化合物,其中,48 h内 2,5-DMP、2,3,5-TMP、3,5-EDMP及3,6-EDMP的合成质量浓度均>1 mg/L。

a-不同吡嗪在液相色谱-质谱联用仪的出峰时间;b-不同二甲基吡嗪在气相色谱-质谱联用仪的出峰时间图2 检测条件优化实现烷基吡嗪有效分离Fig.2 The optimization of detection methods realized the separation of pyrazine peaks

图3 B.subtilis Nr. 5的生长曲线及产吡嗪能力分析Fig.3 The growth and pyrazine production cur es of B.subtilis Nr. 5注:K-G:培养基为LB添加D-葡萄糖,无微生物接种;K-T:培养基为LB添加L-苏氨酸,无微生物接种;K-GT:培养基为LB添加D-葡萄糖及L-苏氨酸,无微生物接种;S-G:培养基为LB添加D-葡萄糖,接种B.subtilis Nr.5; S-T:培养基为LB添加L-苏氨酸,接种B.subtilis Nr.5; S-GT:培养基为LB添加D-葡萄糖及L-苏氨酸,接种B.subtilis Nr.5(下同)

a-2,3-二甲基吡嗪;b-2,5-二甲基吡嗪;c-2,6-二甲基吡嗪图4 枯草芽孢杆菌发酵48 h合成的二甲基吡嗪浓度Fig.4 The production of dimethylpyrazines by B.subtilis Nr. 5注:空白,培养基为LB添加D-葡萄糖及L-苏氨酸,无微生物接种
2.2 酱油模拟发酵体系中接种B.subtilis Nr. 5
B.subtilisNr. 5有多吡嗪产生能力,接种B.subtilisNr. 5是否在酱油发酵中具有提升吡嗪化合物合成能力的有效策略值得探究。基于工业生产酱油的合成工艺,本研究构建模拟酱油发酵体系,设置不添加B.subtilisNr. 5发酵剂的样品为对照,经过30 d保温发酵,研究B.subtilisNr. 5菌株加入对酱油中吡嗪化合物浓度的影响。发酵后,未接种样品(pH 4.50)与接种样品(pH 4.55) 的pH一致,未接种样品总酸质量浓度(以乙酸计)为(0.45±0.03) g/100 mL,接种样品总酸质量浓度为(0.22±0.03) g/100 mL,总酸水平略有下降,可能与枯草芽孢杆菌发酵产生pH中性化合物有关。如表2所示,氨基酸种类及浓度未有明显差异。在吡嗪化合物合成方面,2,5-DMP质量浓度由0.41 μg/L提高到7.74 μg/L,提高了18.88倍。2,3,5-TMP质量浓度由0.39 μg/L提高到1.29 μg/L,提高了3.31倍,其余吡嗪浓度没有明显提高(图5)。结果表明,在酱油发酵过程中,只添加可合成吡嗪的发酵剂,可提升部分吡嗪合成浓度。

图5 模拟酱油样品中吡嗪化合物质量浓度Fig.5 The concentration of pyrazines in stimulate soy sauce samples注:A样品:未添加发酵剂及吡嗪合成底物的模拟酱油体系;B样品:添加了发酵剂(B. subtilis Nr. 5)的模拟酱油体系;C样品:添加了发酵剂(B. subtilis Nr. 5)及吡嗪合成底物(D-葡萄糖、L-氨基酸及铵盐)的模拟酱油发酵体系(下同)
2.3 发酵剂及发酵底物添加提升模拟酱油体系中吡嗪化合物浓度
本研究分析同时加入发酵剂及发酵底物对酱油发酵体系中吡嗪化合物合成的影响。经过30 d发酵,同时加入L-苏氨酸、D-葡萄糖及B.subtilisNr.5的模拟酱油发酵样品pH值为4.61,总酸(以乙酸计)质量浓度为(0.32±0.01) g/100 mL,与未添加底物及菌株的样品相比pH接近(pH 4.50),总酸略有下降[未接种样品总酸质量浓度为(0.45±0.03) g/100 mL]。未添加底物及菌株的氨基酸质量浓度为(8.32±0.09) g/L,氨基酸态氮水平为(0.10±0.01) g N/100 mL, 添加了底物及菌株的氨基酸质量浓度为(10.81±0.10) g/L,氨基酸态氮水平为(0.12±0.01) g N/100 mL。因此,底物及菌株的添加使得氨基酸浓度及氨氮水平均略有提升,可能与添加底物苏氨酸有关。从酱油发酵合成吡嗪种类及浓度来看,如图5所示,多种吡嗪化合物质量浓度得到明显提高。二甲基吡嗪中,2,3-DMP质量浓度由0.12 μg/L提高至0.30 μg/L,提高2.50倍;2,5-DMP质量浓度由0.41 μg/L提高至11.31 μg/L,提高27.59倍;2,6-DMP质量浓度由1.13 μg/L提高至14.03 μg/L,提高了12.42倍。2,3,5-TMP质量浓度由0.39 μg/L提高至2.93 μg/L,提高了7.52倍。2,3,5,6-TTMP质量浓度由0.06 μg/L提高至0.18 μg/L,提高了3倍。3,5-EDMP及3,6-EDMP质量浓度分别由0.09及0.10 μg/L提高至0.59及1.64 μg/L,分别提高了6.56及16.4倍。吡嗪总质量浓度由2.3 μg/L提高到30.98 μg/L,提高了12.46倍。结果表明,同时添加发酵剂及发酵底物,有希望实现酿造酱油中吡嗪化合物种类及浓度的提升。另外,2,3-DMP及2,6-DMP的微生物合成途径尚未解析,本研究有利于重要吡嗪化合物的微生物合成途径解析。

表2 模拟发酵30 d的酱油中氨基酸质量浓度Table 2 The concentration of amino acid in stimulate soy sauce fermentation at 30th days
2.4 接种B.subtilis Nr.5对模拟酱油中风味化合物合成的影响
除吡嗪外,有众多其他风味化合物贡献了酱油风味,包括酸、醇、醛、酯和呋喃等杂环化合物。本研究进一步解析发酵剂B.subtilisNr.5及发酵底物的添加对其他风味化合物形成的影响。如表3所示,同时添加发酵剂及发酵底物,醇类、酸类、酯类、吡嗪类、呋喃类杂环化合物浓度提高,醛类化合物浓度降低。酯类化合物是酱油发酵中的重要风味化合物,与未添加的模拟酱油发酵样品相比,添加了B.subtilisNr.5、L-苏氨酸及D-葡萄糖的样品中,2-甲基丁酸乙酯、3-甲基丁酸乙酯及己酸乙酯浓度提高了50%以上,棕榈酸乙酯浓度提升了2.46倍。值得注意的是,吡嗪化合物中,除已定量的7种吡嗪化合物,另检测发现,甲基吡嗪及2-乙基-6-甲基吡嗪浓度提高,浓度提升比例分别为 1.35及7.82倍。结果表明,同时接种B.subtilisNr.5及发酵底物,会促进多种风味化合物合成。
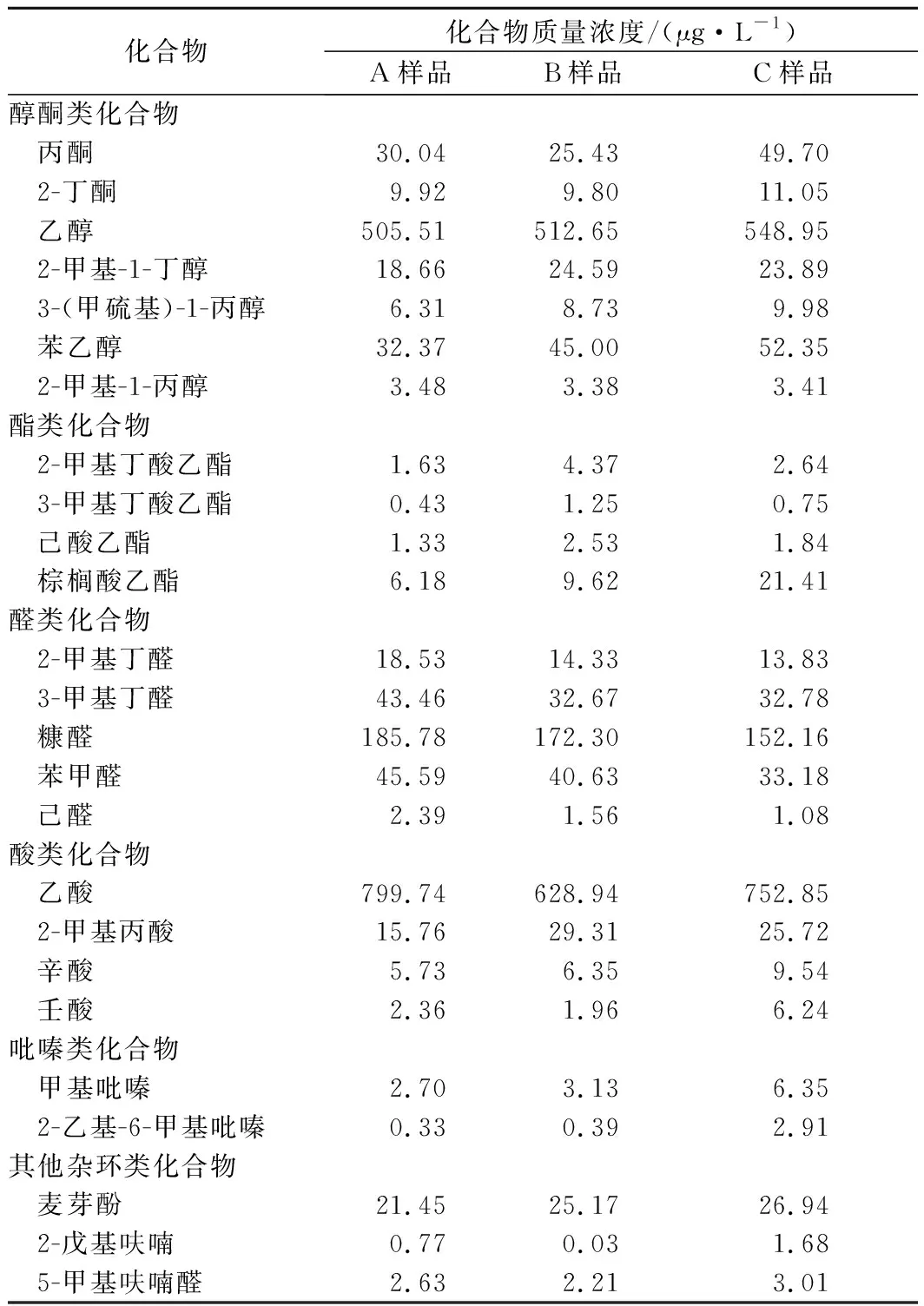
表3 模拟发酵30天的酱油体系中风味化合物种类及质量浓度Table 3 The ariety and concentration of olatile compounds in stimulate soy sauce fermentation at 30th days
3 结论
本研究在筛选得到1株可合成多种吡嗪化合物的微生物菌株基础上,通过模拟酱油发酵方式,探究基于微生物应用的提升酱油发酵过程中吡嗪化合物的合成策略。研究发现,酱油发酵过程中,同时添加可合成吡嗪的发酵剂B.subtilisNr.5及发酵底物L-苏氨酸及D-葡萄糖,可有效提升酱油中吡嗪化合物的种类及浓度。本研究一方面开发了发酵酱油中吡嗪化合物浓度提升策略;另一方面,对多种吡嗪化合物的微生物合成机制以及酱油中已有吡嗪化合物的合成途径研究有借鉴意义。
