瘦素和瘦素受体基因多态性与妊娠期糖尿病易感性的相关性研究*
2020-11-21邓梦瑶
向 俊, 邓梦瑶, 唐 昭, 周 伽, 向 兵, 曾 婧, 易 晶, 杨 梅
武汉科技大学医学院儿少卫生与妇幼保健学系,武汉 430065
妊娠期糖尿病(gestational diabetes mellitus,GDM)是指妊娠期间发生或首次发现的不同程度的糖耐量异常,是妊娠期常见并发症之一。在我国,GDM患病率高达13%[1]。由于肥胖人群和高龄产妇的增加,近年来其发病率有上升趋势[2]。GDM不仅可能增加孕产妇和围产儿的死亡风险,还可能增加产后母亲和后代糖尿病及不良心血管事件的发生率[3]。目前多数学者认为,GDM发病机制与2型糖尿病(type 2 diabetes mellitus,T2DM)相似,与胰岛β细胞功能降低和胰岛素抵抗(insulin resistance,IR)增加相关,而瘦素在其中发挥了重要作用[4]。瘦素是由瘦素基因转录生成的激素样蛋白质,分子量为16 kD,在下丘脑弓状核区中瘦素受体的介导下参与葡萄糖稳态的调控,可影响胰岛素分泌及外周组织对胰岛素的敏感性[5-7]。目前瘦素和瘦素受体基因多态性与T2DM的相关性已经从很多研究中得到证实,而其与GDM的关系尚不十分明确[8-10]。本研究旨在进一步探究汉族人群中瘦素及其受体基因多态性与GDM易感性的关系,为GDM发病机制的阐明及预防策略的制定提供线索,现将研究结果报道如下。
1 资料与方法
1.1 研究人群
本病例对照研究基于两阶段抽样,第一阶段于2015年1月至2015年9月在深圳市宝安区妇幼保健院开展,第二阶段于2018年1月至2019年3月在湖北省妇幼保健院开展。两阶段抽样均采用整群抽样法抽取研究期间于孕24~30周到院行75 g口服葡萄糖耐量试验(OGTT)阳性的孕妇为病例组,采用随机抽样法抽取同期同地点OGTT阴性的孕妇为对照组,最终共得到研究样本1755例,其中GDM组862名,对照组893名。两阶段研究样本的纳入及排除标准相同,排除标准如下:①之前患有或此次妊娠合并心血管系统疾病、肝肾疾病、1型或2型糖尿病、甲状腺疾病、多囊卵巢综合征等内分泌、代谢性疾病者;②多胎妊娠;③有精神性疾病等其他不能配合调查的疾病;④不签署知情同意书、不能配合血液学检测或问卷调查者;⑤非汉族孕妇。本研究经由武汉科技大学医学院伦理委员会批准,所有参与者均签署知情同意书。
本研究对GDM的诊断均符合国际糖尿病与妊娠研究组(International Association of Diabetes and Pregnancy Study Groups,IADPSG)的诊断标准[11]:妊娠24~28周及以后,禁食≥8 h,在实验前连续3 d正常饮食(即每日进食碳水化合物≥150 g),检查期间静坐、禁烟,行75 g OGTT实验。当达到或超过以下血浆葡萄糖值之一时,即可诊断为GDM:①空腹血糖≥5.1 mmol/L;②餐后1 h血糖≥10.0 mmol/L;③餐后2 h血糖≥8.5 mmol/L。
所有参与者在纳入时即收集血液样本,并通过问卷调查的方式对基础资料进行收集,包括孕妇人口学特征、孕前体质指数(body mass index,BMI)、孕期增重、孕产史及家族史、此次妊娠情况(有无早孕反应、有无阴道出血等)。
1.2 DNA提取及基因分型
采集研究对象空腹外周静脉血3 mL,4℃ 3000 r/min离心15 min分离血浆和血细胞,分装后置于-80℃冰箱保存。利用血液基因组DNA提取试剂盒(天根离心柱型DP348),按照试剂盒说明书从血细胞中提取基因组DNA。基因多态性位点分型采用MassArray平台进行检测,经过多重PCR扩增、产物碱性磷酸化处理、单碱基延伸反应、树脂纯化后进行芯片点样和质谱检测。本研究中瘦素基因rs2167270,瘦素受体基因rs1805096、rs1137100应答率均为99%。
1.3 统计学方法
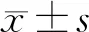
2 结果
2.1 一般情况
研究对象一般情况如表1所示,GDM组较对照组年龄大、学历高、孕前BMI高(均P<0.05)。GDM组中有糖尿病家族史的孕妇比例为29.58%,显著高于对照组(χ2=84.20,P<0.01)。两组孕妇孕周、产次分布差异无统计学意义(均P>0.05)。
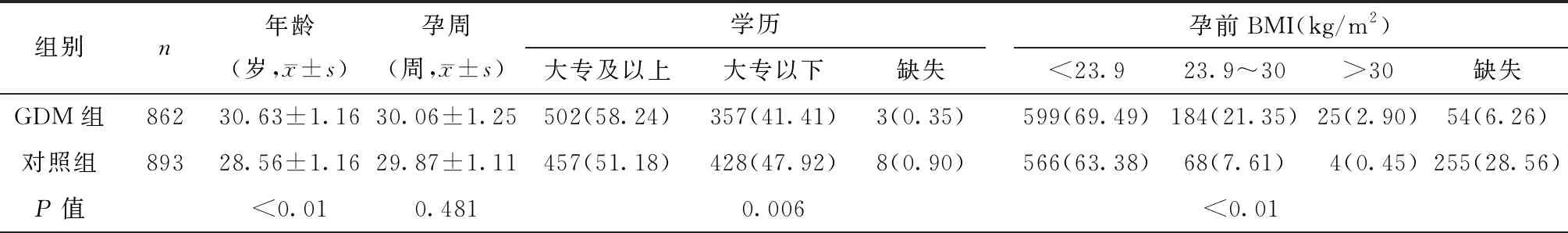
表1 研究对象一般情况[n(%)]Table 1 The characteristics of participants [n(%)]

组别n产次经产妇初产妇缺失糖尿病家族史是否缺失GDM组862506(58.70)353(40.95)3(0.35)255(29.58)603(69.95)4(0.47)对照组893544(60.92)347(38.86)2(0.22)105(11.76)773(86.56)15(1.68)P值0.583<0.01
2.2 Hardy-Weinberg遗传平衡检验
对照组各位点的基因型分布经Hardy-Weinberg遗传平衡(HWE)检验,结果显示各位点均符合该定律(均P>0.05),认为具有群体代表性。结果见表2。
2.3 瘦素及瘦素受体基因多态性与GDM易感性的关系
瘦素与瘦素受体基因多态性与GDM易感性的关系如表3所示。未经混杂因素调整的模型1中,相较于瘦素基因rs2167270位点的GG基因型,其GA基因型与GDM易感性增加有关(P<0.05),且在调整了孕妇的年龄、文化程度、孕前BMI和糖尿病家族史后的模型2中,该相关性依然存在(OR=1.69,95%CI:1.20~2.38,P=0.003)。未发现瘦素受体基因rs1805096和rs1137100位点各基因型与GDM易感性相关(均P>0.05)。

表2 基因位点多态性信息Table 2 Genetic polymorphism information
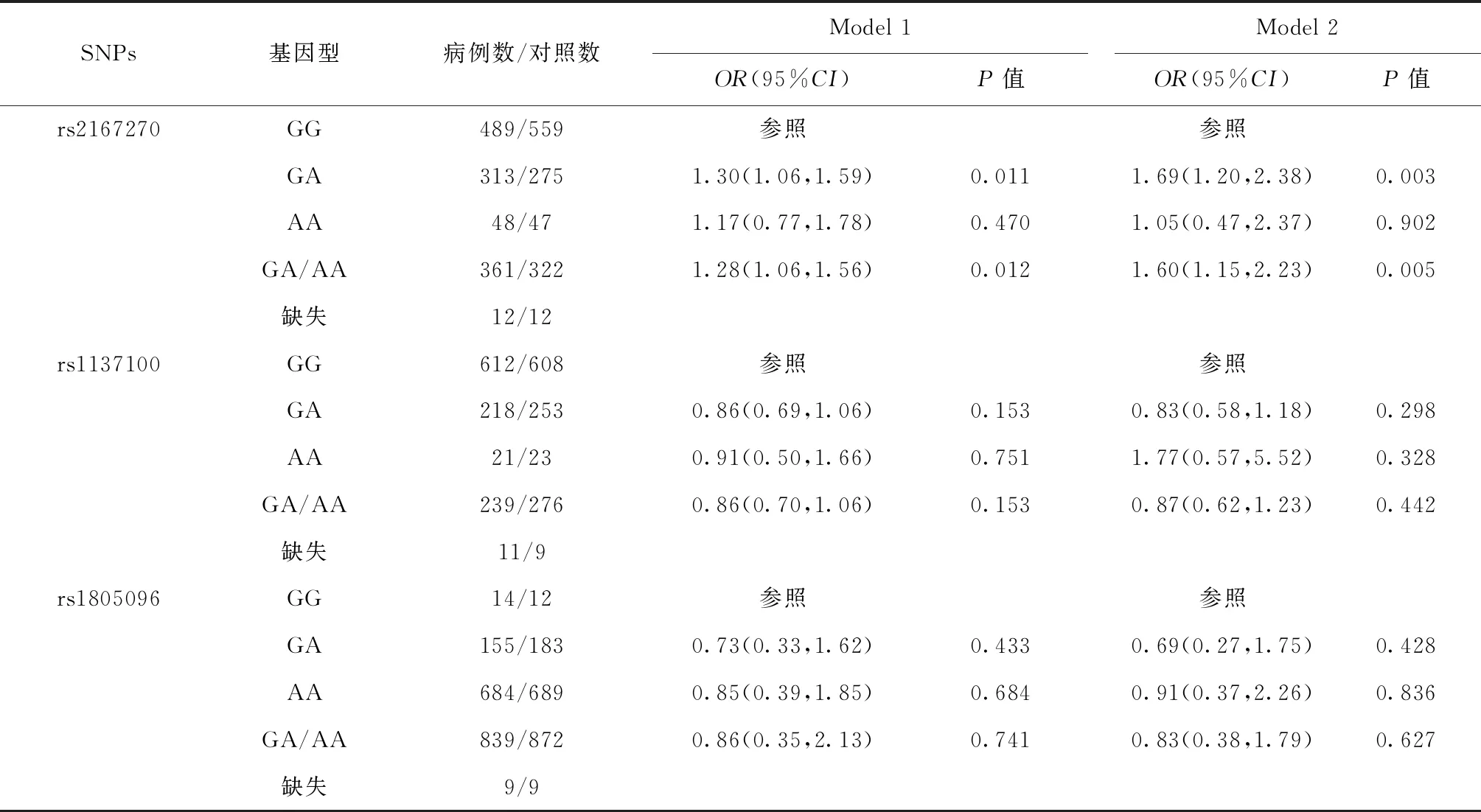
表3 瘦素及瘦素受体基因多态性与GDM易感性的关系Table 3 Relationship between leptin gene,leptin receptor gene polymorphism and susceptibility of GDM
3 讨论
3.1 瘦素基因rs2167270突变可能与GDM易感性相关
本研究中瘦素基因rs2167270位点G等位基因频率为60.89%,与其在高加索和巴士拉人群中的60.54%、60.00%相近[12-13]。瘦素基因rs2167270多态性已被证实与T2DM、肥胖存在显著关联,如于海兵[14]的研究结果显示,携带rs2167270 GA基因型者相比携带GG基因型者,其T2DM发病风险显著提高。瘦素基因rs2167270位点中A等位基因可能通过修饰转录因子结合位点影响瘦素基因表达,增加胰岛素抵抗,进而增加T2DM的发病风险[15-18]。但目前鲜有关于rs2167270位点多态性与GDM易感性的相关性研究。本研究结果提示携带GA基因型的孕妇相较GG基因型者其GDM易感性增加,这可能是由于rs2167270的A等位基因突变与血清瘦素水平升高相关[19]。而Pawlik等[12]的研究中虽未发现该位点突变与GDM的相关性,但仍指出携带rs2167270 A等位基因(AA/GA)的孕妇有着更高的日常胰岛素需求,也在一定程度上反映了rs2167270 A等位基因可潜在影响孕妇的胰岛素抵抗。
3.2 瘦素受体基因多态性与GDM易感性的关系仍需进一步研究
尽管已有Meta分析提示在汉族人群中瘦素受体基因rs1805096和rs1137100位点在等位基因遗传模型及隐性基因模型下均与T2DM相关[20],但本研究未发现其与GDM易感性存在关联,与在巴西开展的一项研究结果相同[21]。而杨媛等[22]则发现rs1805096位点突变会增加GDM发病风险。目前结论的不同可能与各研究纳入的研究对象遗传背景、采用的诊断标准等不同有关。瘦素受体基因位点rs1805096和rs1137100与GDM间的关系仍需要通过更大样本的研究来进一步探讨。
3.3 局限性
本研究纳入了目前研究较少的3个位点来探讨其与GDM易感性间的关系,尽管样本量大,且检验效能均达到90%以上,但仍存在一定的局限性。如研究中虽然调整了年龄、孕前BMI、糖尿病家族史等混杂因素,但不能完全排除所有混杂因素的影响,例如我们缺少研究对象的膳食信息,而饮食可能会对瘦素水平产生影响;也未考虑基因与基因、基因与环境间的交互作用对GDM易感性的影响等,所以它们之间的关系仍需进一步探讨。
综上所述,本研究结果提示汉族孕妇中瘦素基因rs2167270位点多态性与GDM易感性相关,但并未发现瘦素受体基因rs1805096和rs1137100位点突变与GDM易感性存在相关性。
