KH2PO4-KCl-H2O、NH4H2PO4-NH4Cl-H2O三元体系283.15 K相平衡研究
2020-11-21杨家敏李天祥
吴 强,胡 雪,朱 静,杨家敏,李天祥
(贵州大学化学与化工学院,贵州贵阳550025)
近年来,中国发布了一系列关于发展水肥一体化的文件,为水溶性肥料的发展提供了良好的机遇,大量元素水溶肥料氮、磷、钾含量高、养分全,具有全水溶性、兼容性,可用于喷施、滴灌等农业设施,实现水肥一体化等优点,适应了现代农业节水、省肥、高效的施肥理念[1-3]。采用共结晶法生产水溶肥,优于简单的物理混合法,因而受到广泛重视。共结晶是多种固体物质以共晶体状态从蒸汽、溶液或熔融物中析出的过程[4],是化学合成水溶肥——特别是多组分复合肥——的重要手段[5],而多元体系的固液相平衡是共结晶研究和应用的基础[6]。笔者所在课题组已做了(NH2)2CO-NH4H2PO4-H2O体系在283.15 K下相平衡的实验研究[7],本文采用等温溶解平衡法研究了三元体系KH2PO4-KCl-H2O、NH4H2PO4-NH4Cl-H2O在283.15 K时的相平衡,采用湿渣法与X射线衍射相结合的方法考察了平衡固相的组成。
在诸多电解质溶液理论中,以Pitzer模型应用较为广泛。G.Li等[8]采用Pitzer模型拟合了C4H8ONa2SO4-MgSO4-H2O体系,模型的计算值与三元和四元体系的实验溶解度数据吻合良好。何贤江等[9]采用Pitzer方程对四元体系KCl-NaCl-MgCl2-H2O在288.15 K的溶解度数据做了计算,计算值与实验值吻合很好。赵长伟等[10]将Pitzer模型应用于含固溶体的三元体系KCl-NH4Cl-H2O中,实验值与计算值的绝对偏差仅为0.04。因此本文用Pitzer电解质溶液理论对实验数据进行模拟计算。
1 实验部分
1.1 试剂及仪器
试剂:KCl、NH4H2PO4、KH2PO4、NH4Cl,分析纯。实验中所用水为去离子水,电阻率为18.25 MΩ·cm。
仪器:DC-4006型低温恒温槽、S10-3型恒温磁力搅拌器、UV-6100S型紫外可见分光光度计、D8 Advance型X射线粉末衍射仪、夹套容器。
1.2 实验方法及装置
采用等温溶解平衡法测定固液平衡数据,从相对应二元体系的饱和点开始,不断加入另一种物质,直至液相组成不再变化。在整个实验过程中,系统由低温恒温槽保持在(283.15±0.1)K;液相连续取样分析,液相组成不变后认为达到相平衡,本文所研究体系8 h达到平衡。最后,取上层清液和湿固体样品分析,得到液相和湿渣组成。
1.3 分析方法
采用钼锑抗比色法测定NH4H2PO4和KH2PO4质量分数;采用佛尔哈德法测定KCl和NH4Cl质量分数;采用差减法计算水的质量分数;固相鉴定采用湿渣法结合X射线粉末衍射。
2 结果与讨论
2.1 KH2PO4-KCl-H2O三元体系溶解度数据及相图
表1为283.15 K时KH2PO4-KCl-H2O三元体系溶解度数据。由表1中的数据绘制了三元体系KH2PO4-KCl-H2O在283.15 K时的等温溶解相图,如图1所示。由表1和图1可知,该体系为简单共饱和型,有一个共饱和点,其组成为:w(KCl)=22.99%、w(KH2PO4)=2.93%、w(H2O)=74.08%。图1中点A、B、C分别代表H2O、纯固体KH2PO4、纯固体KCl,ad、bd为两条单变量曲线,其中ad为KCl的溶解度曲线,bd为KH2PO4的溶解度曲线。相图被分成了4个区域,Aadb为不饱和区,Cad为KCl结晶区,Bbd为KH2PO4结晶区,CdB为KH2PO4与KCl的共结晶区。由于KCl在水中的溶解度大于KH2PO4,在图1中体现为KH2PO4的结晶区面积大于KCl的结晶区面积。b点处KH2PO4的质量分数为15.47%,共饱和点d处KH2PO4的质量分数仅为2.93%,可见KCl对KH2PO4有强烈的盐析作用。
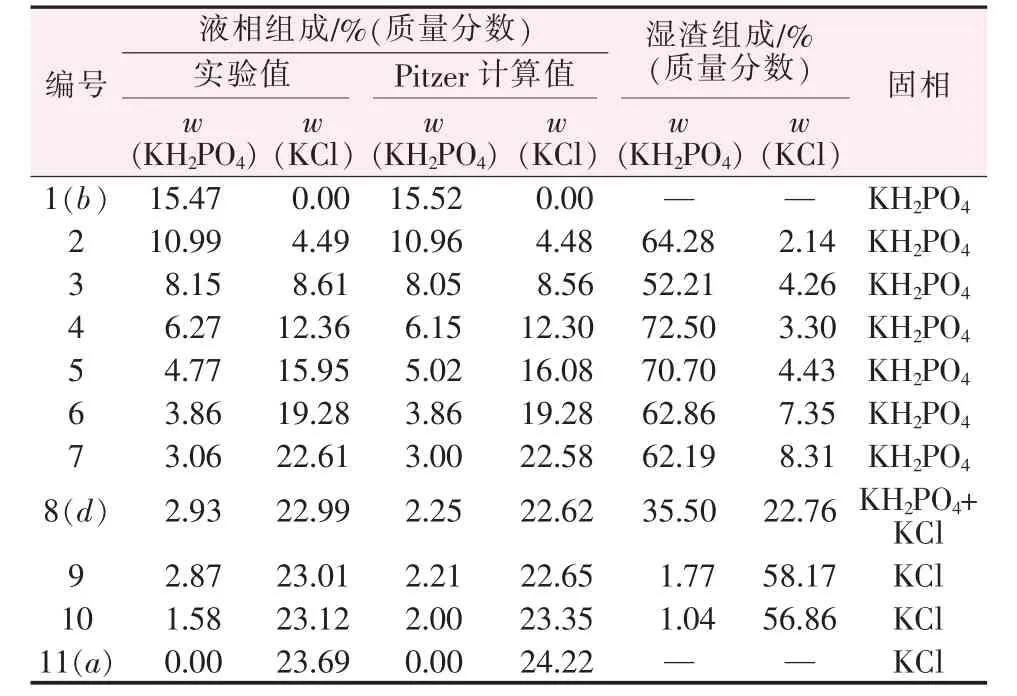
表1 283.15 K时KH2PO4-KCl-H2O三元体系固液相平衡数据
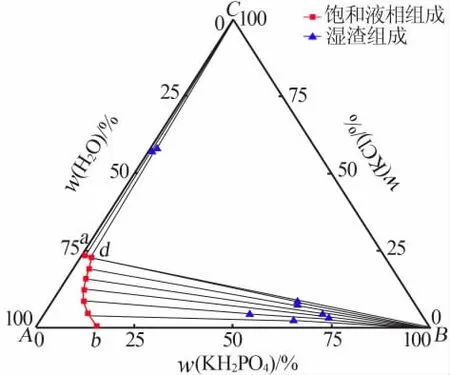
图1 283.15 K时KH2PO4-KCl-H2O三元体系等温溶解相图
图2为共饱和点d的固相X射线衍射谱图。由图2可知,当体系达到共饱和时,平衡固相为KCl晶体与KH2PO4晶体的混合物,该体系中无固溶体或加合物形成。
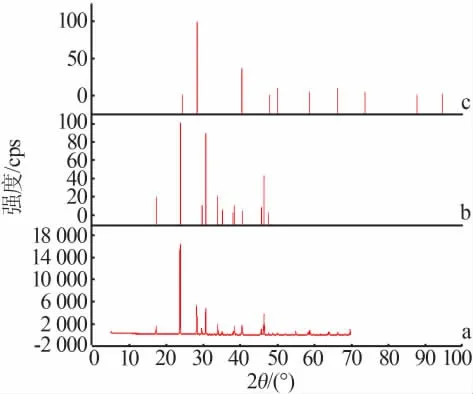
图2 共饱和点固相XRD谱图
2.2 NH4H2PO4-NH4Cl-H2O三元体系溶解度数据及相图
表2为283.15 K时NH4H2PO4-NH4Cl-H2O三元体系溶解度数据。由表2中的数据绘制了三元体系NH4H2PO4-NH4Cl-H2O在283.15 K时的等温溶解相图,见图3。由表2和图3可知,该体系为简单共饱和型,有一个共饱和点,其组成:w(NH4H2PO4)=4.47%、w(NH4Cl)=23.64%、w(H2O)=71.89%。图4中A、B、C分别代表H2O、纯固体NH4Cl、纯固体NH4H2PO4,fg、eg为两条单变量曲线,其中fg为NH4H2PO4的溶解度曲线,eg为NH4Cl的溶解度曲线。相图被分成了4个区域,Afge为不饱和区,Cfg为NH4H2PO4结晶区,Beg为NH4Cl结晶区,CgB为NH4H2PO4与NH4Cl的共结晶区。由于NH4Cl在水中的溶解度大于NH4H2PO4,在图4中体现为NH4H2PO4的结晶区面积大于NH4Cl的结晶区面积。f点处NH4H2PO4的质量分数为22.01%,共饱和点g处NH4H2PO4的质量分数仅为4.47%,可见NH4Cl对NH4H2PO4有强烈的盐析作用。
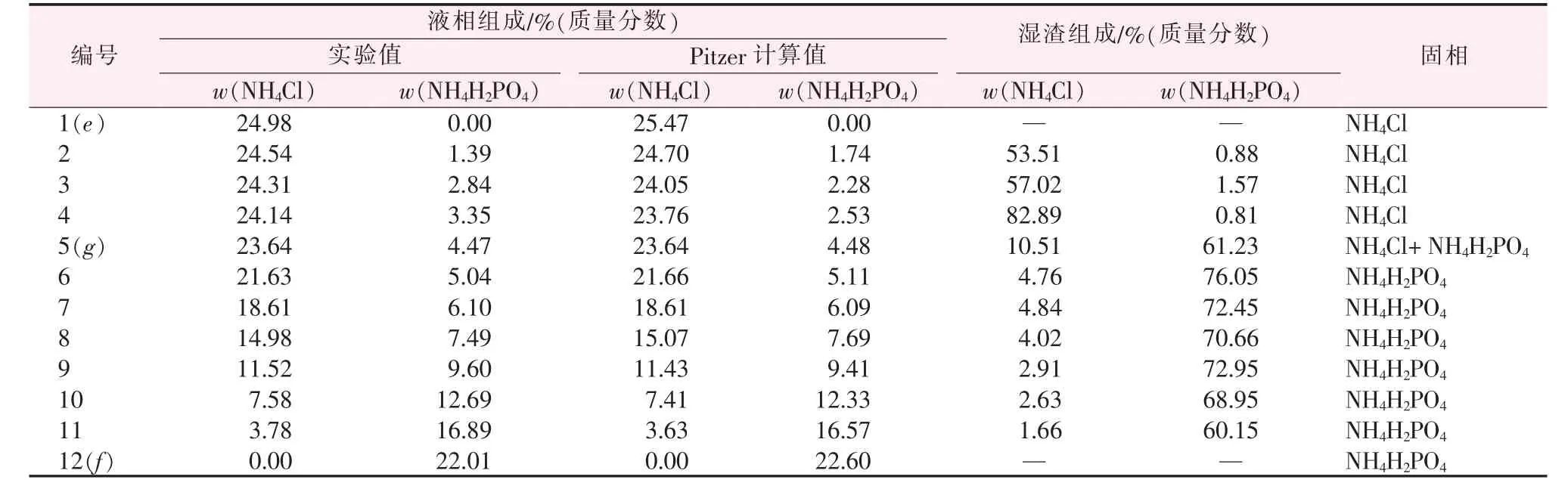
表2 283.15 K时NH4H2PO4-NH4Cl-H2O三元体系固液相平衡数据
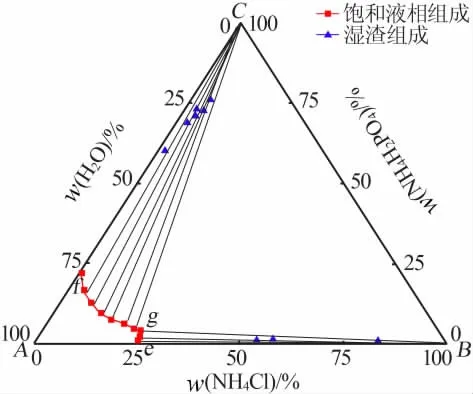
图3 283.15 K时NH4H2PO4-NH4Cl-H2O三元体系等温溶解相图
图4为共饱和点g的固相X射线衍射谱图。由图4可知,当体系达到共饱和时,平衡固相为NH4H2PO4晶体与NH4Cl晶体的混合物,该体系中无固溶体或加合物形成。
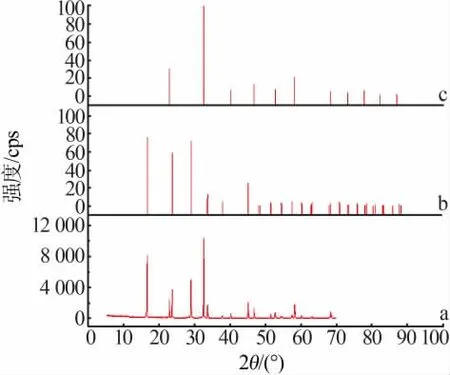
图4 共饱和点固相XRD谱图
3 三元体系KH2PO4-KCl-H2O、NH4H2PO4-NH4Cl-H2O 283.15 K的理论计算
3.1 Pitzer电解质溶液理论
基于Debye-Hückel理论,K.S.Pitzer等[11-17]从1972年起发表了一系列文章提出了一个半经验的电解质溶液理论,即Pitzer电解质溶液理论。对于混合电解质溶液,应用较为广泛的Pitzer公式是C.E.Harvie和J.H.Wear整理过的更为简单的HW公式,该公式给出了计算混合电解质渗透系数及离子活度系数的计算公式,具体的数学表达式:
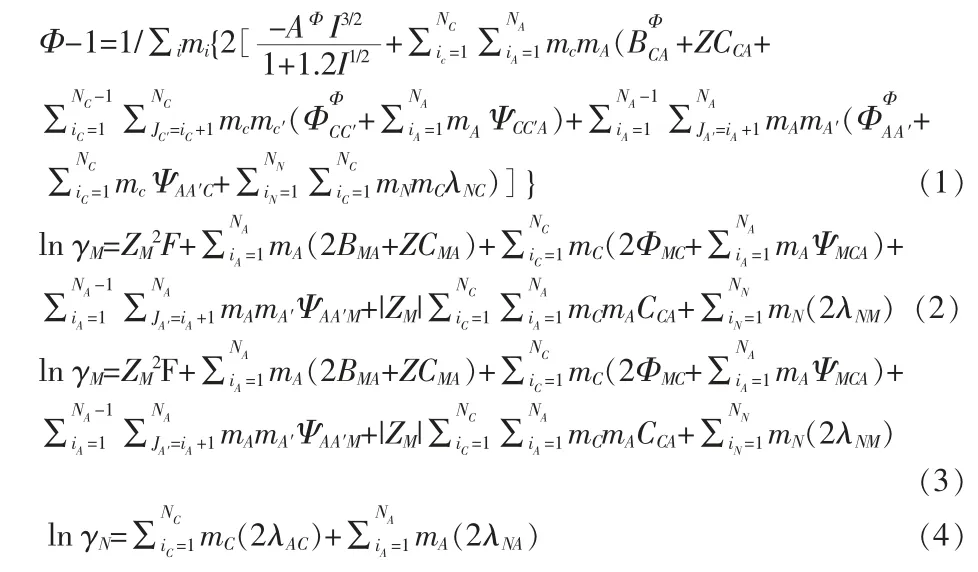
式中,M、C、C′代表阳离子,X、A、A′代表阴离子,NC、NA、NN分别表示阳离子、阴离子及中性分子的种类数,γX、ZX、mA与γM、ZM、mC分别代表阴阳离子的活度系数、离子的价数和质量摩尔浓度,γN、mN、λNC、λNA分别代表中性分子的活度系数、质量摩尔浓度及中性分子与阳离子C、阴离子A的相互作用系数。公式中 出现的F、C、Z、AΦ、Ψ、Φ、BФ可参照《水盐体 系相图及应用》计算[18]。
3.2 Pitzer单盐参数求解
以Pitzer电解质溶液理论计算混合电解质溶液中各电解质溶液的溶解度,首先需要获得的是相应温度纯电解质离子作用参数,即物质的β(0)、β(1)、CФ值。表3为298 K下本文所研究体系中单盐的离子相互作用参数[19]。
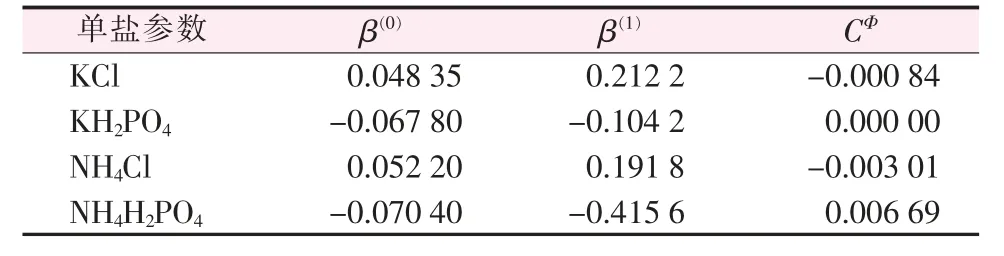
表3 298.15 K时单盐电解质的Pitzer参数值
当系统温度偏离298.15 K不大时,不同温度时的Pitzer方程参数可以根据Pitzer参数的温度系数∂β(0)/∂T、∂β(1)/∂T、∂CΦ/∂T来估算,表4为从量热数据估算的电解质参数的温度系数[14]。
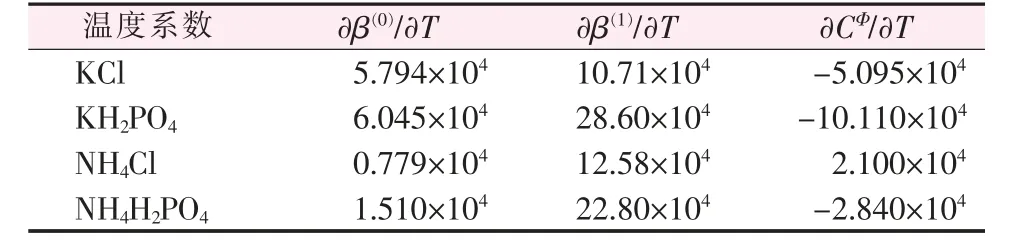
表4 从量热数据估算的单盐电解质参数的温度系数
采用表3和表4中数据,得到283.15 K下各单盐的离子相互作用Pitzer参数,如表5所示。
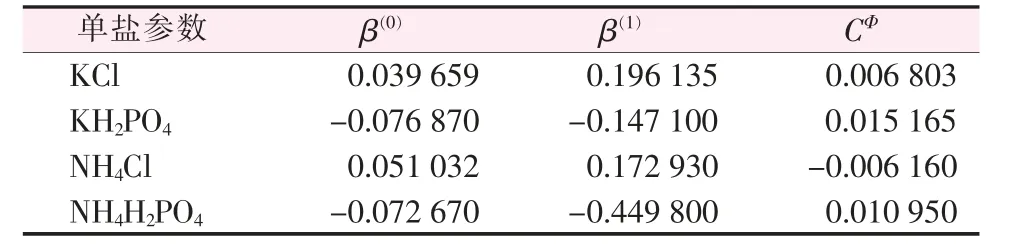
表5 283.15 K时单盐电解质的Pitzer参数值
3.3 Pitzer混合离子作用参数的求解
有关283.15 K时的Pitzer方程混合离子作用参数θ、ψ未见文献报道,本文采用三元体系溶解度数据,运用最小二乘法多元线性回归的方法拟合Pitzer混合离子作用参数。以KH2PO4-KCl-H2O为例,基本原理:设KCl与KH2PO4的溶解平衡常数分别为K1与K2,K+、Cl-、H2PO4-的质量摩尔浓度分别为mK、mCl、mP,活度系数分别为γK、γCl、γP。当溶液中KCl饱和而KH2PO4未饱和时,体系中存在以下平衡:

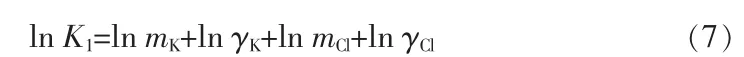
同理,当KH2PO4饱和而KCl未饱和时,体系有:
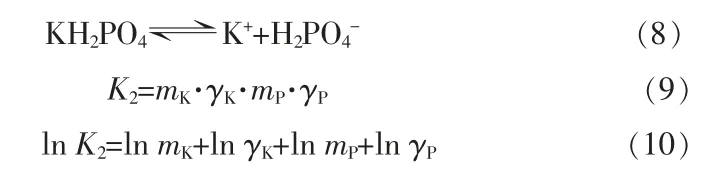
由HW公式可知,γK、γCl、γP为mK,mCl,mP的函数,利用三元体系KH2PO4-KCl-H2O溶解度数据,采用多元线性回归的方法拟合出混合离子作用参数θ、Ψ,拟合结果为:θCl,H2PO4=0.031 51;ΨK,Cl,H2PO4=-0.013 12;ΨNH4,Cl,H2PO4=0.006 76。
3.4 溶解平衡常数的求解
溶解平衡常数的求解通常有2种方法,一种是利用热力学数据由公式ln K=ΔGθ/RT计算得到,或者利用电解质溶液理论模型计算。三元体系KH2PO4-KCl-H2O与NH4H2PO4-NH4Cl-H2O的283.15 K时溶解平衡常数通过Pitzer方程拟合实验数据得到,同3.3节中的拟合方法,计算结果:KCl,3.026 88;KH2PO4,-0.726 53;NH4Cl,2.270 98;NH4H2PO4,-0.885 58。
3.5 溶解度的理论计算
相图上任一单变线上的某一点(包括共饱和点),都可通过平衡固相的溶解平衡常数与Pitzer方程关联求得。由3.3节及3.4节中已经求得的混合离子作用参数及溶解平衡常数,应用Pitzer方程对三元体系KH2PO4-KCl-H2O与NH4H2PO4-NH4Cl-H2O 283.15 K时的溶解度做了理论计算,结果见表1与表2。其中KH2PO4-KCl-H2O系统的相对平均偏差为0.046,均方根差为0.29,NH4H2PO4-NH4Cl-H2O系统的相对平均偏差为0.044,均方根差为0.31,溶解度理论计算结果与实验值基本一致。
4 结论
采用等温溶解平衡法研究了三元体系KH2PO4-KCl-H2O、NH4H2PO4-NH4Cl-H2O在283.15 K时的相平衡,并依据湿渣法与X射线衍射相结合的方法鉴定了平衡固相的组成与结构,为多元体系相平衡研究提供了参考。结果表明,每个相图包含1个不变点、2条单变量曲线和3个结晶区,2个体系均为简单共饱和型体系。三元体系KH2PO4-KCl-H2O共饱和点液相组成:w(KCl)=22.99%、w(KH2PO4)=2.93%、w(H2O)=74.08%,平衡固相为磷酸二氢钾与氯化钾的混合物,该体系中无固溶体和加合物形成;三元体系NH4H2PO4-NH4Cl-H2O共饱和点液相组成:w(NH4H2PO4)=4.47%、w(NH4Cl)=23.64%、w(H2O)=71.89%,平衡固相为磷酸二氢铵与氯化铵的混合物,该体系中无固溶体和加和物形成。
将Pitzer电解质溶液理论运用到简单三元体系KH2PO4-KCl-H2O、NH4H2PO4-NH4Cl-H2O中,计算出了体系的饱和溶解度数据,其中KH2PO4-KCl-H2O体系的相对平均偏差为0.046,均方根差为0.29,NH4H2PO4-NH4Cl-H2O体系的相对平均偏差为0.044,均方根差为0.31,溶解度理论计算结果与实验值基本一致。在相平衡计算中,考虑了非对称混合离子作用参数的影响,提高了溶解度的计算精度。由实验测得的溶解度数据,通过多元线性回归法拟合了K+、Cl-、H2PO4-及NH4+、Cl-、H2PO4-之间的混合离子作用参数和溶解平衡常数。
