痛风湿热蕴结型患者外周血淋巴细胞亚群特点分析
2020-11-20杨亚旭张芳
杨亚旭 张芳
【摘 要】目的:探究痛风湿热蕴结型患者外周血淋巴细胞亚群特点。方法:选取2019年1月至2019年12月在南京中医药大学附属中西医结合医院风湿免疫科门诊就诊的湿热蕴结型痛风患者96例,健康体检者50例。通过流式细胞分析仪检测外周抗凝血淋巴细胞中总T淋巴细胞、辅助/诱导T淋巴细胞、抑制/细胞毒T细胞、NK细胞、B淋巴细胞等细胞数量。结果:湿热蕴结型痛风组患者淋巴细胞、抑制/细胞毒T淋巴细胞与对照组比较,差异有统计学意义(P < 0.05);女性痛风患者总T淋巴细胞、辅助/诱导淋巴细胞明显低于男性患者,差异有统计学意义(P < 0.05)。排泄不良型患者NK细胞明显低于生成过多型及混合型,差异有统计学意义(P < 0.05);排泄不良型痛风患者B淋巴细胞明显低于混合型,差异有统计学意义(P < 0.05)。结论:不同性别患者淋巴细胞亚群分析具有差异;不同尿酸排泄类型湿热蕴结型痛风患者间T淋巴细胞无明显差异,但排泄不良型患者B淋巴细胞、NK细胞数目明显低于另外2种类型。
【关键词】 痛风;湿热蕴结型;尿酸排泄;淋巴细胞亚群
痛风(gout)是一种慢性炎症性疾病,主要由于嘌呤代谢失衡、血清尿酸升高而引起关节复发性炎症和功能障碍,全世界范围内患病率近年来持续上升。美国国家健康和营养检查调查,经医生诊断上报的痛风患病率从26.4‰(1988年至1994年)上升到37.6‰(2007年至2010年)[1]。如果不进行有效干预,反复发作可导致慢性痛风,最终可导致关节损伤、畸形、残疾[2-3]。世界卫生组织2010年全球疾病负担研究表明,1990年至2010年,痛风的伤残调整生命年(DALYs)延长了1倍[4]。淋巴细胞亚群可以有效反映机体的免疫功能情况,先天性免疫途径在痛风的发病中至关重要。淋巴细胞依据其表面标志物及生物学功能大致分为T淋巴细胞(CD3+细胞)、B淋巴细胞(CD3-CD19+细胞)和NK细胞(CD3-CD16+/56+细胞)3个亚群,此外T淋巴细胞还可以进一步分为辅助/诱导T淋巴细胞(CD3+CD4+细胞)和抑制/细胞毒T淋巴细胞(CD3+CD8+细胞)[5]。痛风的中医证型主要分为湿热蕴结证、湿瘀阻痹证、湿热夹瘀证、脾虚湿阻证、肝肾阴虚证5型。郭泽莹等[6]对
172例痛风患者进行统计分析后发现,湿热蕴结证比例达41.9%。目前,对淋巴细胞亚群分析的关注度越来越高,但对于痛风与淋巴细胞亚群的阐述较少,故本文主要分析湿热蕴结型痛风患者的淋巴细胞亚群特点。
1 资料与方法
1.1 临床资料 选取2019年1月至2019年12月在江苏省中西医结合医院风湿免疫科门诊就诊的湿热蕴结型痛风患者96例为痛风组,男88例,女8例;平均年龄(52.53±17.32)岁;平均病程(5.81±4.59)年;平均尿酸水平(494.07±109.1)μmol·L-1[男(495.26±107.98)μmol·L-1,女(492.88±143.11)μmol·L-1];其中尿酸生成过多型5例(5.21%),排泄不良型80例(83.33%),混合型11例(11.46%)。同时选取50例健康体检者为对照组,男34例,女16例;平均年龄(51.40±18.07)岁。所有痛风患者均满足2015年美国风湿病学会(ACR)/欧洲抗风湿病联盟(EULAR)痛风诊断标准[7]及2012年《中医病证诊断疗效标准》中痛风湿热蕴结型诊断标准[8]。排除合并其他免疫性疾病或代谢性疾病者;合并严重的心、肝、肺、肾等脏器功能损害,恶性肿瘤,有病毒感染者,妊娠及哺乳期妇女;近2周有感染性疾病者。
1.2 研究方法 用抗凝采血管采集患者空腹静脉血2 mL。使用美国贝克曼公司FC-500流式细胞分析仪检测各部分细胞比例。总T淋巴细胞为CD3+T细胞,辅助/诱导T淋巴细胞为CD3+CD4+细胞,抑制/细胞毒T细胞为CD3+CD8+细胞,NK细胞为CD3-CD16+/56+细胞,B淋巴细胞为CD3-CD19+细胞。
1.3 统计学方法 采用SPSS 24.0软件进行统计分析。计量资料符合正态分布以表示,2组间比较采用t检验,多组间进行单因素方差分析,组间进行多重比较;不符合正态分布者转化为正态分布后行统计分析。以P < 0.05为差异有统计学意义。
2 结 果
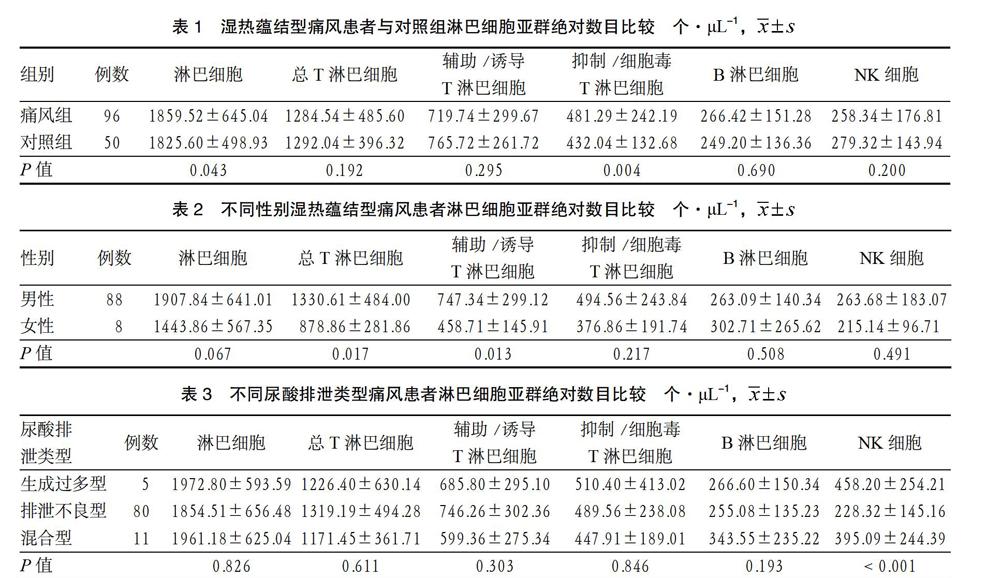
2.1 湿热蕴结型痛风患者与对照组淋巴细胞亚群比较 湿热蕴结型痛风组患者的淋巴细胞、抑制/细胞毒T淋巴细胞高于对照组,差异有统计学意义(P < 0.05)。总T淋巴细胞、辅助/诱导T淋巴细胞、B淋巴細胞、NK细胞2组间比较,差异无统计学意义(P > 0.05)。见表1。
2.2 不同性别湿热蕴结型痛风患者淋巴细胞亚群比较 女性痛风患者总T淋巴细胞、辅助/诱导细胞淋巴细胞明显低于男性患者,差异有统计学意义(P < 0.05)。淋巴细胞、抑制/细胞毒T淋巴细胞、B淋巴细胞、NK细胞2组间比较,差异无统计学意义(P > 0.05)。见表2。
2.3 不同尿酸排泄类型患者淋巴细胞亚群比较 排泄不良型痛风患者NK细胞明显低于生成过多型及混合型,差异有统计学意义(P < 0.05);其他细胞组间比较,差异无统计学意义(P > 0.05)。见表3。
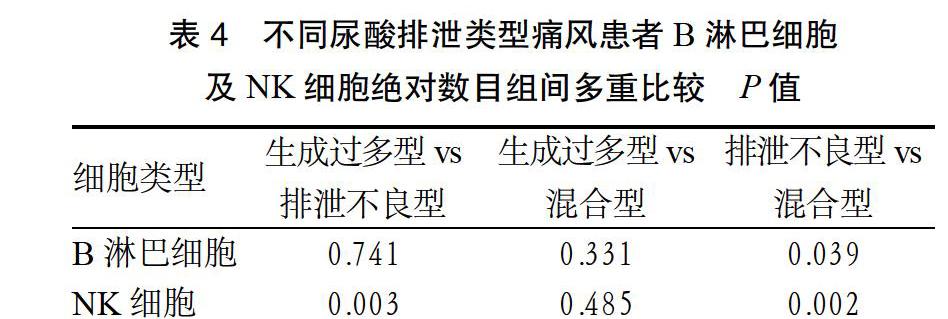
2.4 不同尿酸排泄类型患者B淋巴细胞及NK细胞组间多重比较 排泄不良型痛风患者B淋巴细胞与混合型比较,差异有统计学意义(P < 0.05)。排泄不良型痛风患者NK细胞与生成过多型及混合型比较,差异有统计学意义(P < 0.05)。见表4。
3 讨 论
痛风是炎症性关节炎的最常见原因,发达国家和发展中国家的发病率和患病率均在增加[9]。2017年全球痛风估计为744万例(发病率0.097%),患病率为0.54%,造成128万DALYs(占所有DALYs的0.051%)。痛风的患病人群男性均高于女性,引起的经济负担也呈线性增加[10]。痛风属中医学“痹病”“白虎病”“历节风”范畴。张有为等[11]发现,湿热蕴结证痛风占56.99%,提示湿热蕴结是临床痛风的常见中医证型。体内尿酸水平的平衡主要依靠尿酸生成和排泄来维持。尿酸的排泄主要通过肠道和肾脏,肾小球滤过、重吸收和分泌是个复杂的过程。一般情况下,约90%的肾小球滤过尿酸盐被重吸收回血液中,只有10%左右被排泄。但是,大多数痛风患者的尿酸排泄效率低下,导致高尿酸血症。超过90%的痛风患者属于尿酸排泄不良型[12]。
T淋巴细胞介导细胞免疫,反映了机体总体细胞的免疫状态,B淋巴细胞介导体液免疫,NK细胞介导固有免疫。NK细胞属于固有淋巴样细胞,其主要功能是为生物体提供针对感染、自体转化细胞和同种异体细胞产生快速免疫反应[13-14]。辅助/诱导T淋巴细胞辅助机体完成各种免疫活动,Th17细胞和Treg细胞是其中两种亚型,Th17细胞通过分泌白细胞介素(IL)-17、IL-6等多种炎症因子介导炎症反应,而Treg分泌IL-10等抑炎因子发挥抑制自身免疫应答的作用,在机体受病毒侵袭时第一时间进行防御和消灭[15]。抑制/细胞毒T淋巴细胞可抑制机体的免疫应答,只有两者保持动态平衡才能维持机体正常的细胞免疫[16]。NK细胞不需要用抗原引发即可完全发挥功能,通过识别主要组织相容性复合体Ⅰ类分子或直接与细胞表面配体结合从而直接杀死靶细胞。NK细胞是最早到达组织炎症部位并通过释放大量包括γ干扰素等细胞因子来对抗感染、肿瘤等免疫应答的固有免疫细胞[17]。
本研究发现,痛风患者辅助/诱导T淋巴细胞、NK细胞略低于对照组,而B淋巴细胞、抑制/细胞毒T淋巴细胞略高于对照组,可见痛风性关节炎疾病发展也与整体免疫失衡相关。余文戈等[18]同样发现,痛风患者体内NK细胞数量较正常对照组明显减少,考虑可能与其参与体内炎症反应有关;同时发现,痛风患者CD4+T细胞较正常对照组升高,考虑可能与巨噬细胞释放出抗原信息传递给CD4+
T细胞有关。本研究发现,痛风湿热蕴结型患者辅助/诱导T淋巴细胞较对照组略减少;平时临床观察发现,男性吸烟患者辅助/诱导T淋巴细胞较正常组减少。痛风患者常合并不良饮食及烟酒等生活习惯,此结果可能也与此有关,但具体原因仍需后期进一步明确。痛风湿热蕴结型患者抑制/细胞毒T淋巴细胞明显高于对照组,考虑痛风使免疫功能调节发生障碍,抑炎因子分泌量随之减少,使得机体处于免疫抑制状态。排泄不良型患者NK细胞含量较另外2组下降更加明显,具体原因是否与患者血尿酸水平、饮食生活习惯、病程、是否合并痛风石等相关,仍需后续进一步研究明确。刘炳等[19]对四川宜宾健康成人外周淋巴细胞亚群进行分析后发现,不同地区患者在年龄、性别间存在差异。本研究也发现,不同性别患者在淋巴细胞亚群间存在差异。但此次研究湿热蕴结型痛风女性患者、混合型、生成过多型患者样本量较少,仍需后续大样本继续研究。
参考文献
[1] JURASCHEK SP,MILLER ER,GELBER AC.Body mass index,obesity,and prevalent gout in the United States in 1988—1994 and 2007—2010[J].Arthritis Care Res(Hoboken),2013,65(1):127-132.
[2] 李丹,张剑勇.痛风现代流行病学及降尿酸药物研究进展[J].风湿病与关节炎,2016,5(4):73-76.
[3] PASCART T,NORBERCIAK L,EA HK,et al.Patients with early-onset gout and development of earlier severe joint involvement and metabolic comorbid conditions:results from a cross-sectional epidemiologic survey[J].Arthritis Care Res,2019,71(7):986-992.
[4] SMITH E,HOY D,CROSS M,et al.The global burden of gout:estimates from the global burden of disease 2010 study[J].Ann Rheum Dis,2014,73(8):1470-1476.
[5] 周建光,杨梅,曹海涛,等.淋巴细胞亚群的检测在临床的应用[J].东南国防医药,2015,17(3):298-300,321.
[6] 郭澤莹,张剑勇,张燕英,等.岭南地区痛风危险因素与中医证型相关性分析[J].中医药导报,2018,24(1):57-59,63.
[7] NEOGI T,JANSEN TL,DALBETH N,et al.2015 Gout classification criteria:an American College of Rheumatology/European League Against Rheumatism collaborative initiative[J].Ann Rheum Dis,2015,74(10):1789-1798.
[8] 国家中医药管理局.中医病证诊断疗效标准[M].北京:中国医药科技出版社,2012:46.
[9] WEIFENG ZHU,YAN DENG,XIAODONG ZHOU.Multiple Membrane Transporters and Some Immune Regulatory Genes are Major Genetic Factors to Gout[J].
Open Rheumatol J,2018,24(12):94-113.
[10] CAMILLA MATTIUZZI,GIUSEPPE LIPPI.Recent updates on worldwide gout epidemiology[J].Clin Rheumatol,2019,39(4):1061-1063.
[11] 张有为,杨军琪,李小宏.痛风患者的中医证型及发病特点[J].临床医学研究与实践,2018,3(36):136-138.
[12] PEREZ-RUIZ F,CALABOZO M,PIJOAN JI,et al.Effect of urate-lowering therapy on the velocity of size reduction of tophi in chronic gout[J].Arthritis Rheum,2002,47(4):356-360.
[13] ALEXANDER J DAVIES,SIMON RINALDI,MICHAEL COSTIGAN,et al.Cytotoxic Immunity in Peripheral Nerve Injury and Pain[J].Front Neurosci,2020,12(14):142.
[14] DEL ZOTTO G,MARCENARO E,VACCA P,et al.Markers and function of human NK cells in normal and pathological conditions[J].Cytometry B Clin Cytom,2017,92(2):100-114.
[15] 吳翠萍,赵利.外周血T淋巴细胞亚群变化特点及血清因子表达水平的研究[J].检验医学与临床,2018,15(4):523-525.
[16] 李亚波,林云,邹映东,等.恶性肿瘤患者免疫功能与抗核抗体的关系研究[J].检验医学与临床,2019,16(1):48-50.
[17] S?BASTIEN VIEL,R?MI PESCARMONA,ALEXANDRE BELOT,et al.A Case of Type 2 Hypersensitivity to Rasburicase Diagnosed with a Natural Killer Cell Activation Assay[J].Front Immunol,2018,21(9):110.
[18] 余文戈,管金菊.痛风患者外周血淋巴细胞亚群分布异常的临床研究[J].中国卫生检验杂志,2019,29(14):1721-1723.
[19] 刘炳,郭欣,郑凡,等.四川省宜宾地区健康成人外周血淋巴细胞亚群参考区间的建立[J].现代检验医学杂志,2019,34(5):101-105.
收稿日期:2020-03-21;修回日期:2020-05-01
