噻虫嗪对鲫鱼的急性毒性和抗氧化酶及乙酰胆碱酯酶活性的影响
2020-11-20孟立霞
王 召,彭 舒,孟立霞
( 1.凯里学院 大健康学院,贵州 凯里 556011; 2.贵州大学 昆虫研究所,贵州山地农业病虫害重点实验室,贵州 贵阳 550025 )
现代化工业技术发展的一个重要标志是大量化学合成物质的使用,但这些化学物质在给人类社会生活带来进步和好处的同时也给环境造成了严重的负面压力。目前我国使用的农药中70%是杀虫剂,年使用量达1.015×106t,仅有约1/3能被作物吸收,其余一部分通过地表径流、降雨等途径进入河流及海岸河口区域水体,成为水体中常规理化监测手段难以检测到的痕量有毒有机污染物[1-2]。水体的农药污染不仅危及水生生物安全,导致生态平衡被破坏,还可在生物体内富集积累[3]。目前,关于农药对水生生物如鱼类的研究主要集中在急性毒性及对不同组织酶活性的影响。如三唑酮对斑马鱼(Daniorerio)和稀有鲫(Gobiocyprisrarus)不同发育阶段的毒性效应大小不一致,表现为成鱼个体对三唑酮更为敏感[4]。王召等[5]测定了7种稻田常用杀虫剂对鲫鱼幼鱼的急性毒性,其中溴氰菊酯对其毒性最大。于振海等[6]研究了4种常用渔药对大鳞鲃(Barbuscapito)的急性毒性,其中毒性最大的为敌百虫。陈家长等[7]以不同质量浓度阿维菌素长期暴露鲤鱼(Cyprinuscarpio)后,5.6、7.5 μg/L质量浓度组的超氧化物歧化酶活性先升后降,而10、18 μg/L质量浓度组的超氧化物歧化酶活性逐渐下降。以氯虫苯甲酰胺(1/20半致死质量浓度)暴露南亚野鲮(Labeorohita),其鳃、肝脏、肾脏和肌肉4种组织中过氧化氢酶和超氧化物歧化酶活性均显著被诱导[8];甲基对硫磷和毒死蜱(1/4、1/8、1/10半致死质量浓度)处理孔雀鱼(Poeciliareticulata),其脑、鳃和肝脏中过氧化氢酶和超氧化物歧化酶活性均上升[9]。
噻虫嗪是第2代新烟碱类高效、低毒杀虫剂,不仅具有独特的作用机制,而且具有触杀、胃毒、内吸活性,对防治刺吸式口器的害虫效果甚佳[10-11]。稻田养鱼作为一种传统的农业耕作模式,它既可以提高水稻栽培产量,又可以获得最大的农田生态经济效益。然而,在水稻种植期,常会遭受如白背飞虱(Sogatellafurcifera)、褐飞虱(Nilaparvatalugens)、稻纵卷叶螟(Cnaphalocrocismedinalis)等多种害虫的危害,喷施化学杀虫剂仍然作为防治水稻害虫的首选。此时,稻田内共养鱼类也必然因化学农药施用而受到影响,但目前关于噻虫嗪对鱼类影响的研究相对滞后,而噻虫嗪对鱼类生理生化方面的研究更是鲜见报道[12-14]。笔者以鲫鱼(Carassiusauratus)幼鱼为试验对象,先测定噻虫嗪对其的急性毒性,确定半致死质量浓度,然后以亚致死质量浓度噻虫嗪暴露鲫鱼幼鱼,研究噻虫嗪对其鳃、肝脏和脑中抗氧化酶及乙酰胆碱酯酶活性的影响,以期从生理生化方面探究噻虫嗪对鱼体的影响,为评价噻虫嗪的生态安全性提供参考资料,同时为该农药的合理使用提供一些借鉴依据。
1 材料与方法
1.1 试验材料
1.1.1 试验鱼类
试验用鲫鱼幼鱼,购自贵州大学农场水产养殖基地,平均体长为(11.48±0.79) cm,平均体质量为(19.81±2.40) g。试验前将购置的试验用鱼在实验室内驯养7 d以上,自然死亡率低于2%,驯养期间定时投放饵料。试验用水为充分曝气7 d的自来水,pH 7.0±0.5,驯养及试验期间不断充氧,溶解氧保持在(5±1) mg/L,试验水温(24±1) ℃。试验时,选取大小一致、健康、表皮无损伤的个体进行试验。
1.1.2 试验试剂及来源
96%噻虫嗪原药(南京盼丰化工有限公司);超氧化物歧化酶试剂盒、过氧化氢酶试剂盒、乙酰胆碱酯酶试剂盒、考马斯亮蓝总蛋白试剂盒和标准蛋白均购自南京建成生物工程研究所;其余试剂均为分析纯。
1.2 试验方法
1.2.1 噻虫嗪对鲫鱼幼鱼的急性毒性试验
参照文献[15]报道的半静态急性毒性试验方法。用丙酮将噻虫嗪稀释成一定质量浓度的母液,再根据预试验结果,稀释成5个试验质量浓度:24.35、28.73、33.90、40.00、47.20 mg/L;以丙酮作为对照。在预处理过的水族箱中分别配制上述质量浓度药液10 L,并随机投放试验鱼10尾,每个质量浓度5个平行。为确保药液质量浓度基本一致,试验每隔12 h换取药液1次,其他条件与驯养期间相同。处理24、48、72、96 h后统计各处理组试验鱼的死亡数,以玻璃棒轻轻触碰鱼体,无任何反应即视为死亡,并立即取出。
1.2.2 噻虫嗪对鲫鱼幼鱼组织酶活性影响试验
鱼类的染毒处理:根据急性毒性试验结果,采用1/2 96 h半致死质量浓度以下质量浓度为试验质量浓度(1、10 mg/L);以丙酮作为对照。在处理过的塑料方盆中分别配置上述质量浓度药液10 L,并随机投放鱼苗15尾,每处理设3个平行。试验条件同上。
组织样的处理:分别在染毒12、24、48、72、96 h后,从各处理组随机取样,每个平行取2尾。将取出的鱼用蒸馏水冲洗后,放入冰盘内解剖,分别取出鳃、脑和肝脏,用预冷的0.86%生理盐水清洗血液,再用滤纸拭干后称量质量,放入玻璃匀浆器中,按1∶9(g/mL)的比例加入生理盐水,在冰水浴条件下充分研磨,制备成10%的组织匀浆,4 ℃,3000 r/min离心10 min,取上清液进行酶活性测定。
超氧化物歧化酶活性单位定义:每毫克组织蛋白在1 mL反应液中超氧化物歧化酶抑制率达50%时所对应的超氧化物歧化酶量为1个酶活性单位;过氧化氢酶活性单位定义:每毫克组织蛋白每秒钟分解1 μmol的过氧化氢的量为1个酶活性单位;乙酰胆碱酯酶活性单位定义:每毫克组织蛋白在37 ℃保温6 min,水解反应体系中1 μmol/L基质为1个酶活性单位。
1.3 数据处理与分析
试验数据均采用SPSS 13.0软件进行统计分析,拟合毒力回归方程,并计算相关系数、半致死质量浓度及其95%置信区间。采用单因素方差分析进行差异性显著分析。
2 结果与分析
2.1 噻虫嗪对鲫鱼幼鱼的急性毒性
噻虫嗪对鲫鱼幼鱼的急性毒性测定结果见表1。由表1可知,鲫鱼幼鱼对噻虫嗪敏感,随着处理时间的延长,半致死质量浓度值呈减小趋势。噻虫嗪处理96 h时,半致死质量浓度值趋于平缓,为28.95 mg/L。根据我国《化学农药环境安全评价试验准则》的判定标准,噻虫嗪对鲫鱼幼鱼的毒性为低毒。
2.2 噻虫嗪胁迫对鲫鱼幼鱼肝脏和鳃超氧化物歧化酶活性的影响
低质量浓度(1 mg/L)和高质量浓度(10 mg/L)噻虫嗪处理鲫鱼幼鱼后,肝脏超氧化物歧化酶活性在12~96 h内呈先升后降的趋势(图1a)。当噻虫嗪质量浓度为1 mg/L时,在染毒12 h后,酶活性不断上升,24 h达到最大值[(54.96±0.92) U/mg](P<0.05);随着处理时间的延长,酶活性呈下降趋势,但总体上均高于对照,表明低质量浓度的噻虫嗪对肝脏超氧化物歧化酶活性具有一定的诱导作用。而10 mg/L质量浓度组在染毒12 h时,酶活性稍有升高,与对照组无显著性差异(P>0.05);随着暴露时间的延长,酶活性逐渐受到抑制,72 h活性值达到最低值,仅为对照组的54.73%(P<0.05)。

表1 噻虫嗪对鲫鱼幼鱼的急性毒性Tab.1 Acute toxicity of thiamethoxam to juvenile crucian carp C. auratus
不同质量浓度噻虫嗪处理鲫鱼幼鱼后,鳃组织中超氧化物歧化酶活性变化趋势与肝脏组织相似(图1b)。低质量浓度组(1 mg/L)处理后,酶活性逐渐升高,表现出一定的诱导作用,48 h达到最高值[(31.73±0.54) U/mg](P<0.05),此后,超氧化物歧化酶活性缓慢下降,96 h时基本恢复到正常水平,与对照组无显著性差异(P>0.05)。高质量浓度组(10 mg/L)在暴露24 h时鳃组织超氧化物歧化酶活性达到最高值,与对照组相比上升幅度为30.42%(P<0.05),随后逐渐下降。


图1 噻虫嗪胁迫对鲫鱼幼鱼不同组织超氧化物歧化酶活性的影响Fig.1 Effects of thiamethoxam on the superoxide dismutase activity in different tissues of juvenile crucian carp C. auratus a.肝脏; b.鳃;不同字母表示各处理组同一时间段上差异显著(P<0.05);下同.a.liver; b.gill; different letters indicate significant difference at the same time period at P<0.05; et sequentia.
2.3 噻虫嗪胁迫对鲫鱼幼鱼肝脏和鳃过氧化氢酶活性的影响
不同质量浓度噻虫嗪处理鲫鱼幼鱼后,在96 h内肝脏组织中过氧化氢酶活性均表现为先诱导后抑制(图2a)。其中,低质量浓度组(1 mg/L)在受试的12~48 h,酶活性呈现出明显的上升趋势,分别比对照组高出14.20%、26.98%和27.66%(P<0.05);此后酶活性呈降低趋势,96 h活性值显著低于对照组(P<0.05)。而高质量浓度组(10 mg/L)自受试后迅速升高,12 h酶活性显著上升,与对照组相比上升了28.07%(P<0.05);随着暴露时间的增加,酶活性逐渐下降,在48 h活力值明显低于对照组(P<0.05)。
在不同质量浓度噻虫嗪作用下,鲫鱼幼鱼鳃组织过氧化氢酶活性变化趋势与肝脏相似(图2b)。其中,低质量浓度组(1 mg/L)过氧化氢酶活性首先表现出显著的诱导效应,在处理12 h和24 h时分别较对照组升高24.75%和34.00%(P<0.05);随着处理时间的延长,酶活性受到不同程度的抑制。而高质量浓度组(10 mg/L)暴露12 h时,酶活性表现出略微的诱导作用,随着胁迫时间的延长酶活性显著被抑制(P<0.05)。
2.4 噻虫嗪胁迫对鲫鱼幼鱼脑组织乙酰胆碱酯酶活性的影响
噻虫嗪胁迫对鲫鱼幼鱼脑乙酰胆碱酯酶活性的影响见图3。不同质量浓度噻虫嗪胁迫对乙酰胆碱酯酶活性的影响在不同处理时间的表现各不相同,但变化的总体趋势均表现为先诱导后抑制。其中,低质量浓度组(1 mg/L)在处理24 h和48 h时,酶活性显著高于对照组(P<0.05),表现出一定的诱导作用;随着处理时间的增加,在处理72 h和96 h时,酶活性明显降低,表现出抑制作用(P<0.05)。高质量浓度组(10 mg/L)在处理12 h时,酶活性即明显升高,与对照组差异显著(P<0.05);随后逐渐降低,72 h时酶活性即被显著抑制(P<0.05)。

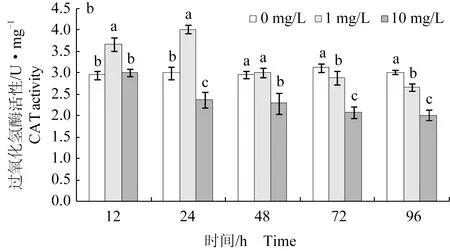
图2 噻虫嗪胁迫对鲫鱼幼鱼不同组织过氧化氢酶活性的影响Fig.2 Effects of thiamethoxam on the catalase activity in different tissues of juvenile crucian carp C. auratus

图3 噻虫嗪胁迫对鲫鱼幼鱼脑组织乙酰胆碱酯酶活性的影响Fig.3 Effects of thiamethoxam on acetylcholinesterase activity in brain of juvenile crucian carp C. auratus
3 讨 论
3.1 噻虫嗪对鲫鱼幼鱼的毒力
急性毒性试验即单次给药毒性试验,指机体(人或试验动物)一次(或24 h内多次)接触外来化合物之后所引起的中毒效应,甚至死亡[16-18]。急性毒性试验是推测新农药对非靶标生物的毒性强弱的重要手段。因此,急性毒性试验对了解农药的安全性非常必要。噻虫嗪对鲫鱼幼鱼的急性毒性试验结果表明,鲫鱼幼鱼对噻虫嗪敏感,随着处理时间的延长,半致死质量浓度值呈减小趋势。噻虫嗪处理96 h时,半致死质量浓度值趋于平缓,为28.95 mg/L。根据国家质量监督及检验检疫总局发布的《化学农药环境安全评价试验准则》[19]中农药对鱼类的毒性分级标准,噻虫嗪对鲫鱼幼鱼的毒性为低毒。
3.2 噻虫嗪对鲫鱼幼鱼抗氧化能力指标的影响
在正常情况下,生物体内各种生理活动能够有序进行。然而,当生物体受到外源性污染物胁迫时,会导致大量活性氧的产生,这些活性氧可能引起细胞膜发生脂质过氧化、引起超氧化物歧化酶、过氧化氢酶等抗氧化酶活性的改变,从而使生物体产生氧化应激反应[20-21]。超氧化物歧化酶是水生生物体内一种重要的抗氧化酶,其基本功能是催化超氧离子与氢离子生成过氧化氢,从而清除体内过高含量的超氧离子。已有研究表明,当鱼体处于轻度污染的环境中时,超氧化物歧化酶活性通常被诱导;而处于重度污染条件下,超氧化物歧化酶活性则被抑制,致使鱼体内活性氧大量积累,从而引起机体受到损伤[22]。本试验结果表明,在低质量浓度(1 mg/L)处理时,肝脏和鳃组织超氧化物歧化酶活性在测试初期即显著上升(P<0.05),说明超氧化物歧化酶在抵御低质量浓度噻虫嗪胁迫时发挥了重要作用,而随着暴露时间的延长和药剂质量浓度的增加,其活性逐渐被抑制。张景飞等[23]在研究20号柴油低质量浓度暴露对鲫鱼肝脏抗氧化防御系统的影响时发现,0.005 mg/L油污暴露能显著诱导超氧化物歧化酶活性,但随着污染暴露质量浓度的增加,超氧化物歧化酶活性又被抑制;此外,在2-硝基-4-羟基二苯胺胁迫对鲫鱼[24]肝脏抗氧化指标的影响及氨氮对异育银鲫(C.auratusgibelio)[25]“中科3号”幼鱼肝脏抗氧化酶系统的影响研究中,也均证实了上述观点。
过氧化氢酶也是水生生物体内参与活性氧代谢的一种非常重要的抗氧化防御酶,它能够催化超氧化物歧化酶歧化超氧离子产生的过氧化氢,生成水和氧气,从而减轻活性氧自由基对生物体的损伤[26-27]。本试验结果表明,不同质量浓度噻虫嗪对鲫鱼幼鱼组织过氧化氢酶活性均产生显著影响,两个质量浓度组鲫鱼幼鱼肝脏和鳃组织过氧化氢酶活性在暴露初期即显著上升(P<0.05),推测其原因可能是由于噻虫嗪暴露引起鱼体内活性氧自由基大量产生,从而诱导过氧化氢酶活性增强以清除鱼体中过量的活性氧自由基。但随着暴露时间的延长和药剂质量浓度的增加,过氧化氢酶活性呈现显著下降的趋势,这表明过氧化氢酶作为机体中抗氧化防御酶,其功能的有效性只局限于一定的范围内,一旦超出“毒物兴奋效应”期后,其功能也势必受到影响,这与用除草剂阿特拉津暴露鲫鱼时其肝脏、肾脏和肌肉组织过氧化氢酶活性先升后降的变化趋势相同[28]。
3.3 对鱼类脑组织乙酰胆碱酯酶的影响
乙酰胆碱酯酶广泛存在于无脊椎动物和脊椎动物体内,它是保证生物神经信号正常传递的一种关键酶,主要存在于胆碱能神经末梢突触间隙,可快速降解神经递质乙酰胆碱,终止其对乙酰胆碱受体的兴奋作用,以保持神经传导的正常进行[29]。目前,乙酰胆碱酯酶已被公认为是检测有机磷和氨基甲酸酯类杀虫剂污染的理想生物标志物[30-31],然而,亦有研究报道其他一些无机或有机污染物也可引起乙酰胆碱酯酶活性的变化。王学峰等[20]研究表明,汞离子质量浓度为0.005、0.025 mg/L时,暴露12 h,红鳍笛鲷(Lutjanuserythropterus)脑组织乙酰胆碱酯酶活性显著增加,随着暴露时间的延长(24~96 h),其活性受到不同程度的抑制。王丽等[21]研究高效氯氰菊酯对斑马鱼不同组织乙酰胆碱酯酶活性的影响时发现,一定质量浓度的高效氯氰菊酯会诱导乙酰胆碱酯酶活性,而高质量浓度即表现出抑制作用。本试验结果表明,低质量浓度(1 mg/L)的噻嗪酮暴露24 h后即可诱导脑乙酰胆碱酯酶活性显著升高,而高质量浓度(10 mg/L)暴露12 h后即表现出显著的诱导作用,随着暴露时间的延长,诱导作用逐渐被抑制作用所取代,这种作用势必会干扰乙酰胆碱的降解速度,使乙酰胆碱与其受体的作用无法正常终止,从而导致鲫鱼幼鱼长期保持兴奋状态[32]。
4 结 论
(1)本试验结果表明,噻虫嗪对鲫鱼幼鱼的96 h半致死质量浓度为28.95 mg/L。根据农药对鱼类的毒性分级标准,噻虫嗪对鲫鱼幼鱼的毒性为低毒。
(2)在噻虫嗪胁迫下,鱼体超氧化物歧化酶、过氧化氢酶、乙酰胆碱酯酶活性发生了较低变化,表明噻虫嗪胁迫可引起鲫鱼幼鱼抗氧化防御系统和神经系统的功能紊乱,从而影响鱼类的正常生长发育。
