血清胃泌素-17、胃蛋白酶原Ⅰ、胃蛋白酶原Ⅱ、同型半胱氨酸在萎缩性胃炎患者表达的临床意义
2020-11-19雷洪军曹丽鹏
雷洪军,潘 金,曹丽鹏,姚 勇
(四川省遂宁市中心医院消化内科,四川 遂宁 629000)
慢性萎缩性胃炎是一种消化系统慢性炎症性疾病,发病率较高,与胃癌的发生联系紧密,现已普遍认为,慢性萎缩性胃炎是胃癌癌前病变的重要病理时期[1]。因此,及时检出慢性萎缩性胃炎,并积极给予干预措施,以减少胃癌发生率,对我国胃癌防控工作非常重要。胃泌素-17(G-17)、胃蛋白酶原Ⅰ(PGⅠ)及胃蛋白酶原Ⅱ(PGⅡ)均为胃黏膜腺体分泌的辅助性消化因子、内源性消化酶,与慢性萎缩性胃炎发生也有关,甚至能预测胃癌发生风险,在慢性胃部疾病诊疗中占据重要地位[2]。而同型半胱氨酸(Hcy)具有细胞毒性、神经毒性及基因毒性,国内外学者[3,4]还表示,Hcy在恶性肿瘤的发生发展中具有一定作用。近年研究[5]指出,Hcy在早期胃癌筛查中发挥积极作用。本研究回顾性分析我院91例慢性萎缩性胃炎患者、72例非萎缩性胃炎患者及42例健康体检者临床资料,以评估血清G-17、PGⅠ、PGⅡ、Hcy在慢性萎缩性胃炎中的表达水平及其意义,为胃癌癌前病变的筛查提供新思路。
1 资料与方法
1.1 一般资料2017年5月至2019年12月我院收治的91例慢性萎缩性胃炎患者(萎缩性胃炎组)及72例非萎缩性胃炎患者(非萎缩性胃炎组)。纳入标准:①符合《中国慢性胃炎共识意见(2017年,上海)》[6]诊断标准且经胃镜及病理组织活检证实为萎缩性胃炎或非萎缩性胃炎;②年龄>18岁;③临床资料完整。排除标准:①近1个月内服用非甾体类抗炎药、抑酸药、胃黏膜保护剂、抗癫痫药、利尿药等影响本研究结果的相关药物;②近1周内使用阿司匹林、华法林等抗凝药物;③既往胃部手术史;④合并消化道出血、恶性肿瘤、胃部肿物、消化性溃疡;⑤伴严重心、肝、肾等器官功能障碍;⑥免疫系统功能异常;⑦伴甲状腺功能减退、严重贫血、严重硬皮病。并纳入42例同期健康体检者作为健康对照组(经性别、年龄匹配)。
1.2 方法萎缩性胃炎组及非萎缩性胃炎组患者收集胃镜检查前或检查后12 h空腹外周静脉血,健康对照组收集体检当日空腹外周静脉血;采用酶联免疫吸附法(试剂盒由芬兰必欧瀚生物技术有限公司生产)检测血清G-17、PGⅠ、PGⅡ水平,采用免疫比浊法(试剂盒由美国贝克曼库尔特公司生产)检测血清Hcy水平。
1.3 统计学方法采用SPSS 21.0软件分析数据。计量资料两组比较采用t检验,三组比较采用方差分析;计数资料比较采用χ2检验;诊断价值分析采用受试者工作特征曲线(ROC),计算其曲线下面积(AUC)。P<0.05为差异有统计学意义。
2 结果
2.1 三组一般资料及血清G-17、PGⅠ、PGⅡ、Hcy水平比较三组性别、年龄等一般资料及血清PGⅡ水平比较,差异无统计学意义(P>0.05);血清G-17、PGⅠ比较,萎缩性胃炎组<非萎缩性胃炎组<健康对照组;血清Hcy比较,萎缩性胃炎>非萎缩性胃炎组>健康对照组(P<0.05)。见表1。

表1 三组一般资料及血清G-17、PGⅠ、PGⅡ、Hcy水平比较
2.2 血清G-17、PGⅠ、Hcy对慢性萎缩性胃炎的诊断价值血清G-17、PGⅠ、Hcy对慢性萎缩性胃炎均具有较高诊断价值(P<0.05),其Cut-off值分别为7.135 pmol/L、85.865 ng/ml、17.090 μmol/L,见表2。
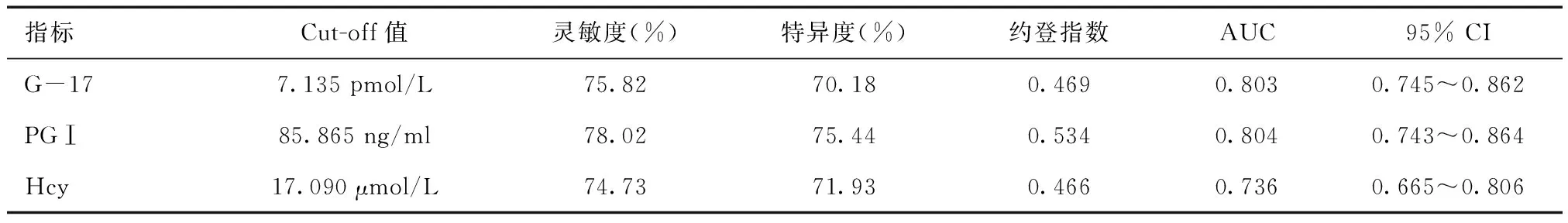
表2 血清G-17、PGⅠ、Hcy对慢性萎缩性胃炎的诊断价值
2.3 慢性萎缩性胃炎患者不同萎缩部位组血清G-17、PGⅠ、PGⅡ、Hcy水平比较91例慢性萎缩性胃炎患者中,胃体萎缩组14例,胃窦萎缩组57例,全胃萎缩组20例;三组血清G-17比较,胃窦萎缩组<全胃萎缩组<胃体萎缩组;血清PGⅠ比较,胃窦萎缩组>全胃萎缩组>胃体萎缩组(P<0.05);血清PGⅡ比较,差异无统计学意义(P>0.05);胃体萎缩组、全胃萎缩组血清Hcy比较,差异无统计学意义(P>0.05),但均高于胃窦萎缩组(P<0.05);见表3。

表3 慢性萎缩性胃炎患者不同萎缩部位组血清G-17、PGⅠ、PGⅡ、Hcy水平比较
3 讨论
PGⅠ、PGⅡ均由胃肠黏膜上皮细胞分泌,其中PGⅠ主要由胃体及胃底黏膜分泌,PGⅡ可由胃窦、十二指肠、幽门等黏膜分泌,故在胃肠黏膜炎症病变时可出现表达水平变化[7]。临床研究[8]发现,在萎缩性胃炎中,腺体及主细胞数量减少,使PGⅠ分泌急剧降低,但分泌PGⅡ的腺体分布广泛,血清波动幅度较小。本研究也发现,三组血清PGⅠ比较,萎缩性胃炎<非萎缩性胃炎组<健康对照组,而血清PGⅡ水平无明显差异,与国内学者[9]研究结果一致。这也提示,PGⅠ对萎缩性胃炎的筛查效果更好,血清PGⅡ则因其分泌范围广而筛查效果不佳。且血清PGⅠ对慢性萎缩性胃炎具有较高诊断价值,其Cut-off值为85.865 ng/ml。也证实,血清PGⅠ在慢性萎缩性胃炎筛查中发挥重要作用。85.865 ng/ml也可供临床参考。但本研究样本量有限,研究结果还需后续大样本量研究的支持。本研究还发现,不同萎缩部位者血清PGⅠ比较,胃窦萎缩组>全胃萎缩组>胃体萎缩组。考虑该结果与PGⅠ主要由胃体及胃底黏膜分泌,在胃体、胃底及全胃发生萎缩性病变时,分泌显著降低有关[10]。该结果也说明,血清PGⅠ表达水平对慢性萎缩性胃炎诊断有积极意义。
另外,G-17作为胃泌素的主要活性成分,具有刺激胃酸及胃蛋白酶分泌作用,还能促黏膜生长,于调节胃肠道功能也有利[11]。在胃窦萎缩时,胃窦G细胞急剧减少,分泌能力降低,导致血清G-17含量减少[12]。本研究也发现,三组血清G-17比较,萎缩性胃炎<非萎缩性胃炎组<健康对照组。表明血清G-17对慢性萎缩性胃炎筛查具有一定作用。经ROC曲线分析,也发现血清G-17对慢性萎缩性胃炎具有较高诊断价值,与孟丽英等[13]研究一致。且其Cut-off值为7.135 pmol/L。也提示,在普查血清<7.135 pmol/L时,发生慢性萎缩性胃炎风险较高,应积极进行进一步检查,以尽早发现胃癌癌前病变。然而,慢性萎缩性胃炎的萎缩部位也能影响G-17分泌,在萎缩局限于胃底或胃体时,胃酸分泌减少,对G细胞负反馈作用减轻,刺激G-17分泌增多。本研究也对不同萎缩部位患者G-17表达水平进行进一步分析,发现胃窦萎缩组血清G-17显著低于全胃萎缩组及胃体萎缩组。说明,血清G-17不仅能辅助筛查慢性萎缩性胃炎,还对判断病灶位置有利。
此外,本研究还发现,三组血清Hcy比较,萎缩性胃炎>非萎缩性胃炎组>健康对照组,血清Hcy对慢性萎缩性胃炎诊断价值较高。表明,Hcy在慢性萎缩性胃炎中表达显著升高,可作为胃癌癌前筛查的新指标,与穆素恩等[14]研究结果一致。分析其原因可能与慢性萎缩性胃炎患者消化及吸收功能减低,导致叶酸摄入减少,影响蛋氨酸循环,使Hcy在血液循环中大量堆积有关。不仅如此,胃体萎缩性胃炎及全胃多灶性胃炎的发生发展与自身免疫有一定关系,易引起胃酸及内因子缺乏,使维生素B12吸收受限,导致蛋氨酸循环障碍,Hcy进一步堆积。本研究中,胃体萎缩组、全胃萎缩组血清Hcy水平均高于胃窦萎缩组。也证实,胃体及全胃萎缩时,蛋氨酸循环受阻更严重,使血清Hcy水平更高。因此,临床还能通过观察血清PGⅠ、G-17、Hcy水平,评估慢性萎缩性胃炎萎缩部位,辅助临床诊疗。
综上所述,血清G-17、PGⅠ、Hcy不仅能辅助诊断慢性萎缩性胃炎,其表达水平还与萎缩发生部位有关,在慢性萎缩性胃炎筛查中具有重要作用,但PGⅡ分泌范围广泛,对慢性萎缩性胃炎诊疗影响较小。
