贝伐单抗联合PC 化疗方案对非小细胞肺癌恶性胸腔积液患者血清肿瘤标志物及免疫功能的影响
2020-11-18应乐
应乐
河南圣德医院,河南 信阳 464000
非小细胞肺癌(non-small cell lung cancer,NSCLC)为临床常见恶性肿瘤之一,占全部肺癌发生率的70%~85%,具有较高病死率[1]。恶性胸腔积液为NSCLC 常见并发症,主要因胸膜转移性肿瘤、胸膜弥漫性恶性间皮瘤所致,手术治疗可行性差,目前临床主要采用PC(顺铂+培美曲塞)化疗,但部分患者治疗效果欠佳。相关研究指出,血管内皮生长因子(vascular endothelial growth factor,VEGF)为恶性胸腔积液形成的重要介质,贝伐单抗为单克隆抗体,可抑制血管内生长因子受体,有助于减少腹水形成[2]。基于此,本研究选取我院86 例NSCLC 恶性胸腔积液患者为研究对象,旨在观察贝伐单抗联合PC 化疗方案对其血清肿瘤标志物及免疫功能的影响,现将观察结果报道如下。
1 资料与方法
1.1 一般资料
选取我院2018 年1 月—2019 年11 月诊治的NSCLC 恶性胸腔积液患者86 例,采用随机数字表法分为观察组(n=43)和对照组(n=43)。对照组:男27 例,女16 例;年龄41~72 岁,平均(56.44±6.03)岁;病理分型:鳞癌14 例、腺癌20 例、大细胞癌9 例;病理分期:Ⅲ期29 例、Ⅳ期14 例。观察组:男25 例,女18 例;年龄40~73 岁,平均(57.15±5.61)岁;病理分型:鳞癌13 例、腺癌22 例、大细胞癌8 例;病理分期:Ⅲ期28 例、Ⅳ期15 例。两组基线资料(性别、年龄、病理分型、病理分期)均衡可比(P>0.05)。本研究经我院伦理委员会审核批准。
1.2 纳入及排除标准
1.2.1 纳入标准经细胞学或组织病理学确诊;临床分期为Ⅲ~Ⅳ期;影像学检查明确为中等或大量胸腔积液;预计生存周期>6 个月;知情本研究并签署同意书。
1.2.2 排除标准近1 个月内行放化疗者;卡氏评分<60 分;合并严重感染;合并心功能不全;对本研究药物过敏者;合并肝肾功能损伤;合并其他恶性肿瘤;自身免疫功能缺陷。
1.3 治疗方法
两组均进行胸腔积液B 超定位检查,经胸腔穿刺留置中心静脉导管,定期引流胸腔积液。
对照组:采用PC 方案化疗。第1 d 给予注射用培美曲塞二钠(江苏奥赛康药业,批准文号:H1903031)500 mg/m2静脉滴注;第1、3 d 给予注射用顺铂(齐鲁制药,批准文号:H20043889)75 mg/m2,胸腔内注射,分2 次完成。21 d 为1 个周期。
观察组:于对照组基础上加用贝伐珠单抗治疗。第1 d 给予贝伐单抗注射液(Roche Diagnostics GmbH,批准文号:S20170035)5 mg/kg,胸腔内注射。21 d 为1 个周期。
两组均持续治疗4 个周期。
1.4 观察指标
(1)客观有效率(ORR);(2)血清VEGF 水平。于治疗前、治疗4 个周期后,采用无菌真空采血管抽取患者空腹静脉血5 mL,离心分离10 min(3 500 r/min),取血清,采用双抗夹心酶免疫吸附法检测血清VEGF 水平,试剂盒购自上海康朗生物科技有限公司;(3)血清癌胚抗原(CEA)、糖类抗原125(CA125)水平。采用化学发光免疫分析法,测定CEA、CA125 水平,试剂盒均购自上海心语生物科技有限公司;(4)血清免疫学指标(CD3+、CD4+、NK+)。采用流式细胞仪测定CD3+、CD4+、NK+水平,配套试剂盒购自上海市酶联生物公司。所有检测均由检验科高年资医师依照仪器、试剂盒说明书完成操作。(5)不良反应(腹泻、皮疹、恶心呕吐、骨髓抑制)发生率。
1.5 疗效评估标准
采集患者胸腔积液评估疗效。完全缓解(CR):胸腔积液完全消失,且维持>4 w;部分缓解(PR):胸腔积液减少≥30%,且维持>4 w;稳定(SD):胸腔积液减少<30%或增加<20%,且症状不改善;进展(PD):胸腔积液增加≥20%。客观有效率(ORR)=(CR +PR)例数/总例数×100%。
1.6 统计学分析
采用SPSS 22.0 对数据进行分析。血清肿瘤标志物、免疫细胞水平以()表示,t检验,ORR、不良反应发生率以%表示,χ2检验。P<0.05表示差异有统计学意义。
2 结果
2.1 两组ORR比较
治疗4 个周期后,ORR 观察组(81.40%)高于对照组(60.47%),差异有统计学意义(P<0.05),见表1。

表1 两组ORR比较
2.2 两组血清肿瘤标志物水平比较
治疗前,两组血清VEGF、CEA、CA125 水平比较无显著差异(P>0.05);治疗4 个周期后,观察组血清VEGF、CEA、CA125 水平低于对照组,差异有统计学意义(P<0.05),见表2。
表2 治疗前后两组血清肿瘤标志物水平比较()
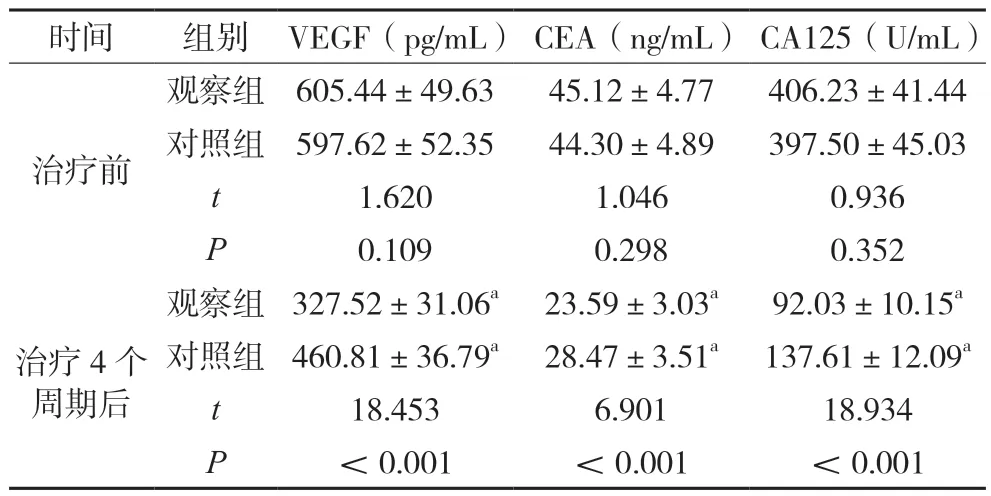
表2 治疗前后两组血清肿瘤标志物水平比较()
注:与本组治疗前比较,aP<0.05。
2.3 两组免疫细胞水平比较
治疗前,两组血清CD3+、CD4+、NK+水平比较无显著差异(P>0.05);治疗4 个周期后,观察组血清CD3+、CD4+、NK+水平高于对照组,差异有统计学意义(P<0.05),见表3。
表3 治疗前后两组免疫细胞水平比较() %

表3 治疗前后两组免疫细胞水平比较() %
注:与本组治疗前比较,aP<0.05。
2.4 两组不良反应发生率比较
观察组腹泻发生率、皮疹发生率、恶心呕吐发生率、骨髓抑制发生率与对照组比较无显著性差异(P>0.05),见表4。

表4 两组不良反应发生率比较 n(%)
3 讨论
NSCLC 患者初诊时约15%存在恶性胸腔积液,随着病情进展,50%患者最终可出现恶性胸腔积液,若未有效治疗,大量积液可造成压迫性肺不张及不可逆性肺功能损伤,严重影响患者生存质量[3]。因此,选择科学有效治疗方案、及时控制NSCLC 恶性胸腔积液患者病情进展至关重要。
PC 化疗为临床常用细胞毒性化疗方案,其中顺铂可结合肿瘤细胞DNA 碱基,抑制肿瘤细胞DNA 复制,进而降低肿瘤活性;培美曲塞作为新型抗叶酸代谢细胞毒药物,具有良好靶酶亲和力,通过干扰腺嘧啶及嘌呤生物合成,抑制肿瘤细胞增殖,二者联合应用可有效发挥抗肿瘤活性作用,但此方案仍具有较多局限性,部分患者治疗效果不理想[4]。相关研究发现,VEGF 由系膜细胞、肿瘤细胞等分泌,在恶性胸腔积液及肿瘤血管形成过程中具有强烈诱导作用[5]。贝伐单抗可抑制VEGF,阻断其生物学作用,避免肿瘤内血管形成及恶性胸水量增加,提高抗肿瘤效果,抑制胸腔积液产生。李彦磊等[6]研究报道,于常规化疗基础上加用贝伐单抗治疗NSCLC 恶性胸腔积液疗效显著,有效率达74.40%。本研究结果显示,ORR 观察组(81.40%)高于对照组(60.47%),两组不良反应发生率比较无显著差异,与上述研究结果一致,表明贝伐单抗联合PC 化疗方案治疗NSCLC 恶性胸腔积液,可抑制肿瘤发展进程,提高临床疗效,且安全性高。
肿瘤标志物为反映肿瘤生长及存在的一类物质,对肿瘤诊断、分期、疗效评估、预后判断具有重要意义。CA125 主要合成储存于细胞内,肿瘤浸润或组织恶变时释放入血,引起血清CA125 水平升高;CEA 为酸性糖蛋白,在肺腺癌患者中阳性表达率高达70%以上,与肿瘤复发具有一定相关性;VEGF水平升高可增加血管通透性,诱导恶性胸腔积液形成[7]。本研究结果显示,治疗4 个周期后,观察组血清VEGF、CEA、CA125水平低于对照组(P<0.05),提示贝伐单抗联合PC 化疗方案治疗NSCLC 恶性胸腔积液,可促进肿瘤细胞凋亡,有效控制胸腔积液,进而降低血清VEGF、CEA、CA125 水平。相关研究报道,NSCLC 恶性胸腔积液患者因肿瘤恶性消耗、化疗药物毒副作用等影响,易发生机体免疫功能低下,进而影响疾病治疗效果[8]。本研究结果显示,治疗4 个周期后,观察组血清CD3+、CD4+、NK+水平高于对照组(P<0.05),表明贝伐单抗联合PC化疗方案应用于NSCLC 恶性胸腔积液患者,可改善其免疫功能,但具体作用机制仍需进一步深入探究。
综上所述,贝伐单抗联合PC 化疗方案治疗NSCLC 恶性胸腔积液疗效显著,可降低血清VEGF、CEA、CA125 水平,改善机体免疫功能,且安全性高。
