组合酶对复合骨素酶解液呈味物质的影响
2020-11-18李晓瑞刘贵珊赵君哲余江泳张晓娟樊奈昀宁夏大学农学院宁夏银川7500抚顺独凤轩骨神生物技术股份有限公司辽宁抚顺
李晓瑞,王 梓,刘贵珊,*,赵君哲,余江泳,张晓娟,樊奈昀(.宁夏大学农学院,宁夏银川 7500;.抚顺独凤轩骨神生物技术股份有限公司,辽宁抚顺 3)
骨素是骨经过高温高压抽提、脱除油脂和浓缩得到的骨抽提物,其营养丰富,富含蛋白质、氨基酸、矿物质以及风味物质等,是生产调味品的重要基料[1]。牛骨素香精虽口感醇厚、肉味饱满,但是鲜味不足,生产过程中需要添加呈味核苷酸二钠来增强牛骨素香精的鲜味,增加生产成本。鸡骨素鲜味浓郁,且鸡骨原料相较于牛骨原料成本略低,通过两种骨素复合可以降低生产成本、达到改善牛骨素香精的鲜味、减少添加呈味核苷酸二钠的目的。目前,对牛骨素、鸡骨素、猪骨素的滋气味和加工性能的研究报道较多,但是对复合骨素报道较少[2-6]。
生物酶解技术是生产天然安全调味基料的常用方法,其反应条件温和、能耗低、污染少,反应进程定向、可控,在骨素风味形成中起到非常重要的调节作用[7]。用于酶解骨素蛋白的蛋白酶主要包括内切蛋白酶和外切蛋白酶。内切蛋白酶能识别特有的氨基酸序列,将连接氨基酸的酰胺键从酶切位点断开,得到长短不同的多肽和氨基酸[8]。外切蛋白酶作用于蛋白质或多肽分子氨基或羧基末端的肽键,释放末端的疏水性氨基酸,但是对于蛋白质内部肽键几乎没有作用,因此将外切酶与内切酶组合使用可以深度水解蛋白质,提高酶解液水解度,释放大量氨基酸和短肽[9]。目前,国内外研究主要集中于鸡骨素、牛骨素、猪骨素酶解种类的选择,对复合骨素酶种类的选择少有研究。乔凯娜等[10]通过研究红烧风味香精滋味物质,发现木瓜蛋白酶、风味蛋白酶和菠萝蛋白酶组合酶解猪肉,得到的红烧风味香精感官评分更高。董宪兵等[11]通过组合酶酶解鸡骨素工艺及风味物质研究表明,木瓜蛋白酶和风味蛋白酶的添加方式对鸡骨素风味物质有重要影响。徐欣如等[12]探究了单酶和组合酶对牛骨素热反应香精滋气味的影响,发现复合蛋白酶和风味蛋白酶组合酶解牛骨素效果最佳。Chiang等[13]通过探究美拉德反应对牛骨酶解液理化性质及风味成分的影响,发现风味蛋白酶酶解牛骨素可以改善牛骨酶解液风味。
本文以牛骨素和鸡骨素的复合骨素为研究对象,采用四种组合蛋白酶(木瓜蛋白酶+风味蛋白酶、菠萝蛋白酶+风味蛋白酶、碱性蛋白酶+风味蛋白酶、复合蛋白酶+风味蛋白酶)酶解复合骨素,通过测定水解度、游离氨基酸、呈味核苷酸、味精当量、肽分子量分布等呈味物质指标,探究组合酶种类对四种复合骨素酶解液呈味物质的影响,为复合骨素酶解深加工利用提供理论参考。
1 材料与方法
1.1 材料与仪器
清汤型牛骨素、鸡骨素 抚顺独凤轩骨神生物技术股份有限公司;复合蛋白酶(Protamex,47500 U/g)、风味蛋白酶(Flavourzyme,25000 U/g)、木瓜蛋白酶(Nematolyt,157000 U/g)、碱性蛋白酶(Alkaline proteinase,302420 U/g)、菠萝蛋白酶(Bromelain,600000 U/g) 丹麦诺维信公司;葡萄糖 源叶生物科技有限公司;甲醛、氢氧化钠、磺基水杨酸、盐酸、磷酸二氢钾、三氟乙酸 分析纯,国药集团化学试剂有限公司;甲醇、乙腈 色谱纯,飞赛尔科技(中国)有限公司;混合氨基酸标准品、核苷酸标准品(5′-GMP、5′-IMP和5′-AMP)、肽标准品(甘氨酸、抑肽酶、细胞色素C、杆菌肽、谷胱甘肽) 美国Sigma公司。
BSA224S-CW电子天平 赛多利斯科学仪器有限公司;HH-4数显恒温水浴锅、JI-1 精密增力电动搅拌器 国华电器有限公司;TSK-gel ODS-80 TM色谱柱(4.6 mm×250 mm) 美国J&W公司;TSK gel G2000 SWXL色谱柱(7.8 mm×300 mm) 日本岛津公司;1260高效液相色谱仪、AgilentEclipse XDB-C18柱 美国Agilent公司;8900全自动凯氏定氮仪 丹麦Foss公司。
1.2 实验方法
1.2.1 复合骨素酶解液的制备 取牛骨素(Brix=50%)70 g,鸡骨素(Brix=50%)30 g,按1∶1添加蒸馏水稀释,四种组合酶在pH为6.2的条件下,按表1条件酶解1 h后,90 ℃灭酶10 min,制得四种复合骨素酶解液,其中E/S为每克蛋白中酶活的添加量。

表1 复合骨素提取物酶解条件Table 1 Conditions for enzymatic hydrolysis of complex bone extract
1.2.2 水解度测定 氨基酸态氮采用甲醛滴定法进行测定[14]。准确吸取5 mL酶解液至100 mL容量瓶,并添加蒸馏水定容,从中取20 mL稀释液至烧杯中,加入60 mL蒸馏水混匀,在磁力搅拌状态下,用标定好的0.05 mol/L的NaOH溶液滴定至pH8.2,加入10 mL甲醛溶液后继续滴定至pH9.2,记录消耗的NaOH溶液体积。80 mL蒸馏水在相同条件下进行滴定,作为空白溶液。溶液中氨基酸态氮含量的计算公式为:
式中:x为溶液中氨基酸态氮的含量(g/100 g);V1为滴定样品时,pH从8.2~9.2所消耗的NaOH溶液体积(mL);V2为滴定空白溶液时,pH从8.2~9.2所消耗的NaOH溶液体积(mL);V3为参与反应的稀释液体积(mL);C为NaOH溶液浓度(C=0.05 mol/L)。
总蛋白质含量通过FOSS全自动凯氏定氮仪进行测定,消化程序为200 ℃消化30 min,升温至420 ℃消化1 h。水解度的计算公式为:
1.2.3 游离氨基酸含量的测定 参照Chungchunlam等[15]的方法,并稍作修改。取复合骨素酶解液2 mL、2 mL 40% 磺基水杨酸于10 mL离心管内,然后在10000 r/min下、4 ℃离心20 min,取上清液于50 mL离心管中,并用超纯水定容,过0.22 μm滤膜,待氨基酸分析仪上机。
氨基酸分析条件[16]:色谱柱为日立专用离子交换树脂(4.6 mm×60 mm),检测波长为440 nm;缓冲液流速35 mL/h;柱温 31~76 ℃;茚三酮溶液流速25 mL/h;进样量20 μL。
1.2.4 核苷酸含量的测定 参照Chen等[17]的方法,并稍作修改。取复合骨素酶解液1 mL于50 mL离心管内,加25 mL超纯水,然后在10000 r/min下、4 ℃离心20 min,取上清液于50 mL离心管中,并用超纯水定容,过0.22 μm滤膜,待HPLC测定。
高效液相色谱条件[18]:色谱柱为TSK-gel ODS-80 TM(4.6 mm×250 mm),柱温为30 ℃,紫外检测波长为254 nm,进样量为10 μL,流速为0.8 mL/min。流动相:洗脱液A为甲醇,洗脱液B为pH为5.4的0.05 mol/L磷酸二氢钾缓冲液;流动相经0.45 μm滤膜过滤后,在室温下超声脱气30 min。采用二元流动相进行梯度洗脱分离,检测时间为23 min,其中甲醇0.05 mol/L磷酸二氢钾随时间配比为:0 min:0~100%;11 min:10%~90%;18 min:0~100%;23 min:0~100%。
1.2.5 味精当量分析 鲜味氨基酸与核苷酸协同作用所产生的鲜味强度相当于一定浓度的单一味精所产生的鲜味强度[19],即为味精当量EUC(10-2g MSG/mL),计算式如下:
EUC=Σai×bi+1218(Σai×bi)(Σaj×bj)
式中:ai为鲜味氨基酸(Asp,Glu)的含量,g/100 mL;bi为鲜味氨基酸相对于谷氨酸钠(MSG)的相对鲜度系数,其中,Asp 的b值为0.077,Glu 的b值为1;aj为呈味核苷酸(5-IMP、5-GMP、5-AMP)的含量,g/100 mL;bj为呈味核苷酸相对于5-IMP 的相对鲜度系数,其中,5-IMP 的b值为1,5-GMP的b值为2.3,5-AMP的b值为0.18。
1.2.6 肽分子质量分布的测定 参照Chiang等[20]的方法,并稍作修改,采用高效液相色谱仪测定复合骨素酶解液分子量分布。色谱柱为TSK gel G2000 SWXL(7.8 mm×300 mm);柱温:40 ℃;流动相:A为体积分数为0.1%的三氟乙酸混合的45%(V/V)乙腈溶液;等梯度洗脱;流速:0.5 mL/min;进样体积:10 μL,于214 nm波长下测定响应值。
1.3 数据处理
曲线图的绘制采用origin 2017软件,显著性分析及相关性分析采用SPSS 19.0软件进行处理,每个实验在相同条件下重复三次。
2 结果与分析
2.1 水解度分析
酶的种类及水解度对复合骨素酶解液的风味有重要影响。图1为四种组合酶对复合骨素酶解液水解度的影响,A+F与P+F酶解液的水解度最大,分别为10.67%和11.27%(P>0.05)。复合蛋白酶是由内切蛋白酶、外切肽酶以及风味蛋白酶复合而成的,具有较多的切割位点,因此复合蛋白酶与外切风味蛋白酶组合酶解后水解度大[21]。碱性蛋白酶属于丝氨酸蛋白酶,能够切割芳香族或疏水性氨基酸残基的肽键,再与风味蛋白酶组合,其水解度也会相对较大[22]。N+F与B+F酶解液的水解度最小,分别为8.60%和8.40%,木瓜蛋白酶和菠萝蛋白酶属于半胱氨酸蛋白酶,也称为巯基蛋白酶,可作用于肽链中精氨酸和赖氨酸的羧基端,并对N-端具有二个羧基的氨基酸具有优先水解性[23]。

图1 蛋白酶对复合骨素酶解液水解度的影响Fig.1 Effect of protease on the degree of hydrolysis of compound osteolysin hydrolysate注:不同小写字母代表化合物在4种酶解液间的显著性差异(P<0.05);图2、表2~表5同。
2.2 游离氨基酸分析
蛋白酶的酶切位点决定了酶解产物中游离氨基酸的组成及含量,使酶解产物中游离氨基酸组成有较大的差异,同时,游离氨基酸的组成及含量对酶解液滋味有着重要影响[24]。如表2所示,不同复合骨素酶解液中游离氨基酸含量存在较大差异,A+F酶解液的总氨基酸含量最高,P+F酶解液次之,这可能由于碱性蛋白酶主要裂解疏水性氨基酸,与风味蛋白酶组合酶解后,制得的酶解液中含有大量的疏水性氨基酸[25]。复合蛋白酶是由多种蛋白酶复合而成,与风味蛋白酶组合酶解后,可从肽链的任意一端切下一个单位氨基酸残基,也可在多肽链的内部破坏肽键,进而提高蛋白水解度,并产生大量的游离氨基酸[26]。而N+F与B+F的水解度低,木瓜蛋白酶与菠萝蛋白酶的酶切位点主要为羧基端,易于释放苦味氨基酸,且酶切位点特异性强,所以N+F与B+F酶解液总游离氨基酸含量低。

表2 蛋白酶对复合骨素酶解液游离氨基酸的影响Table 2 Effect of protease on free amino acids in compound osteolysin hydrolysate
不同复合骨素酶解液中共检测到17种游离氨基酸。氨基酸根据其结构特性不同,可分为呈鲜味、甜味、苦味、无味氨基酸,呈味氨基酸含量高可以增加酶解液的鲜味、浓厚感和丰富度[27]。鲜味氨基酸包括天冬氨酸和谷氨酸,这两种氨基酸在A+F、P+F和N+F酶解液中含量较高,其中谷氨酸本身具有酸味,但和钠盐并存时,可以提供强烈的鲜味,是重要的鲜味氨基酸[28]。甜味氨基酸中的甘氨酸和丙氨酸在复合骨素酶解液中检出量较高,甘氨酸除了增强甜味,还可以改善酶解液的苦味[29]。同时,谷氨酸和丙氨酸共存时产生协同作用,可增强酶解液的鲜味[30]。A+F、P+F和B+F酶解液中苦味氨基酸含量最高,同时A+F与P+F酶解液中苯丙氨酸和亮氨酸含量较N+F与B+F酶解液更高。无味氨基酸包括酪氨酸、半胱氨酸和赖氨酸,半胱氨酸可以增强酶解液的肉香味,其中P+F酶解液中半胱氨酸含量最高,肉香味更强[31]。总的来说,酶解液中的游离氨基酸能赋予食物特定的味感,为Maillard反应制备热反应型肉味香精提供丰富底物。
2.3 呈味核苷酸分析
AMP、GMP、IMP是主要的低阈值呈鲜味物质,AMP由 ATP 降解产物生成还可以降解为IMP,GMP 是植物性食品如菌类食品中主要呈鲜物质,IMP 主要存在于动物性食品。AMP、GMP、IMP是肉类食品中主要的风味核苷酸,有助于提升肉质的鲜味[32]。本研究测定了四种复合骨素酶解液中3种核苷酸含量,如表3所示,四种酶解液中IMP含量最高,这可能由于复合骨素属于肉类食品,自身就含有大量的IMP,酶解后得到大量释放,以及AMP在酶解过程中发生降解反应,导致IMP含量相对于AMP和GMP较高[33-34]。同时,IMP与AMP有协同作用,且与天冬氨酸、谷氨酸等鲜味氨基酸共存时能增强复合骨素酶解液的鲜味和甜味[35]。四种酶解液中,A+F酶解液所含核苷酸含量最高,P+F酶解液次之,N+F酶解液核苷酸含量最低,有研究表明酶解液中水解度高低对核苷酸含量有影响[36],A+F与P+F酶解液的水解度较大,所以其核苷酸含量也相对较高。

表3 蛋白酶对复合骨素酶解液呈味核苷酸的影响Table 3 Effect of protease on taste-flavored nucleotides of compound osteolysin hydrolysate
2.4 味精当量分析
EUC表示鲜味氨基酸与呈味核苷酸的混合物协同作用所产生的鲜味强度,被用来衡量氨基酸与核苷酸的协同效应,是国际上通行的研究食品鲜味的分析方法[37]。如图2所示,A+F酶解液的EUC值最高为4.26×10-2g MSG/mL,其次是P+F酶解液的EUC为3.83×10-2g MSG/mL,B+F酶解液的EUC最低为2.73×10-2g MSG/mL,EUC表示鲜味氨基酸及呈味核苷酸之间的协同效应,其值的大小由鲜味氨基酸及呈味核苷酸含量共同决定。复合蛋白酶其酶切位点广泛,碱性蛋白酶主要裂解疏水性氨基酸,两种酶分别与外切酶风味蛋白酶组合酶解复合骨素,可增强酶解液水解度,产生大量游离氨基酸。因此,A+F与P+F酶解液的水解度大,其鲜味氨基酸和核苷酸含量也相对较高,有较为强烈的鲜味强度。同时,有研究表明甜味氨基酸与IMP协同作用可以增强鲜味[38],而A+F与P+F酶解液的甜味氨基酸含量与IMP核苷酸含量较N+F和B+F酶解液更高。
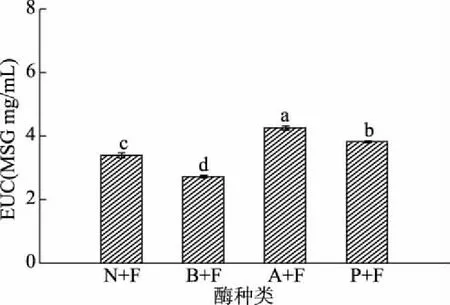
图2 蛋白酶对复合骨素酶解液EUC的影响Fig.2 Effect of protease on EUC of compound osteolysin hydrolysate
2.5 肽分子量分布分析
多肽分子量分布是Maillard反应的重要表征指标之一。刘建彬[39]发现分子量<1000 Da的肽段更具有美拉德反应活性,Toelstede等[40]发现分子量200~1000 Da的寡肽有独特的增味作用。如表4所示,对比四种酶解液肽分子量分布发现,总体肽分子量分布差异不大,肽段分子量分布主要集中于分子量1000~3000、200~500和<200 Da,这可能由于分子量1000~3000 Da肽段发生肽聚集和肽交联作用,使得该肽段分子量分布较多,而酶解使得蛋白和大分子肽段降解为分子量<500 Da的小分子肽段,为之后的美拉德反应提供丰富的物质基础[41]。酶解液中小分子量肽所占比例越大,代表其水解程度越高,酶解效果越好。其中P+F和A+F酶解液中分子量<1000 Da肽段含量较高,说明P+F和A+F组合酶的水解度大、酶解效果好,这与2.1水解度分析中的结果一致。分子量<1000 Da肽段主要包括小肽、寡肽、小分子活性肽和游离氨基酸。复合骨素酶解过程中产生的肽类物质对酶解液风味的影响,主要是包括寡肽、游离氨基酸和其他呈味物质发生协同作用,使酶解液风味饱满、口感协调。分子量<1000 Da肽段含量高的酶解液,其呈味肽的含量也可能相应较高[42-43]。根据水解度和分子量<1000 Da肽段含量的差异,说明P+F和A+F组合酶制备复合骨素酶解液的呈味效果明显优于N+F和B+F组合酶。
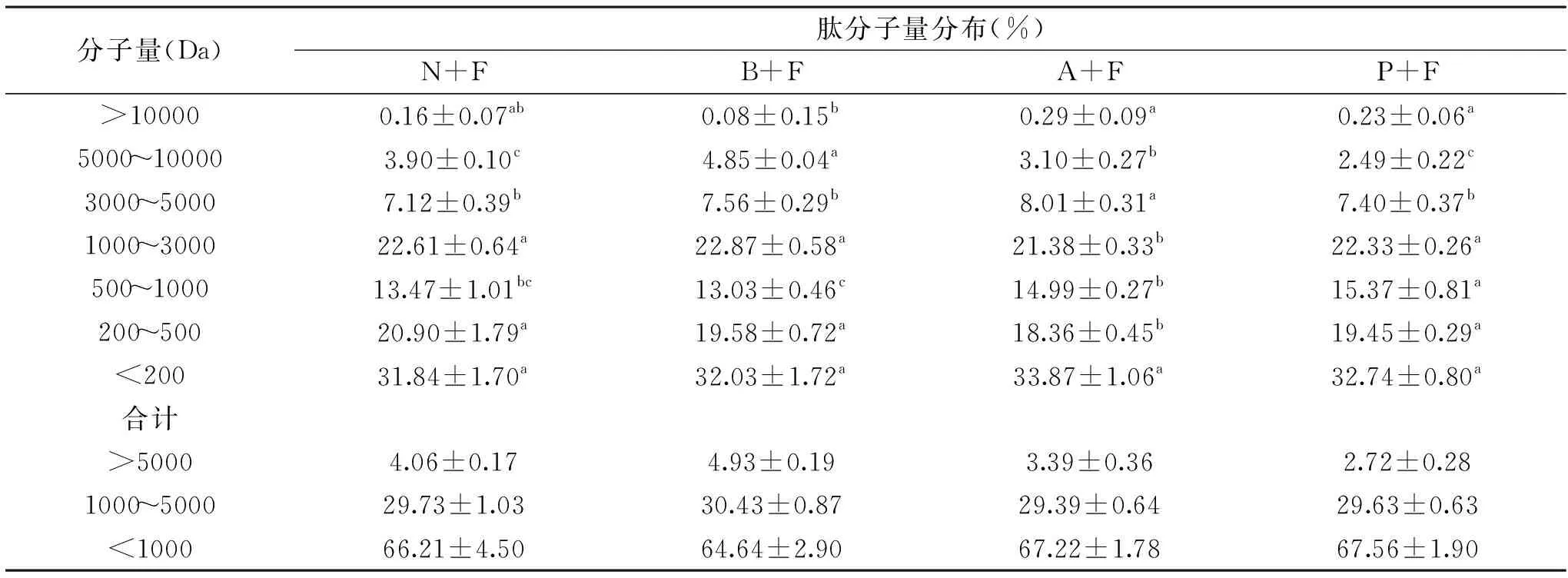
表4 蛋白酶对复合骨素酶解液肽分子量分布的影响Table 4 Effect of protease on molecular weight distribution of compound osteolysin hydrolysate
2.6 主成分分析
为了进一步明确酶种类对复合骨素酶解液呈味物质的影响,利用SPSS 19.0对四种酶解液的水解度、鲜味氨基酸、甜味氨基酸、苦味氨基酸、无味氨基酸、IMP、GMP、AMP、EUC、分子量<1000 Da的肽段进行主成分分析(Principle component analysis,PCA)。将10维度的呈味物质指标数据进行标准化处理并分析各指标变量间的相关性,得到各指标间的相关矩阵。如表5所示,经PCA特征提取的前2个主成分,其特征值均大于1,累计方差贡献率达到96.633%,基本涵盖反映了所有变量的初始信息,因此,选取前2个主成分作为数据分析的有效成分。

表5 主成分的特征值和贡献率Table 5 Eigenvalue and contribution rate of principal components
由10个指标的荷载系数与特征值计算得到10个因子的特征向量(见表6)。以特征向量为系数构建2个主成分的线性方程,如下所示:
主成分1的特征方程为:
Y1=0.320X1+0.287X2+0.252X3+0.341X4+0.331X5+0.331X6+0.327X7+0.315X8+0.325X9+0.322X10
主成分2的特征方程为:
Y2=-0.307X1-0.442X2+0.548X3-0.164X4+0.018X5-0.143X6+0.27X7+0.322X8+0.295X9-0.316X10
上述式中:Xi为标准化后的数据,i=0,1,2,…,10。

表6 主成分的载荷矩阵和特征向量Table 6 Principal loading matrix and component eigenvectors


表7 四种复合骨素酶解液呈味物质综合得分Table 7 Comprehensive scores of four kinds of compound bone enzymatic hydrolysates
N+F与B+F酶解液综合得分为负值,且B+F酶解液综合得分值最小。A+F与P+F酶解液综合得分为正值,A+F酶解液综合得分值最大,说明使用A+F组合酶酶解复合骨素呈味物质含量更高,为后续美拉德反应提供更多反应物质。
3 结论
本研究以复合骨素为原料,采用四种组合酶酶解复合骨素,探究酶种类对复合骨素呈味物质的影响。结果表明,A+F和P+F酶解液的水解度最大分别为10.67%和11.27%;对呈味游离氨基酸组成分析发现,A+F和P+F酶解液的总游离氨基酸含量最高,P+F酶解液中半胱氨酸含量最高,肉香味更强;A+F酶解液的总核苷酸含量和EUC值最大;A+F和P+F酶解液分子量<1000 Da肽段含量最高,制备复合骨素酶解液的呈味效果更好;利用PCA综合分析10个检测指标,得到A+F组合酶的综合得分最高,表明A+F酶解液为后续复合骨素酶解液美拉德反应提供更多的反应前体物质,更适合酶解复合骨素。复合骨素酶解液含有丰富的游离氨基酸和小分子活性肽,未来的研究可进一步开展复合骨素酶解液中的小分子肽种类的分离鉴定,研究美拉德反应条件、添加物种类对复合骨素酶解液呈味特性、功能特性和生理活性的影响,为复合骨素深加工利用提供理论参考。
