Ghrelin早期干预改善急性心肌梗死后心肌重构和心脏功能
2020-11-18王德国刘银华刘表虎
梅 勇,孙 楠,邢 文,王德国,刘银华,刘表虎,吕 坤
[皖南医学院第一附属医院(弋矶山医院)1.老年医学科、2. 病理科、3. 影像超声科,4.安徽省高校非编码RNA转化研究重点实验室(中心实验室),安徽 芜湖 241001]
心肌梗死(myocardial infarction,MI)不能及时再灌注可导致慢性心力衰竭(chronic heart failure,CHF),在此过程中心交感神经过度兴奋起非常重要的作用。交感神经递质能够与心肌细胞β肾上腺素受体(β-adrenergic receptors,β-AR)结合产生心脏毒性,如心肌细胞增生和心脏重构1。CHF不但引起特定基因表达如心钠肽(atrial natriuretic peptide,ANP)和脑钠肽(brain natriuretic peptide,BNP),也造成心肌细胞膜β肾上腺素受体表达改变[1- 2]。
Ghrelin是一种28个氨基酸多肽,首次发现在大鼠的胃细胞中。Ghrelin受体生长激素促分泌素受体(GHSR-1a)分布广泛,参与多种病理生理功能[3]。研究表明补充外源性Ghrelin可以抑制交感神经活性[4],提高迷走神经兴奋性[4-5],改善心肌缺血[6],降低多种心肌损伤模型动物的死亡率[7]。因此,Ghrelin有可能减轻心肌缺血并防止其进展为CHF。在本研究中,我们首先建立MI模型,并早期使用合成的外源性Ghrelin连续干预,评价其对缺血大鼠心交感神经活性以及左心室心肌细胞肥大、心肌纤维化、心肌细胞膜β肾上腺素受体表达的影响,从而探索心力衰竭治疗的新途径。
1 方法
1.1 实验动物及分组30只SD大鼠,体质量(180~210) g,♂,(南京青龙山实验动物中心,许可证号为:SCXK2018-0001)随机分成3组:假手术组(Sham组,n=6);心肌梗死组(MI,n=12);心肌梗死 + Ghrelin组(MI+Ghrelin组,n=12)。Ghrelin购自于上海生物多肽公司,合成序列:GSS(octanoyl)FLSPEHQRVQQRKESK KPPAKLQP。
1.2 动物模型建立及其干预建立大鼠心肌梗死模型[8-9],即动物麻醉、固定、气管插管呼吸机正压通气,潮气量为40 L·g-1,将呼吸频率调至70次·min-1,呼吸比2 ∶1。开胸暴露心脏,以眼科缝线沿左心耳下缘2 mm穿过冠状动脉左前降支(LAD),结扎引起LAD闭塞,Ⅱ导联心电图显示ST段抬高,Sham组仅穿缝线但不结扎。建模成功后,逐层缝合胸腔并排出胸腔内气体。大鼠清醒后随后常规饲养,并在术后3 d肌肉注射10万单位青霉素以防止伤口感染。MI+Ghrelin组给予Ghrelin皮下注射(100 μg·kg-1,每天2次),连续4周;Sham组和MI组以同等量的容量的生理盐水注射。
1.3 心脏彩超测定心脏功能术后第5周末,称体质量并麻醉大鼠,胸部备皮,按文献报道的方法用高频超声探头测定大鼠心脏功能[8]。根据左心室短轴面测定左室短轴舒张末期内径(left ventricular end-diastolic dimension,LVDd)和左室收缩末期内径(left ventricular end-systolic dimension,LVDs),并计算出左室短轴缩短分数(left ventricular fractional shortening,LVFS)以及左室射血分数(left ventricular ejection fraction,LVEF)。
1.4 交感神经放电的测定将麻醉大鼠仰卧位固定,逐层剥离颈部皮肤和肌肉寻找到颈部星状神经节[10],其形态为米粒状半透明结节。玻璃神经分离针分开0.5 ~ 1 cm交感神经束并轻柔剥离外层神经束外膜。以自制铂丝电极勾住该段交感神经,液体石蜡油滴在神经表面以便与周围组织电绝缘,连接电生理仪(RM6240多道生理记录仪,成都仪器厂)并记录交感神经放电并存储在微机中。实验结束后电脑分析交感神经放电情况,根据报道的方法分析交感神经放电幅度以评价交感神经活性(sympathetic nerve activities,SNA)[10]。
1.5 HE染色评估心肌细胞肥厚和心肌纤维化实验结束后,取心脏标本进行病理学观察[10],即经主动脉以4%多聚甲醛逆向灌洗心脏,并切除结扎线下小块的心肌组织在4%多聚甲醛中固定。随后常规处理标本并石蜡组织包埋。随后由病理科专业技术人员进行常规切片,HE和Masson染色。按我们既往方法测定心肌细胞直径[10- 11],即于40倍放大光镜下,每张切片随机选取10个细胞测量直径,取平均值作为该切片心肌细胞的直径;高倍视野下以ImageJ软件分析心肌梗死面积和非梗死区心肌胶原容积积分(collagen volume fraction,CVF),CVF/%=心肌胶原面积/所测视野面积×100%。
1.6 蛋白免疫印迹分离心脏蛋白质并以BCA法测定蛋白质浓度[11],14% SDS-PAGE电泳分离蛋白,并转移到PVDF膜上。常规处理后以不同抗体(一抗)在4 ℃下孵育过夜(ANP,BNP和β1-AR,1 ∶1 000,Santa Cruz公司;β2-AR,1 ∶ 2 000,Abbkine公司),冲洗后再与辣根过氧化物酶偶联的二抗(1 ∶2 000; Sigma)检测抗体结合,随后冲洗,并使用ECL试剂盒显色,在Quantity One(Bio-Rad)中定量分析。
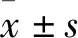
2 结果
2.1 Ghrelin对心梗后心脏功能的影响大鼠心脏超声检查提示心肌梗死后第5周,大鼠LVDs和LVDd增高(LVDs:6.15±0.64 mmvs4.56±0.37 mm;LVDd:7.23±0.85 mmvs4.82±0.57 mm;P<0.01),而Ghrelin干预可以明显减轻心肌梗死引起的LVDs和LVDd异常(LVDs:5.37±0.46 mmvs82.1±4.16.15±0.64 mm;LVDd:5.98±0.67 mmvs7.23±0.85 mm;P<0.01 )。MI组大鼠LVEF(46.2%±6.5%vs82.1%±4.1%,P<0.01)和LVFS(20.1%±3.7%vs45.8±4.6%,P<0.01)明显降低,而Ghrelin干预可以明显改善心肌梗死引起的LVEF(65.10±3.91vs46.2%±6.5%,P<0.01 )和LVFS(32.00%±3.51%vs20.1%±3.7%,P<0.01)异常。见Fig 1。
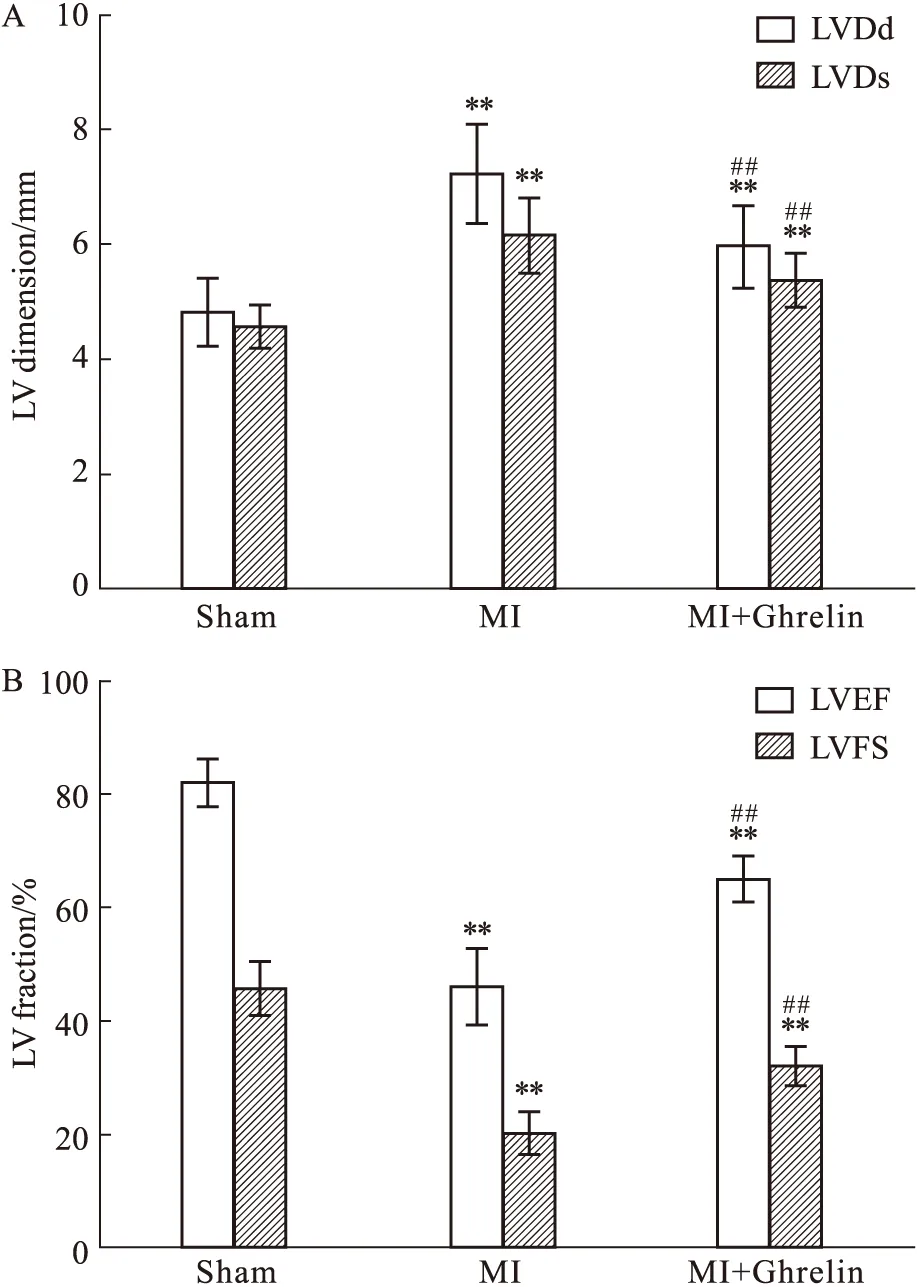
Fig 1 Effects of Ghrelin on cardiac function post myocardial infarction by echocardiographic MI=Myocardial infarction; LVDs= left ventricular end-systolic dimension; LVDd= left ventricular end-diastolic dimension; LVEF= left ventricular ejection fraction; LVFS=left ventricular fractional shortening. **P<0.01 vs Sham; ##P<0.01 vs MI group.
2.2 Ghrelin对心肌梗死面积及心机纤维化的影响急性心肌梗死后第5周大鼠心脏出现透壁性心肌梗死,Masson染色可见心室前壁全层蓝色胶原组织(Fig 2A), Ghrelin治疗可以明显缩小梗死面积(20.75%±3.54%vs34.4%±4.58%,P<0.01)(Fig 2C)。非梗死区域的心肌区域的心肌组织间隙呈现显著地胶原增生(Fig 2B),以CVF定量分析发现MI组比正常组明显增加(13.17%±2.44%vs2.98%±1.028%,P<0.01),Ghrelin治疗可明显降低CVF(8.04%±1.52%vs13.17%±2.44%,P<0.01)(Fig 2D)。
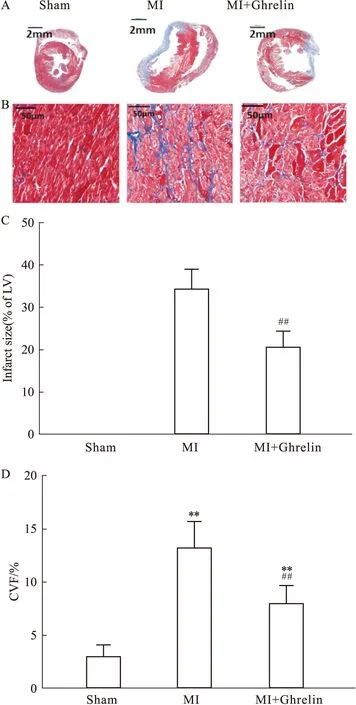
Fig 2 Effects of Ghrelin on infarct size and collagen volume fraction (CVF) post myocardial (A) Representative micrographs showing the cross-section of a heart stained with Masson’s staining in heart from Sham,MI and MI+Ghrelin group; (B) Representative amplified field in non-infarct area in different groups. (C) Summary data of infarction size (%); (D) Collagen volume fraction (CVF%) in different groups. MI=Myocardial infarction; **P<0.01 vs Sham; ##P<0.01 vs MI group.
2.3 Ghrelin对心梗后心肌细胞肥大的影响如Fig 1所示,高倍镜下可见清晰观察到心肌细胞形态及其间质。Sham组心肌细胞形态及大小正常,心肌纤维排列也比较整齐致密。而MI组的心肌细胞呈现增生肥大改变,细胞不够致密,而且细胞间质增多。MI+Ghrelin组心肌细胞的肥大改善,排列也相对整齐,细胞间质也有所改善。以心肌细胞的直径作进行定量分析可见,MI组心肌细胞直径以及MI+Ghrelin组心肌细胞直径明显高于Sham组(20.01±1.06vs14.04±0.82,P<0.01);MI+Ghrelin组直径明显小于CHF组(16.24±0.97vs20.01± 1.06,P<0.01),这种形态学观察表明早期注射外源性Ghrelin可明显改善心梗后心肌细胞增生重构。
2.4 Ghrelin对心梗后心衰心肌ANP及BNP蛋白表达的影响心梗后心肌重构可引起多种胚胎蛋白表达,与心肌细胞肥大相关。如Fig 3所示,心梗5周大鼠左心室心肌组织ANP和BNP相对蛋白表达量明显增加(ANP: 3.84±0.23vs1.05±0.08; BNP:4.48±0.45vs1.09±0.11;P<0.01);而心肌梗死后早期使用Ghrelin干预可以明显降低心梗后心肌组织ANP和BNP相对蛋白表达(ANP:1.56±0.18vs3.84±0.23; BNP:2.18±0.32vs4.48±0.45;P<0.01)。这表明早期注射外源性Ghrelin可明显改善心梗后心肌重构相关蛋白的表达。
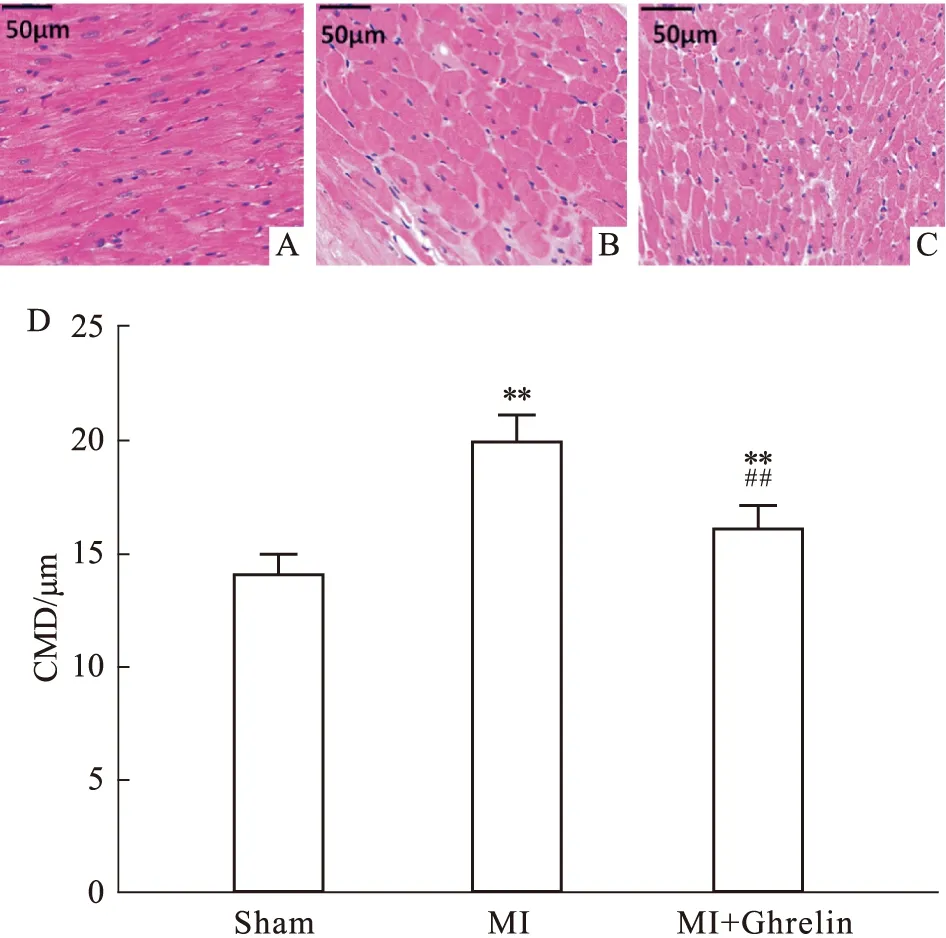
Fig 3 Effects of Ghrelin on cardiomyocyte hypertrophy post myocardial infarctionRepresentative micrographs of left ventricular tissue stained with hematoxylin-eosin (HE) staining in heart from Sham (A),MI (B) and MI+Ghrelin (C) group. (D) Summary data of cardiomyocyte diameter (CMD) in left ventricular MI,Myocardial infarction; **P<0.01 vs Sham; ##P<0.01 vs MI group.
2.5 Ghrelin对心梗后心衰大鼠心交感神经活性的影响为明确心梗后心衰大鼠及Ghrelin干预对交感神经功能的影响,通过直接记录心脏交感神经放电并评估心肌梗死后心交感神经活性。如Fig 3A所见, MI组大鼠在梗死后5周时科记录到增强的交感神经放电,而MI+Ghrelin组交感神经放电减弱。对交感神经放电强度定量分析显示,MI 组SNA幅度明显增高(50.8±5.83vs19.9±3.5,P<0.01),而Ghrelin干预明显抑制心肌梗死后心交感神经过度激活(34.3±4.6vs50.8±5.83,P<0.01 )。
2.6 Ghrelin对心梗后心衰大鼠心肌细胞β受体蛋白表达的影响为了明确心衰大鼠及Ghrelin干预对特定肾上腺素受体亚型的影响,以蛋白免疫印迹测定梗死后心肌组织匀浆中β1和β2肾上腺素受体表达。 如Fig 4所示,与Sham组的匀浆相比,MI 组心脏的心室匀浆含β1和β2肾上腺素受体蛋白表达明显降低(β1-AR: 0.26±0.09vs1.08±0.08; β2-AR:0.43±0.09vs1.15±0.12;P<0.01),然而Ghrelin干预明显增加心梗后心脏的心室匀浆含β1和β2肾上腺素受体蛋白表达(β1-AR: 0.96±0.11vs0.26±0.09; β2-AR: 0.89±0.16vs0.43±0.09;P<0.01)。
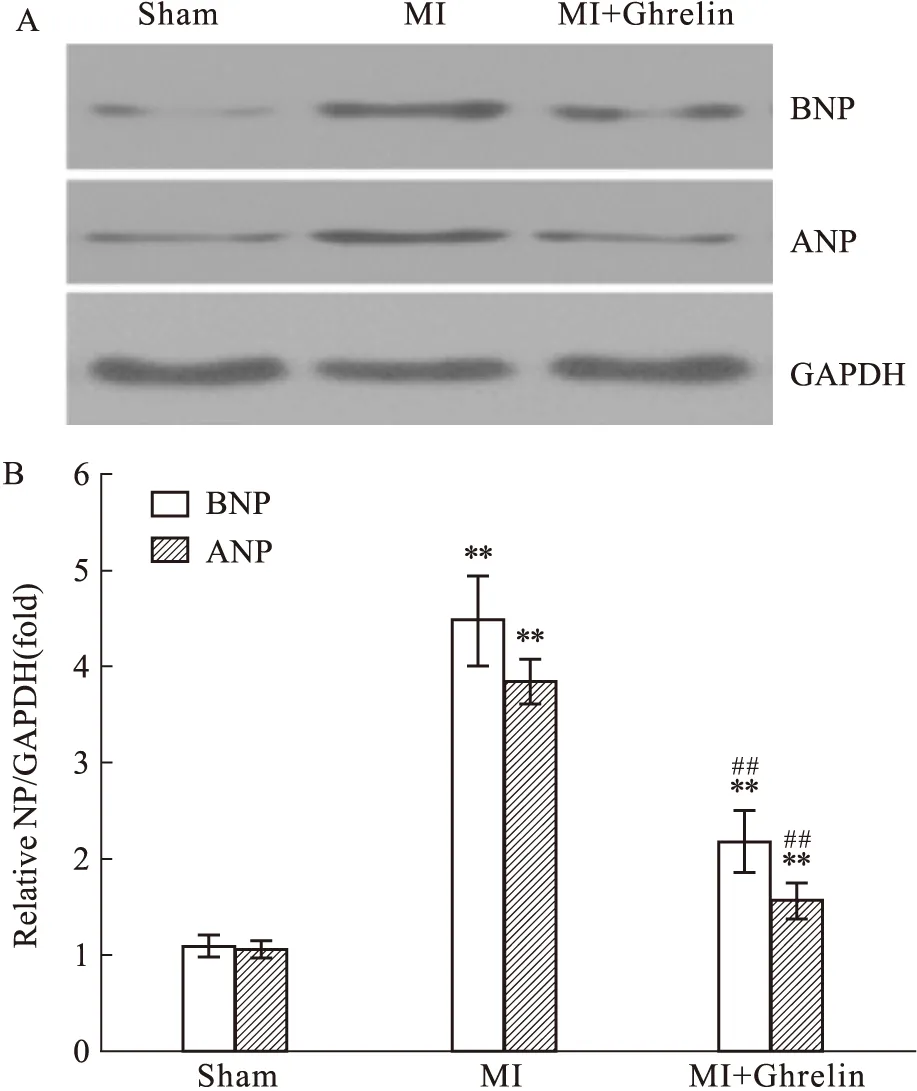
Fig 4 Effects of Ghrelin on natriuretic peptide expression in left ventricular tissue post myocardial infarctionA: Representative Western blot of BNP,BNP and GAPDH; B: Summary data of BNP and ANP expression relative to ANP:atrial natriuretic peptide;BNP:brain natriuretic peptide. **P<0.01 vs Sham; ##P<0.01 vs MI group.
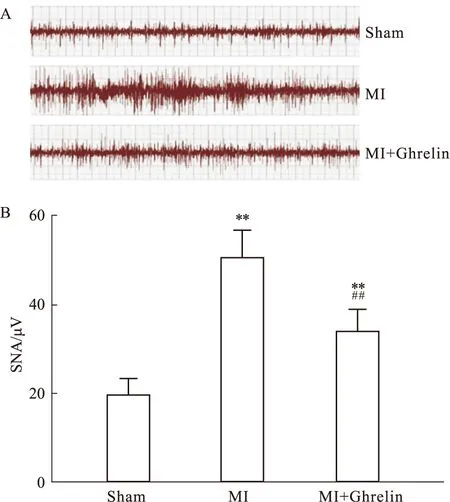
Fig 5 Effects of Ghrelin on cardiac sympathetic activities (SNA) post myocardial infarctionA: Representative trace of cardiac B: Summary data of cardiac SNA in rats from different groups. MI,Myocardial infarction; **P<0.01 vs Sham; ##P<0.01 vs MI group.

Fig 6 Effects of Ghrelin on β-adrenergic receptor expression in left ventricular tissue post myocardial infarction(A) Representative Western blot of β1-AR and β2-AR. (B) Summary data of β1-AR and β2-AR expression relative to MI,Myocardial infarction; **P<0.01 vs Sham; ##P<0.01 vs MI group.
3 讨论
急性MI后CHF是严重威胁人们的生命健康,早期治疗是避免或延缓进展为CHF的关键。防止和逆转心脏重构是当前治疗的共识,例如抑制交感神经过度激活、阻断肾素血管紧张素醛固酮系统等是当前CHF治疗基石[13]。作为一种内源性氨基酸多肽,Ghrelin参与多种病理生理功能[3]。既往研究显示,Ghrelin不但能够保护急性MI大鼠的心脏功能[4],也能改善MI后期心脏重塑引起的CHF[6]。本研究观察到MI后5周大鼠左心室内径扩大,收缩力减弱,Ghrelin治疗可以明显改善MI后心衰大鼠的心脏功能,提示在MI早期使用Ghrelin可能减少后期形成CHF的风险。
心交感神经过度激活是导致心衰进展的重要因素,抑制交感神经活性及阻断其受体效应可以保护衰竭心脏[13-14]。无论是皮下注射还是脑室内给予Ghrelin治疗,均可以抑制急性MI引起的交感神经活性增强,即便切断了双侧迷走神经,Ghrelin仍能进一步抑制交感神经活性,表明Ghrelin主要通过中枢神经通路抑制交感活性,而迷走神经传入通路则部分则协同抑制MI诱导的交感神经过度激活[4]。Shirai等[4]发现Ghrelin治疗2周可以将MI诱导的血浆甲肾上腺素浓度抑制到与假手术组水平,并降低了实验动物心率,改善了自主神经功能。Jense等[13]研究表明经外周静脉使用Ghrelin也可以穿过血脑屏障并作用于脑内的Ghrelin受体,对中枢神经系统产生影响发挥抗抑郁作用。在本研究中,通过直接记录心交感神经放电活动,实验观察到心肌梗死后心衰时交感神经过度激活,心肌梗死早期使用Ghrelin干预可明显抑制心交感神经活性。表明MI后经静脉早期Ghrelin治疗能够抑制过度激活的交感神经活性,但其具体的作用机制还不清楚,可能与Ghrelin在中枢和外周神经共同作用的结果。
过度增加的交感神经激素可以与心肌细胞膜β-AR结合产生心肌细胞毒性[14],并造成β-AR表达的异常[1]。CHF时心肌细胞膜表面的β1-AR表达明显下调,从而引起G蛋白偶联受体后信号传导通路异常,参与CHF的病理生理机制[1]。目前有关Ghrelin与心脏β1-AR相关研究较少,有研究发现急性MI时微小动脉扩张而促进非缺血区的冠状动脉灌注,β-AR阻滞(普萘洛尔)则抑制了心脏微小血管的扩张,Ghrelin则可以防止β-AR阻滞剂的小血管不良作用。这一研究表明ghrelin可以与常规的β-AR阻断剂联合使用,从而协同改善冠状动脉血流和心脏功能[15]。有研究认为心肌细胞中Ghrelin及其受体(growth hormone secretagogue receptor subtype 1a,GHS-R1a)与β-AR间存在交互作用,Ghrelin对β-AR有增敏效应,Ghrelin可以促进异丙肾上腺素的正性肌力和冠脉扩张效应。本研究发现MI后心衰心脏中β-AR表达下调,Ghrelin早期干预可以防止心肌细胞β-AR的降低。Ghrelin对MI后心肌β-AR的上调作用可能有助于保护缺血心脏的功能。有必要进一步的研究以探讨Ghrelin激活GHS-R1a时心脏β-AR的活性变化的具体机制及效应。
MI后心力衰竭可表现为心肌重构和利钠肽系统的表达升高。二者对心衰病理生理过程有一定代偿作用,既能够增强心脏收缩功能,同时也是心衰发生发展的重要标志[2]。有效的抗心衰治疗可以明显地减轻心肌细胞肥大,也降低心脏和循环中ANP和BNP的水平[2,11]。过去有研究表明Ghrelin可降低MI后心脏胶原增生和左心室肥大。本研究也观察到,Ghrelin早期干预可以缩小梗死面积、降低非梗死区的胶原增生、减轻MI导致的心肌细胞肥大并降低心肌组织的ANP和BNP蛋白表达。表明Ghrelin可能通过抑制心梗后心脏重塑而发挥心脏保护作用。然而,Ghrelin 抗MI后心肌重塑的机制尚不清楚,可能与Ghrelin抑制交感神经活性有关[6]。
综上所述,在MI早期Ghrelin干预可以(1)改善心梗后心衰动物的心脏功能;(2)减轻心肌细胞重构和相关基因表达;(3)调节心衰心脏的β肾上腺素受体表达;(4)抑制MI后交感神经过度激活。本研究表明在心肌梗死早期使用Ghrelin可以减轻心梗后心肌重塑并预防心力衰竭,其作用机制可能通过抑制交感神经过度激活并减少肾上腺素心肌毒性实现。
