3,8′-联芹菜苷元通过抑制氧连接氮乙酰葡糖胺转移酶(OGT)降低HeLa细胞迁移侵袭潜能
2020-11-18张娜娜李文利张嘉宁刘宇博
刘 欣,张娜娜,曹 禺,朱 彤,李文利,张嘉宁,刘宇博
(大连理工大学,生命科学与药学学院,辽宁 盘锦 124000)
蛋白质的氧连接氮乙酰葡糖胺(O-GlcNAc)修饰是一种广泛存在于哺乳动物细胞内的翻译后修饰,是一种非经典的糖基化,其底物蛋白为细胞质和细胞核中的可溶蛋白。不同于复杂的细胞膜蛋白聚糖修饰,O-GlcNAc糖基化是一种发生在底物蛋白丝/苏氨酸残基上的单糖修饰[1]。与磷酸化修饰类似,O-GlcNAc修饰是动态变化的过程[2]:糖基供体尿苷二磷酸氮乙酰葡糖胺(UDP-GlcNAc)在氧连接氮乙酰葡糖胺转移酶(O-linked N-acetylglucosamine transferase, OGT)的催化作用下连接到底物蛋白上,完成O-GlcNAc修饰;而在对应糖苷酶(OGA)的作用下,O-GlcNAc从蛋白质的肽链上水解,完成去糖基化[3]。OGT活性的异常对是包括癌症在内的多种慢性疾病的共同特征。已有大量研究表明,OGT催化的O-GlcNAc[4-6]糖基化异常与肿瘤细胞代谢重编程介导的快速增值和迁移侵袭密切相关[7]。因此,抑制OGT酶活性带来的O-GlcNAc修饰降低将有望抑制肿瘤细胞增殖和转移,用于多种肿瘤的治疗[8-9]。
目前,已报道的OGT小分子抑制剂主要包括四氧嘧啶类化合物、氮乙酰半乳糖胺衍生物、OSMI-1(喹啉酮-6-黄酰胺衍生物)、苯并恶唑啉酮衍生物[10-11],以及本课题组前期报道的四氢穗花杉双黄酮(tetrahydroamen-toflavone)[12]。其中,天然产物类四氢穗花杉双黄酮显示出较低的IC50值,且具有细胞毒性小的优势。在此基础上,本研究进一步分析了四氢穗花杉双黄酮的天然产物类似物,分析其与OGT的结合能和细胞外OGT抑制活性。通过细胞内及外活性检测[13],均确认3,8′-联芹菜苷元(3,8′-Biapigenin)具有优于四氢穗花杉双黄酮的OGT抑制活性,可通过抑制HeLa细胞的O-GlcNAc修饰,降低肿瘤细胞的迁移侵袭潜能。且有研究表明确实有相关药物,例如噻吩取代长链查尔酮可抑制肿瘤细胞的增殖[4]。
1 材料与方法
1.1 材料
1.1.1细胞 人宫颈癌细胞系HeLa,购自中科院上海细胞库。
1.1.2软件及数据库 分子对接与结合能分析软件Discovery Studio 4.5(Accelrys Software公司,美国),化学结构式绘制软件Chembiodraw 15.0(Cambridgesoft公司,美国),蛋白质结构数据库(PDB)。
1.1.3试剂 氧连接氮乙酰葡糖胺转移酶(OGT)多肽底物(CKII肽,氨基酸序列为KKKYPGGSTPVSSANMM,强耀公司,#04010026647,中国),四氢穗花杉双黄酮及其类似物(ChemFaces,#48236-96-0,中国),二甲基亚砜(DMSO,Sigma公司,#67-68-5,美国)和尿苷二磷酸氮乙酰葡糖胺(UDP-GlcNAc,Sigma公司, 91183-98-1,美国),O-GlcNAc抗体(RL2,Abcam公司,#ab2739,英国),OGT活性分析试剂盒(Promega公司,#V6961,美国),其它化学试剂为国产分析纯。
1.1.4仪器 二氧化碳细胞培养箱、Nanodrop型微量分光光度仪、Pico17型高速低温离心机(Thermo Fisher公司,美国),FluorChem HD2型化学发光成像仪(伯乐公司,美国),Synergy H1型全功能荧光酶标仪(BioTek公司,美国)。
1.2 方法
1.2.1四氢穗花杉双黄酮类似物与OGT结合能分析 利用Discovery Studio 4.5对受体OGT(Protein Bank Database,3PE4)晶体结构进行优化,从而达到去水加氢等目的;分别将候选化合物利用Discovery Studio 4.5软件中Libdock模块进行以OGT为受体的刚性分子对接,得到由Libdock计算所得的受体与配体结合自由能;使用C-Docker模块再次对接,输出半柔性对接条件下的受体与配体结合自由能;对两种对接方式所得结果按平均值进行排序,使用聚类分析算法获得最终的候选分子。
1.2.23,8′-联芹菜苷元分子动力学模拟分析 使用Discovery Studio 4.5软件对3,8′-联芹菜苷元进行能量最优处理,利用分子对接结果中OGT与3,8′-联芹菜苷元的结构,以OGT/UDP的X射线晶体结构(3PE4)为模板,去除UDP结构和晶体中的水分子,以OGT蛋白分子脯氨酸(Pro)559为中心,建立活性中心。并调节相应大小,以覆盖UDP和OGT的结合位置。使用Discovery Studio 4.5软件中分子动力学模拟模块对分子对接结构进行预处理后赋予Amber立场,模拟发生体系在pH 7.4环境下,设定分子动力学优化的采样区间为10 ns,输出优化的结构。
1.2.3OGT活性细胞外活性测定 使用高效液相色谱法(HPLC法)分析四氢穗花杉双黄酮及其类似物对OGT活性的抑制作用。将200 μmol·L-1的FAM荧光标记的OGT底物多肽CKII肽(FAM-KKKYPGGSTPVSSANMM),1 mmol·L-1的UDP-GlcNAc,100 nmol·L-1的人源OGT蛋白,12.5 mmol·L-1MgCl2,缓冲体系(150 mmol·L-1NaCl,1 mmol·L-1EDTA,2.5 mmol·L-1三羟丙基膦,20 mmol·L-1Tris-HCl,pH 7.4)的反应混合物和候选小分子在37 ℃孵育30 min后,加入等体积的甲醇终止反应,将反应混合物以10 000×g离心10 min。将上清液(40 μL)加载到Agilent 1260 Infinity HPLC系统上,使用荧光检测器以基于糖肽产物和肽底物的积分面积定量分析产物得率。使用Zorbax SB-C18 StableBond为分析柱(4.6 mm×250 mm,5 μm;Agilent)。流动相A为质量分数为0.1% TFA水溶液,流动相B为质量分数为0.1% TFA的乙腈溶液。液相使用梯度洗脱组分(流速为1 mL/min;0 min洗脱溶剂混合物A/B=90/10;20 min洗脱溶剂混合物A/B=70/30)。每个反应重复2次或3次后,利用GraphPad 5计算IC50值。
在无细胞反应体系中检测体外OGT酶活,使用OGT活性分析试剂盒检测候选分子对OGT酶活的抑制情况。多肽底物为无标记的CKII肽(KKKYPGGSTPVSSANMM),于黑色96孔板进行,反应体系组成为250 mmol·L-1的OGT,125 μmol·L-1的CKII,40 μmol·L-1的UDP-GlcNAc,其它反应试剂和步骤参照试剂盒说明书,使用GraphPad 5计算IC50值。
1.2.4细胞培养 HeLa细胞使用含质量分数为10%胎牛血清,质量分数为1%青/链霉素的RPMI-1640培养基在37 ℃,饱和湿度的质量分数为5% CO2培养箱中常规培养并传代。
1.2.5Western blot及凝集素印迹实验 使用候选小分子处理细胞相应时间后,收集5×106的HeLa细胞,使用Western细胞裂解液提取总蛋白,Nanodrop蛋白定量后,利用质量分数为10%的SDS-PAGE电泳分析总蛋白样品,然后湿法转膜(PVDF膜)。利用BSA封闭液室温封闭2 h后,使用1 ∶1 000的抗体或凝集素在4 ℃条件下孵育过夜,PVDF膜洗涤3次,每次5min,在室温条件下使用二抗(1 ∶5 000)中孵育1 h,洗涤3次后,使用化学发光检测试剂进行显色反应。
1.2.6细胞划痕实验 将1×106的HeLa细胞并接种到6孔板中,细胞贴壁生长近满后划痕,PBS洗3次,更换无血清培养基继续培养加入候选小分子抑制剂,使用DMSO作为对照,继续培养相应时间使用显微镜观察划痕愈合情况。
1.2.7Transwell侵袭实验 将Matrigel基质胶与RPMI 1640培养基按1 ∶5比例混匀后加入Transwell小室底部,取5×105个HeLa细胞接种于Transwell上室(200 μL无血清培养基),下室内加入500 μL完全培养液。将相应浓度的候选小分子抑制剂加入上室内,继续培养48 h,以DMSO为对照。使用质量分数为4%多聚甲醛固定上室细胞10 min,使用结晶紫染料染色30 min。PBS洗涤后使用棉签擦去小室上层细胞,利用倒置显微镜观察小室下层细胞,统计侵袭细胞数目。
2 结果
2.1 3,8′-联芹菜苷元具有OGT体外抑制活性选取10个已知OGT小分子抑制剂四氢穗花杉双黄酮(tetrahydroamentoflavone)的类似物分子(Fig 1A),依据OGT与天然底物的结合模式,利用两种对接方式Lib-Dock(刚性对接)和C-Docker(半柔性对接)。结合能力情况如Fig 1B所示,其中结合能力3,8′-联芹菜苷元在候选分子中具有优于四氢穗花杉双黄酮的结合能。OGT活性分析试剂盒检测表明所有候选分子在50 μmol·L-1浓度下均具有不同程度的OGT抑制活性,其中3,8′-联芹菜苷元可抑制OGT活性超过82%(Fig 1C)。
2.2 3,8′-联芹菜苷元结合在OGT的底物结合口袋为了进一步阐释3,8′-联芹菜苷元抑制OGT的作用机制,使用分子动力学模拟优化3,8′-联芹菜苷元与OGT(3PE3)的分子对接结果,经20 ns优化后,输出结构稳定状态构象,聚类后挑选最大聚类的典型构象。该构象在20 ns的模拟轨迹中的频率约为60.8%。Fig 2A和Fig 2B给出3,8′-联芹菜苷元与OGT底物结合口袋结合的稳定状态构象,其中3,8′-联芹菜苷元的B环与His920和Gln839形成两个较稳定的氢键相互作用,C环羟基与His920形成较稳定的氢键相互作用,D环与Thr922形成较稳定的氢键相互作用,E环羟基与Ala896和Phe837形成2个较稳定的氢键相互作用。同时3,8′-联芹菜苷元与OGT活性口袋处的Met501、His498、Lys634、Thr633、His901、Asn838、His558残基形成一个范德华力网。这些稳定的相互作用,使得3,8′-联芹菜苷元能够稳定结合在OGT活性口袋内。
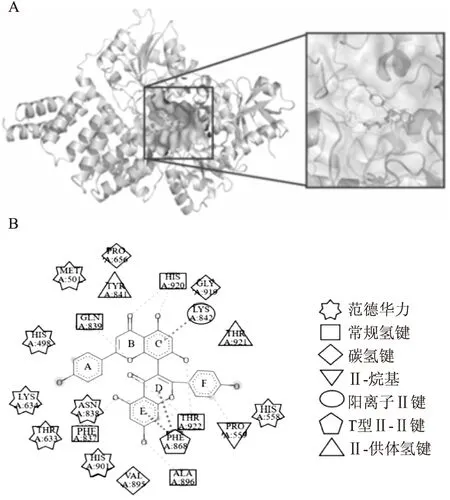
Fig 2 Binding model analysis of 3,8′-Biapigenin and OGTA:Binding pose of 3,8′-Biapigenin with OGT after molecular dynamics simulation;B:Analysis of binding model of 3,8′-Biapigenin and OGT.
2.3 3,8′-联芹菜苷元OGT抑制活性优于四氢穗花杉双黄酮使用HPLC法[15]分析3,8′-联芹菜苷元和四氢穗花杉双黄酮对OGT活性的抑制作用 (Fig 3A),结果显示加入候选分子相比与对照OGT单独反应1 h,9 min出现的产物峰明显减弱,相应在18 min的底物峰增强,证明候选分子均能抑制OGT将CKII肽糖基化反应。但由结果图可见,3,8′-联芹菜苷元作用1 h的产物峰明显低于四氢穗花杉双黄酮作用组,且底物峰呈相反趋势,证明在相同反应时间内,3,8′-联芹菜苷元具有优于四氢穗花杉双黄酮的OGT抑制活性。进一步使用0.025 μmol·L-1~400 μmol·L-1的浓度梯度的3,8′-联芹菜苷元作用于OGT无细胞反应体系,结果显示3,8′-联芹菜苷元对OGT抑制呈浓度依赖特征,计算3,8′-联芹菜苷元对OGT的半数抑制浓度(IC50)值为12.88 μmol·L-1(Fig 3B),优于文献报道的四氢穗花杉双黄酮21.8 μmol·L-1的IC50值。
2.4 3,8′-联芹菜苷元有效抑制细胞内OGT活性为了进一步研究3,8′-联芹菜苷元在活细胞中的OGT抑制活性,使用25 μmol·L-1~200 μmol·L-1的3,8′-联芹菜苷元处理HeLa细胞24 h,Western blot检测细胞内OGT催化的蛋白质O-GlcNAc修饰变化情况。结果表明随着3,8′-联芹菜苷元浓度的增加,O-GlcNAc修饰呈现减少趋势(Fig 4A)。使用100 μmol·L-1的3,8′-联芹菜苷元处理HeLa细胞6~24 h,细胞内糖基化修饰水平随时间延长逐渐降低(Fig 4B),证明3,8′-联芹菜苷元可以时间和浓度梯度方式抑制HeLa细胞内的OGT活性。使用凝集素半刀豆球蛋白A(concanavalin A, ConA)和野豌豆凝集素(fluorescein labeled vicia villosa lectin, VVL)检测100 μmol·L-1的3,8′-联芹菜苷元处理24 h后的HeLa细胞蛋白质N-聚糖和O-聚糖修饰(Fig 4C),未见明显改变,证明其它聚糖结构不受3,8′-联芹菜苷元影响。
2.5 3,8′-联芹菜苷元抑制HeLa细胞迁移侵袭潜能50 μmol·L-1~100 μmol·L-1的3,8′-联芹菜苷元处理HeLa细胞48 h能够明显抑制细胞划痕愈合(Fig 4D)。Transwell细胞侵袭实验结果表明,100 μmol·L-1的3,8′-联芹菜苷元和四氢穗花杉双黄酮处理48 h均能有效抑制HeLa细胞的侵袭潜能(Fig 4E)。这些结果表明3,8′-联芹菜苷元能够抑制细胞内的OGT,通过降低胞内O-GlcNAc糖基化修饰抑制肿瘤细胞迁移侵袭潜能。
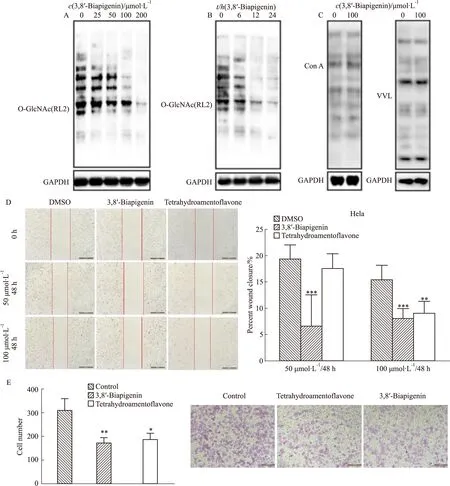
Fig 4 3,8′-Biapigenin inhibited OGT activity in HeLa cells and effect of 3,8′-Biapigenin on HeLa cell invasiveness and migration capabilityA:Western blot of HeLa cell lysates after 3,8′-Biapigenin treatment at different doses(0~200 μmol·L-1) for 24 h;B:Western blot of HeLa cell lysates after 3,8′-Biapigenin treatment at 100 μmol·L-1 for indicated times;C:Lectin blot of HeLa cell lysates after 3,8′-Biapigenin treatment at 100 μmol·L-1 for 24 h.D:Results of HeLa cells wound scratch assay after 50~100 μmol·L-13,8′-Biapigenin treatment,**P<0.01 vs invasion assays showed the invasion ability of HeLa cells treated with 100 μmol·L-13,8′-Biapigenin and Tetrahydroamentoflavone for 48 h,**P<0.01 vs
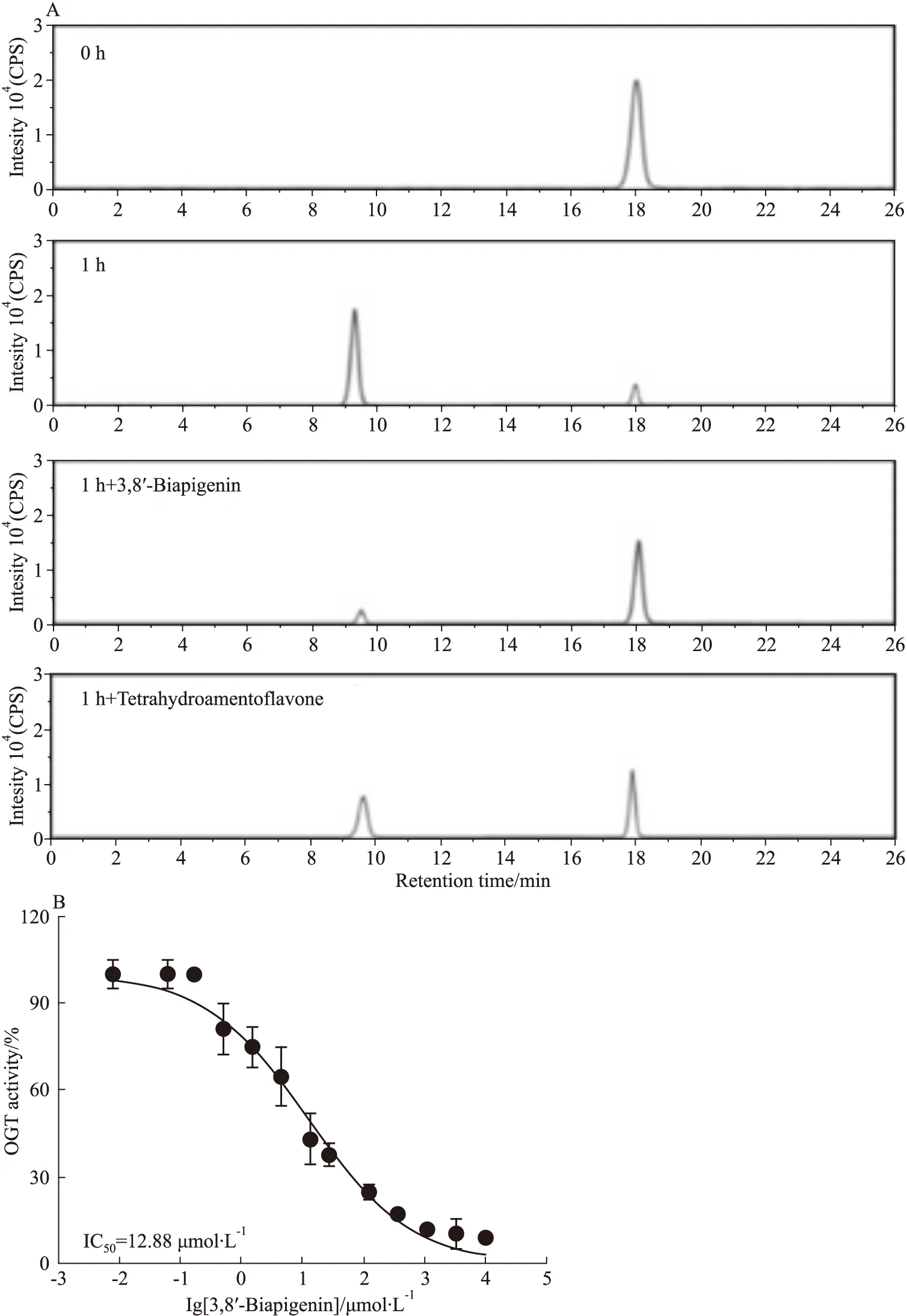
Fig 3 3,8′-Biapigenin inhibited OGT in an enzyme-based assayA:Inhibitory effect of 3,8′-Biapigenin and Tetrahydroamentoflavone on OGT activity by using HPLC method;B:3,8′-Biapigenin inhibited OGT activity in a dose-dependent manner.
3 讨论
针对肿瘤的研究表明,肿瘤细胞糖基化修饰的异常是肿瘤的分子特征之一。这种改变通常表现为相关糖基转移酶及其调控的特征性糖链结构的表达改变。蛋白质的O-GlcNAc糖基化修饰机制类似于磷酸化,发生在蛋白质的丝氨酸和苏氨酸残基上。这种糖基化方式存在于所有高等真核生物的胞核和胞质中,对胞内的多种信号通路具有调节作用,并与几乎所有细胞生理过程和包括肿瘤在内的多种重大疾病的发生和发展密切相关。由于底物蛋白众多,O-GlcNAc糖基化修饰被发现参与包括侵袭转移在内的多种肿瘤生物学行为的调控。与受到数百个激酶调控的磷酸化修饰不同,胞内仅有一种OGT酶调控这一修饰过程。OGT的功能是将糖基供体UDP-GlcNAc的N乙酰葡糖胺部分共价连接到蛋白质上。因此,抑制OGT的活性将能够调控胞内蛋白的O-GlcNAc修饰。
本文通过基于结构的分子对接方法,分析了多个已报道的OGT天然产物抑制剂四氢穗花杉双黄酮的类似物与OGT的结合能,这些化合物亲和力各异,其中3,8′-联芹菜苷元具有优于四氢穗花杉双黄酮的结合能和体外OGT抑制活性,故选取该分子作为OGT抑制剂候选分子。通过分子动力学优化,发现3,8′-联芹菜苷元能够与受体OGT的底物结合口袋形成5个氢键相互作用,并与周围7个氨基酸残基形成范德华力网。相比于文献报道的四氢穗花杉双黄酮与OGT形成的3个氢键作用力外,3,8′-联芹菜苷元还具备额外4个稳定的氢键相互作用。这些相互作用将有利于3,8′-联芹菜苷元稳定作用于OGT的活性口袋。OGT无细胞反应体系抑制活性结果表明,3,8′-联芹菜苷元抑制OGT所需的IC50值低于四氢穗花杉双黄酮,HPLC法结果中也得到了验证,这些结果与分子对接和动力学优化结果相符。此外,3,8′-联芹菜苷元表现出较好的细胞内OGT抑制活性。ConA和VVL凝集素印迹结果说明,3,8′-联芹菜苷元在抑制OGT的同时没有对其它糖基转移酶活性造成明显影响,N-聚糖和O-聚糖修饰没有明显变化,证明3,8′-联芹菜苷元具有较少的脱靶效应。文献报道,OGT催化的O-GlcNAc修饰参与多种肿瘤细胞迁移侵袭过程[5]。细胞划痕和Transwell实验结果表明,3,8′-联芹菜苷元对OGT活性的抑制能够明显抑制HeLa细胞的迁移和侵袭过程,再次证明3,8′-联芹菜苷元具有细胞内的抑制活性,并影响O-GlcNAc修饰参与的肿瘤细胞转移过程。
综上,3,8′-联芹菜苷元通过与OGT底物口袋结合,抑制细胞内OGT酶活和胞内蛋白的O-GlcNAc修饰,进一步降低肿瘤细胞的迁移侵袭潜能。这些结果为OGT小分子抑制剂和O-GlcNAc修饰功能的研究提供了参考,为治疗肿瘤转移相关研究提供了相关工具,但3,8′-联芹菜苷元抑制肿瘤转移作用机制还有待进一步的研究。
