湖南省部分地区猪、鸡源粪肠球菌耐药性及多位点序列分型分析
2020-11-18蒋逸凡李岱霞鲍翔宇黎满香
蒋逸凡,李岱霞,鲍翔宇,黎满香
(湖南农业大学动物医学院,长沙 410128)
粪肠球菌(Enterococcus faecalis)是一种革兰氏阳性菌,广泛存在于口腔、土壤等环境中。是人和动物胃肠道内微生物群落的重要组成部分,数量仅次于大肠杆菌[1]。一般情况下,粪肠球菌很难引起机体发病[2],但当机体的免疫环境遭到抑制或破坏时,则会引起感染。在引起人心内膜炎感染的病原菌中,粪肠球菌居第二位,仅次于大肠埃希菌;由粪肠球菌引起的菌血症感染率居第三位,仅次于金黄色葡萄球菌和凝固酶阴性葡萄球菌。粪肠球菌还可引起猪、鸡感染发病和死亡,如引起鹑鸡败血症和公猪睾丸炎、仔猪关节炎,造成鸡胚死亡和产弱雏等[3-4],给规模化猪、鸡养殖场带来经济损失。
随着对粪肠球菌的研究不断深入,发现抗菌药物的滥用和粪肠球菌的获得性耐药,使其耐药性大大增加,对某些常用抗生素几乎达到完全耐药[5]。粪肠球菌的耐药性主要分为染色体介导的天然性耐药和染色体外遗传物质所诱导的获得性耐药。该菌的天然耐药性比临床上许多其他革兰氏阳性菌都要强,且更容易被诱导进而对许多抗菌药物产生获得性耐药[6]。
相对传统的分子分型技术而言,细菌多位点序列分型(multilocus sequence typing,MLST)技术具有更高的分辨率与更强的重复性,且更简单方便。因此该方法已被广泛应用于细菌生物学及种群进化分析的研究中。欧洲部分研究[7-8]表明,粪肠球菌产内酰胺酶菌株或耐万古霉素菌株大多属于CC2、CC16及CC87 3个克隆群,位于CC16克隆群的粪肠球菌多重耐药菌株在社区和院内都有分布,且在社区中极大多数为ST16型的粪肠球菌菌株都表现为对氨基糖苷类抗菌药物耐药。本研究欲以猪、鸡源粪肠球菌为例,对湖南部分地区养殖场分离株的耐药性进行检测,并通过MLST对粪肠球菌多重耐药株可能的来源及优势菌型等进行分析,以初步了解该地养殖场中动物源粪肠球菌多重耐药株的流行趋势,为粪肠球菌感染的防治提供依据。
1 材料与方法
1.1 菌株的分离与鉴定2018年分离自湖南省宁乡、衡阳、常德、浏阳4个不同地区规模化养殖场健康猪、鸡源采集的254份肛门拭子共81株粪肠球菌,包括猪源38株,鸡源43株。拭子样品接种于粪肠球菌显色培养基上进行培养并筛选单个紫红色带光泽的圆形菌落进行革兰氏染色镜检;参照文献[9]设计引物,提取可疑菌株DNA,利用PCR对菌株进行鉴定,PCR程序为:94℃预变性5 min;94℃变性30 s;53℃复性30 s,72℃延伸40 s,35个循环;72℃延伸10 min。质控菌株粪肠球菌(ATCC29212)由湖南省药物监察所馈赠。
1.2 主要试剂2×PCR Mix购自北京天恩泽基因科技有限公司;DNA marker购自康为世纪生物科技有限公司;肠球菌显色培养基购自青岛海博生物技术有限公司;PCR引物由北京擎科生物技术有限公司合成;革兰氏阳性菌药敏试验试剂盒购自天津市金章科技发展有限公司。
1.3 药敏试验按照2018年美国临床实验室标准化协会(Clinical and Laboratory Standards,CLSI)推荐的抗菌药物敏感性实验执行标准,按照天津市金章科技发展有限公司革兰氏阳性菌药敏试验试剂盒使用说明,使用肉汤稀释法测定临床上使用较多的万古霉素、庆大霉素、四环素、氟苯尼考、氧氟沙星、红霉素、头孢西丁、复方新诺明8种抗菌药物的最小抑菌浓度(minimal inhibitory concerntration,MIC)。取生理盐水润湿后的无菌棉签,从过夜培养皿上挑取数个新鲜菌落,于适量无菌生理盐水中混匀,选用标准比浊管调整菌液浓度至0.5麦氏单位,吸取120 μL菌液与24 mL肉汤充分混匀,吸取菌悬液100 μL接种于含不同药物浓度的96孔细菌定量药敏试剂盒中,空白对照孔加入100 μL无菌肉汤。观察没有产生沉淀的最小浓度,其所含最低抗菌药物浓度即为最小抑菌浓度,再结合CLSI规定的标准耐药折点来判断分离株是否耐药。
1.4 粪肠球菌的MLST分析从75株多重耐药的粪肠球菌中选取耐药谱较广的35株,采用水煮法提取DNA,制备PCR模板,引物序列参照文献[13]设计,并由北京擎科生物科技有限公司合成,PCR扩增7个管家基因的目的片段。PCR程序为:94℃预变性5 min;94℃变性30 s;按照各管家基因特异性引物要求的退火温度设置,时间为30 s,72℃延伸40 s,35个循环;72℃延伸7 min。PCR扩增产物纯化后进行测序,将测序序列提交至MLST数据库进行比对,确定菌株的各个等位基因的序号并提交数据库,可得到菌株确定的序列型,即ST型。应用eBURST软件分析所有菌株的MLST结果及其在整个粪肠球菌数据库中的分布情况,通过绘制聚类分析图来研究各个实验菌株ST型之间的亲缘关系。
1.5 统计学分析应用SPSS 22.0软件进行数据分析,计数资料比较采用χ2检验,P<0.05为差异显著,具有统计学意义。
2 结果与讨论
2.1 81株粪肠球菌分离株对8种抗菌药物的耐药结果对分离到的81株粪肠球菌进行8种抗菌药物的药敏试验,结果表明,猪源与鸡源分离株对同种药物的耐药率较为相似,不同地区的分离株对同种药物的耐药情况却存在一定差异;81株分离菌对四环素、红霉素及头孢西丁耐药最严重,耐药率均在90%以上,与王送林[10]2015年报道的湖南省猪源粪肠球菌耐药结果相比较发现,耐四环素和红霉素的猪源粪肠球菌在湖南地区仍然占据着较高比例(90%以上)。对氧氟沙星和氟苯尼考的耐药相对严重,耐药率为60%~80%,对万古霉素普遍敏感,仅在衡阳地区发现1株鸡源粪肠球菌对万古霉素耐药,具体耐药结果见表1、表2。由此可知,不同地区的分离株对8种抗菌药物的耐药结果存在差异,与李金磊等[11]报道的河南省4个地区猪、鸡源粪肠球菌的结果相似,这可能与各地用药情况及水平存在直接关系;通过比较可知,4个地区均对四环素、红霉素和头孢西丁耐药严重,耐药率有的高达100%,此结果与我国大部分地区报道的相关耐药结果相似[13-14];宁乡地区粪肠球菌对庆大霉素的耐药率明显高于其他3个地区(P<0.05);衡阳地区分离株对氟苯尼考、氧氟沙星、红霉素、复方新诺明以及头孢西丁的耐药率均低于其他3个地区,且出现了1株7重耐药鸡源耐万古霉素粪肠球菌;常德地区分离株对氧氟沙星的耐药率显著高于其他地区(P<0.05);浏阳地区分离株对复方新诺明的耐药性均显著高于其他地区(P<0.01)。万古霉素作为医院常用的临床治疗药物,在养殖场中暂未被提倡为常规用药,因此粪肠球菌对该药普遍敏感,而本次试验分离到1株鸡源耐万古霉素粪肠球菌,说明耐万古霉素粪肠球菌可能通过环境或相关途径传播到了该鸡场中,因此,对耐万古霉素菌株可能的来源及发展值得引起关注。
本次试验中有75株粪肠球菌对3种及3种以上抗菌药物耐药,多重耐药率达92.6%;猪源与鸡源分离株的多重耐药率均超过92%,且都以5重耐药(25.8%、37.5%)和6重耐药(31.4%、27.5%)为主;在4个地区中,宁乡与浏阳地区的粪肠球菌分离株全部对3种及3种以上的抗菌药物耐药(100%),常德地区的多重耐药菌株所占比例为95%,且以5重耐药和6重耐药菌株居多;衡阳地区的多重耐药率为75%,且以3重耐药与4重耐药菌株居多;除常德地区外,7重耐药菌株在其他3地均有少量发现,没有发现对8种抗菌药物全部耐药的菌株。
2.2 粪肠球菌MLST分析35株粪肠球菌共分为21个ST型,其中包括ST32型3株、ST16型4株、ST476型3株、ST480型4株;ST828、ST903、ST553、与ST416型各包含2株;除此之外,其余序列型在本次试验中均只包含1个菌株。35株粪肠球菌分型结果见表3。对35株粪肠球菌的ST型进行比较可知,不同地区不同动物来源的粪肠球菌拥有丰富的ST型,但总的来说具有相同或相似ST型的菌株大多来自同一地区,这与张秀方[14]的研究结果一致。其中,17个猪源分离株共分为11个ST型,18个鸡源分离株共包含10个ST型。本次研究成功构建了21个ST型的克隆图谱(图1),由图可知,21个ST型分为了3个组别与10个独立型。图中ST16处于核心位置,是经eBURST运算推测的试验菌株的祖先ST型(即Founder),ST553、ST363、ST265、ST372以及ST541型以它为中心,与该型的亲缘关系较近;组别2由ST480、ST663及ST846组成;组别3由ST476和ST828组成,组别4由ST32和ST846组成;10个独立序列型分别为ST538、ST823、ST903、ST494、ST556、ST416、ST334、ST32、ST826和ST618,它们的亲缘关系较为疏远。在7个管家基因里,拥有5个及5个以上相同等位基因编号的ST属于同一个复合克隆群,将本试验的21个ST型与整个数据库的ST型导入该软件进行分析,结果见图2。本试验通过eBURST数据分析软件得到的优势CC群共有4个(CC16、CC480、CC476、CC4),其中CC16(ST16、ST363、ST372、ST541、ST265、ST553)所覆盖的粪肠球菌数量最多,占比28.6%。ST16型是CC16群的优势ST型,也是经eBRUST软件推测出的35株粪肠球菌的祖先序列型,一般认为位于同一子群的优势ST型其分化时间相对来说较长,并逐渐向不同地区分布并进化,当这些菌株序列发生突变或是重组,便会产生丰富的ST型,由此可初步推测本研究中的35株多重耐药粪肠球菌可能由同一ST16型祖先菌株分化而来。这些菌株在宁乡、衡阳等地区均有分布,且大多为猪源粪肠球菌(7/10)。位于CC480(ST480、ST663、ST846)的3个ST型总共包括6株菌株,其中,宁乡猪源2株、鸡源1株,衡阳鸡源1株,常德鸡源2株;位于同一CC群的ST476与ST828,共包含5株菌株,且均为猪源;位于CC4(ST32、ST334)的菌株有4株,且均为鸡源。除此之外,其他CC群以及余下的独立ST型在不同地区的猪、鸡源分离株中均有少量分布。
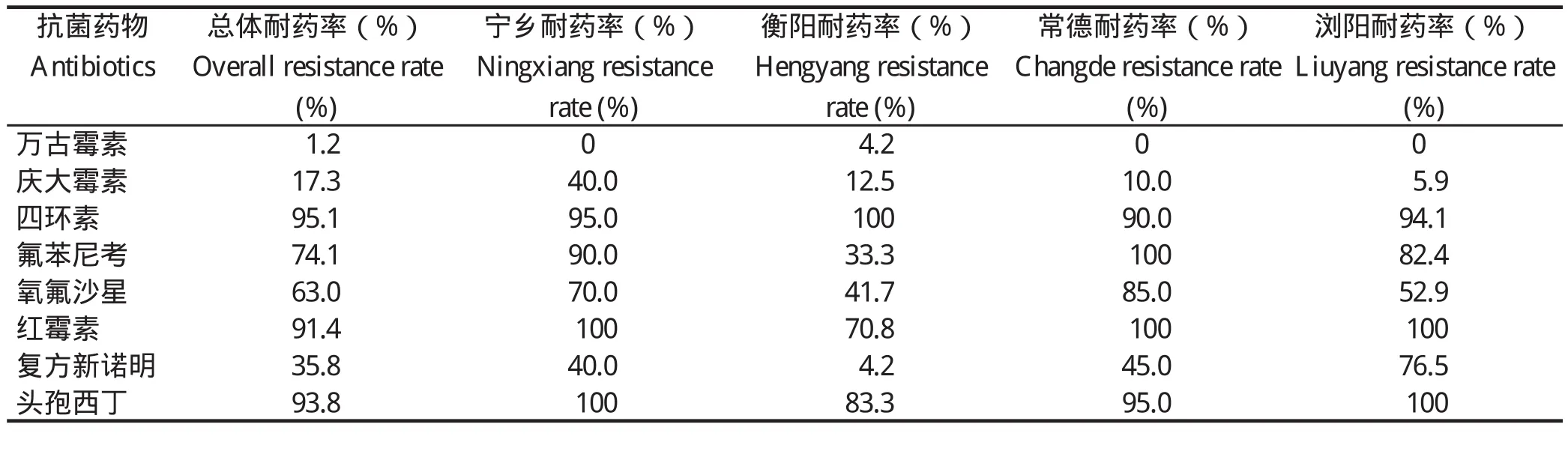
表1 粪肠球菌分离株对8种抗菌药物的耐药结果Table 1 Resistance results of 8 antibiotics in Enterococcus faecalis isolates

表2 猪、鸡源粪肠球菌对8种抗菌药物的耐药结果Table 2 Resistance results to 8 antibiotics of Enterococcus faecalis isolated from swine and chickens
2.3 优势CC群粪肠球菌的耐药性比较对本次试验中的4个优势CC群(CC16、CC480、CC476、CC4)粪肠球菌的多重耐药情况进行比较,4个CC群中的分离株均对四环素、红霉素及头孢西丁表现为耐药;其中,有2株ST16型菌株的多重耐药谱完全相同,均为5重耐药菌(庆大霉素+四环素+氧氟沙星+红霉素+头孢菌素),有2株ST480菌株的耐药谱仅存在1处差异,说明同一ST型的菌株可能具有相同或相似的多重耐药谱,与李岩等[12]的研究结果相似。除此之外,CC16群分离株对庆大霉素耐药率(90%)明显高于其他CC群(P<0.05);CC4(100%)菌株对氟苯尼考的耐药率明显高于CC16(60%)和CC480(16.7%),且本研究中唯一的1株耐万古霉素鸡源粪肠球菌也包括在该群中;CC476群菌株对氧氟沙星的耐药率(100%)也比其他3个CC群高;CC480分离株对复方新诺明及氟苯尼考的耐药率低于其他3个CC群。研究还表明[15],CC16和CC4均是粪肠球菌流行的主要CC群,在抗生素的选择性压力下,某些分化已久且适应性较强CC群便会成为优势克隆群,优势CC群的流行又可以促进耐药性菌株的传播,这一恶性循环势必会给人类及动物健康带来潜在威胁,故针对不同CC群粪肠球菌的不同耐药特征,合理使用抗菌药物,对粪肠球菌感染的临床治疗具有一定指导意义。

表3 粪肠球菌15个ST型的等位基因谱Table 3 Allele spectrum of 15 ST types in Enterococcus faecalis

图1 35株粪肠球菌21个ST型的eBRUST图Fig.1 The eBURST map about 21 STs of 35 Enterococcus faecalis

图2 粪肠球菌MLST全局分布图Fig.2 MLST global distribution map of Enterococcus faecalis
