我国进口乌拉圭肉牛引发EBL和BVD传播的定性风险评估
2020-11-18辛思培孙卫东
辛思培 ,蒋 蔚 ,李 健 ,张 强 ,孙卫东 ,王 权
(1.中国农业科学院上海兽医研究所,上海200241;2.中华人民共和国上海海关,上海200002;3.南京农业大学动物医学院,南京210095)
随着生活水平的提高,我国现有肉牛的品质和数量不足以满足人们对优质肉品的需求,国内供给侧改革举措的实施也正促进肉品实现“一品多源”的目标,因此我国与乌拉圭签署了一系列协定,以期从乌拉圭进口优质肉牛。然而在进口贸易过程中,活体动物很有可能成为外来疫病的携带者,一旦引入外来疫病将会对国内动物健康、食品安全、公共卫生等多方面造成影响,所以实施动物检疫是不可或缺的流程[1]。根据世界贸易组织WTO《动植物检疫及卫生措施协议》和世界动物卫生组织OIE《国际动物卫生法典》要求,进行风险评估是国际贸易中动物检疫必不可少的环节[2],正确的评估可以筛选出潜在的疫病,分析各个疫病各个环节的风险,为制定贸易策略、优化检验检疫措施、建立疫病防控体系等提供有利参考。本研究参考OIE制定的国际动物卫生风险分析方法,从释放、暴露和后果评估三个方面对乌拉圭输华牛的历年检测结果中较为高发的两种疫病(牛地方流行性白血病EBL和牛病毒性腹泻BVD)进行了定性风险评估。
1 材料与方法
根据贸易议定书要求,乌拉圭输华肉牛需要在农场进行初次检疫,合格牛经官方兽医逐头临床检查后,进入境外隔离场进行至少30天的隔离检疫剔除疫病阳性牛,并持有我国签发的《进境动植物检疫许可证》按照指定的路线,在规定的时间内由指定口岸入境,进入我国境内隔离场隔离检疫。根据以上的进口流程,参考OIE进口风险分析原则,分析识别我国自乌拉圭进口肉牛过程中可能引入疫病的关键环节,构建风险评估流程图(图1),再分别进行释放评估、暴露评估和后果评估以得出最终定性结果。
1.1 危害确认根据2014-2018年乌拉圭输华牛检测数统计分析疫病检出种类,并对各疫病传播过程中的危害因素进行确认。
1.2 释放评估疫病的释放建立在进口肉牛携带某疫病病原,且在农场隔离、境外隔离场、境内隔离场检疫环节发生漏检基础上。针对以上因素分别评估其可能性,并从佐证材料丰富程度对其不确定度进行描述,分析得出释放风险。

图1 乌拉圭输华肉牛风险评估流程图Fig.1 Flow chart of risk assessment for cattle imported from Uruguay
1.3 暴露评估从我国健康易感动物比例、未接种疫苗/无免疫保护可能性、接触病原可能性3个方面评估其可能性和不确定度,分析得出暴露风险。
1.4 事件发生可能性及不确定度分类参照OIE《动物及动物产品进口风险分析手册》及SNT2486-2010标准,将每种事件发生的可能性划分为由“可忽略”至“高”7个程度(表1),将不确定度划分为低、中、高3个级别(表2)。

表1 风险事件定性描述术语表Table 1 Glossary of qualitative descriptions of risk events

表2 不确定度描述术语表Table 2 Glossary of uncertainty descriptions
1.5 后果评估对进口乌拉圭肉牛携带某疫病入境后带来的直接后果及间接后果用4种程度进行定义(表3),对其可能影响的范围用4种水平进行描述(表4),综合各个风险因素的后果严重程度及影响范围得出风险等级(表5),参照SNT2486-2010标准比对得出后果评估结果。

表3 后果严重程度术语表Table 3 Glossary of the effect severity

表4 后果影响范围术语表Table 4 Glossary of scope of effect
1.6 最终定性结果首先对释放风险和暴露风险中各风险事件的可能性进行分析和定性描述,依据风险可能性描述合并规则(表6)合并各事件可能性,分别得出进口乌拉圭肉牛携带某疫病传入我国的释放和暴露风险。然后按照乌拉圭输华肉牛携带疫病风险评估流程图逐级合并风险,即先综合释放和暴露的风险,再结合后果评估结果,综合描述得出乌拉圭肉牛携带某疫病进入我国的最终定性评估结果。

表5 后果风险等级评估表Table 5 Risk level assessment form for effect
2 结果
2.1 危害确认根据议定书要求,乌拉圭输华牛需对口蹄疫、布杆菌病、结核病(tuberculosis,TB)、副结核病(Johne's disease,JD)、牛地方流行性白血病(enzootic bovine leukosis,EBL)、牛病毒性腹泻(bovine viral diarrhoea,BVD)等疫病进行检测,根据近年来乌拉圭输华牛检测数据可知(图2),牛地方流行性白血病是检出数最多的疫病,牛病毒性腹泻次之,副结核病检出较少,偶有布氏杆菌病及结核病检出。因此,本研究选取检出数较多的EBL、BVD进行进一步风险评估。
牛地方流行性白血病的病原是牛白血病病毒(Bovine leukemiavirus,BLV)。该病毒是C型致瘤病毒群、反转录病毒科的一类单股RNA病毒[3],自然情况下仅能感染牛[4],目前根据gp51基因分为10个基因型[5-8]。感染BLV的牛大多数并不表现明显临床症状,仅有30%会发生持续性淋巴增生,5%会发展为恶性淋巴瘤[9],年龄、性别、营养等因素也是导致感染牛发病的重要诱因。

表6 风险可能性描述合并规则表Table 6 Description of the possibility of risk events merge rules
牛病毒性腹泻病毒(Bovine viral diarrhea virus, BVDV)是引起牛病毒性腹泻/黏膜病的病原。BVDV是黄病毒科瘟病毒属的单股正链RNA病毒[10-11],瘟病毒的命名是根据其最初发现的宿主来确定的,但在多种家畜和野生动物中均发现并分离到BVDV[12]。BVDV可根据5'UTR序列分为Ⅰ型和Ⅱ型两种基因型[13],目前已发现1a-1u及2a-2d共25个亚型[14],根据能否产生细胞病变将其分为非致细胞病变型NCP和致细胞病变型CP两种生物型[15]。
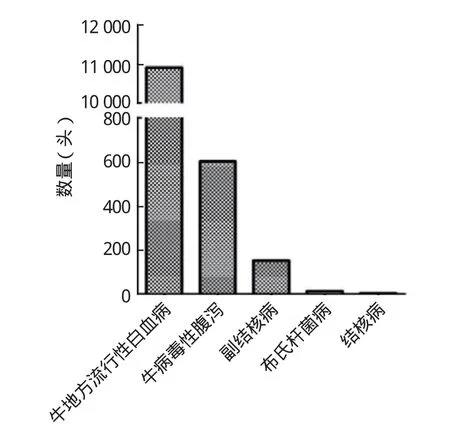
图2 近年乌拉圭输华牛检疫情况Fig.2 Quarantine situation of cattle imported from Uruguay to China in recent years
2.2 释放评估
2.2.1 牛地方流行性白血病的释放评估
2.2.1.1 乌拉圭输华肉牛携带BLV可能性 BLV属于反转录病毒,易感动物感染后,BLV将整合到CDS+B细胞的DNA中形成前病毒,造成感染动物终生带毒,因此动物血清中抗体呈阳性即可说明该动物携带有BLV。本研究收集了有关乌拉圭输华牛境内外隔离检疫的数据,李志荣[16]在一批乌拉圭进口奶牛的境外预检中,发现该批牛在农场检疫及境外隔离场检疫时BLV抗体阳性率为18.28%;据相关资料,我国近年来共计9个批次(A-I)乌拉圭输华牛检疫结果显示(图3),其中一批牛在农场、境内外隔离场BLV的累积检出率可达30.75%。
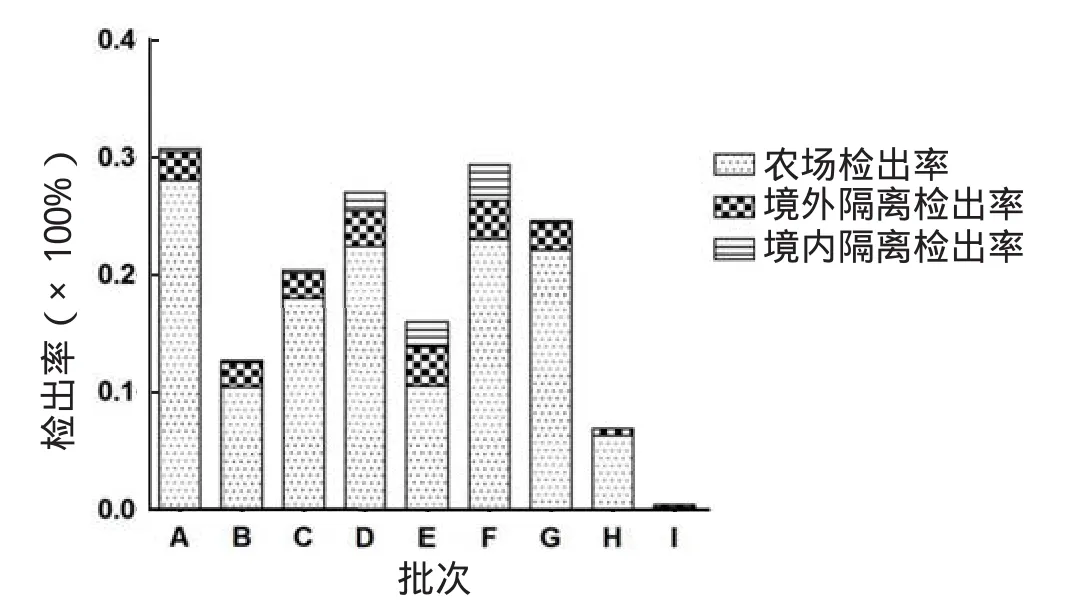
图3 9个批次乌拉圭输华牛BLV检疫结果Fig.3 Detection results of BLV about nine batches of Uruguayan cattle exported to China
上述BLV的累积检出率并不能完全反映当地实际流行率,因为两国议定书条款对输华牛农场的动物卫生条件有相对较高的要求,当地普通农场的BLV流行情况可能更为严峻。有报道显示,乌拉圭周边国家的牛BLV个体阳性率约为33%~50%,群体阳性率可达84%[17],阿根廷一项调查对363个牛群的10 000份以上的血液样本进行了检测,个体阳性率达到32.85%[18]。乌拉圭与阿根廷之间仅有乌拉圭河分隔,与巴西几乎不存在地理分隔与自然屏障,也不存在OIE承认的非疫区,乌拉圭牛群中BLV的实际流行率较检出结果很有可能高于32.85%,因此据表1认定乌拉圭输华牛感染BLV可能性为“轻微”,不确定性为“低”。
2.2.1.2 BLV感染牛发生漏检可能性 根据议定书规定的检疫流程,乌拉圭输华牛在农场检疫及境外隔离检疫期间,针对该病需要进行AGID琼扩试验或ELISA检测,采用的试剂盒由IDEXX公司或Synbiotics公司生产,均具有ISO9001:2000认证且符合欧盟ECC认证标准。赵祥平[19]、王作佳等[20]重复验证了ELISA、AGID两种方法用于检测3998头乌拉圭进口奶牛BLV感染情况,结果显示,两种方法在统计学差异不显著,而且ELISA方法检出率略高。有报道显示,ELISA方法的敏感性和特异性可达97.2%和97.5%[18]。除检测方法的敏感性影响可能产生漏检,动物的感染阶段和个体发育水平也会对检测造成干扰,BLV感染后期的体液免疫反应降低导致血清中抗体水平下降[21-22],ELISA检测可能会发生假阴性;而利用gp51的AGID试验由于灵敏度低于ELISA,在对早期感染样本或者分娩前后的母牛样本检测时,由于血清抗体水平下降也可能出现假阴性[23],赵祥平等[19]也证实了这一观点。
李志荣[16]报道,经农场检疫后的乌拉圭牛在后续境外隔离场中BLV仍然有2.18%的检出率;本研究收集数据显示,9个批次乌拉圭输华牛经过农场检疫后在后续境外隔离及境内隔离检疫均有阳性样本检出,比例由0%~5.06%不等,可证实有部分感染牛在检疫环节发生漏检。据表1可认为乌拉圭感染BLV的牛发生漏检的综合可能性为“低”,不确定性为“中”。
若风险评估中的各风险事件均为非独立事件,组合后发生的可能性会降低(表6),乌拉圭输华牛携带BLV的可能性、发生漏检的可能性分别为“轻微”、“低”,根据风险可能性描述合并规则,可得出牛地方流行性白血病的释放风险为“很低”。
2.2.2 牛病毒性腹泻释放评估
2.2.2.1 乌拉圭输华肉牛携带牛病毒性腹泻病毒可能性 据报道,乌拉圭约69%的肉牛群体感染过BVDV[24],然而抗体阳性率并不能全面反映牛群中带毒牛的概率,因为BVDV主要的携带者和传染源是发生持续性感染(persistent infection,PI)的牛。有研究认为,在受感染的牛群中PI牛的数量约占0.5~2%[25]。虽然疫苗接种在一定程度上可以降低PI牛的出生,但乌拉圭仅有3%肉牛群体定期进行免疫[24],一项对乌拉圭3个省份牛血样进行的抗原捕捉ELISA(AC-ELISA)试验显示,未接种BVDV疫苗的牛抗原阳性率可达4.1%[26]。窦树龙等[27]报道,2017年乌拉圭输华牛BVDV检出率为1.67%;李志荣[16]报道,在乌拉圭境外预检中农场及境外隔离场BVDV检出率分别为0.54%和0.05%;2014-2018年,乌拉圭输华牛BVDV检出率为0.62%~2.03%。综上,乌拉圭输华牛BVDV阳性率小于5%,携带BVDV可能性为“很低”。
2.2.2.2 带毒牛发生漏检可能性 根据议定书规定的检疫流程,乌拉圭输华牛在农场检疫及境外隔离检疫期间,需要进行病毒分离试验或用抗原捕捉ELISA(antigen capture enzyme linked immunosorbent assay,AC-ELISA)进行检测,在进入隔离场后7 d内再进行一次AC-ELISA试验(IDEXX)[16,28]。病毒分离试验是检测BVDV的金标准[29],但无法鉴别发生持续性感染或处于急性感染期的牛,而且犊牛血液中游离病毒受母源抗体影响降低也会干扰检测[30]。为了弥补这一缺陷,通常采用基于捕获病毒复制过程中受感染细胞分泌的gp48蛋白的ACELISA,该方法可以有效检出PI牛[31]。有研究报道,应用Svanovir公司生产的ELISA试剂盒,其敏感性和特异性分别可达到97.9%和99.7%[24];Hill等[32]使用AC-ELISA对牛血清及耳部皮肤组织进行BVDV检测,结果与PCR检测结果完全符合;Bhuyan[33]优化了AC-ELISA条件,不仅降低了检测限,同时与TaqMan qRT-PCR和传统RT-PCR的检测结果保持了高度一致;Kramps[34]利用针对猪瘟病毒非结构蛋白NS3的单克隆抗体构建竞争ELISA方法检测BVDV,与病毒中和试验结果相比,其敏感性和特异性达99%和98%。丹麦等多个国家也将AC-ELISA方法应用于监测净化BVDV计划中。以上报道说明,ACELISA可以与分子检测方法达到相同的可靠性,然而,由于病毒感染的阶段不同、动物的个体差异或人员操作失误,漏检仍有可能发生。据本研究收集的2014-2018年我国从乌拉圭进口牛检疫数据统计显示,多个批次的乌拉圭输华牛在农场隔离检疫后,在境外隔离场仍有0.05%~0.69%的BVDV检出率,这些批次牛在境内BVDV检出率最高可达0.22%。综上,可以认为感染BVD的乌拉圭肉牛发生漏检的概率为“很低”,不确定度为“低”。
根据风险可能性描述合并规则(表6),由乌拉圭肉牛携带BVDV可能性为“很低”和带毒牛发生漏检的概率为“很低”,得出BVD的释放风险为“可忽略”。
2.3 暴露评估
2.3.1 牛地方流行性白血病的暴露评估
2.3.1.1 我国健康易感动物比例 1978年,我国于新疆首次发现BLV感染病例[35],根据多项流行病学调查显示,BLV在我国江苏、上海、重庆等多个省市自治区均有分布,李凯航等[36]调查了2007-2009年上海市规模化牛场的BLV阳性率为11.3%~32%;杨泽林等[37]报道了重庆市11个区县,BLV总体阳性率达11.2%;陈小丽[38]对福建7个规模化牛场和14个散养农户的牛群进行了检测,BLV阳性率达到18.1%;我国牦牛的BLV分子流行病学调查显示,甘肃天祝县和甘南藏族自治州的牦牛BLV阳性率分别为18.93%和19.14%,青海省和四川省牦牛BLV阳性率也达到14.83%和14.94%[39];2016年,一项调查检测了我国19个省份3353份牛血液样本,结果显示,在我国15个省份的肉牛场BLV阳性率为1.5%,6个省份的奶牛场BLV阳性率为49.1%[40]。综上,我国牛群中BLV流行率约为11.2%~49.1%,可认为我国健康易感动物的比例为“中”,不确定度为“低”。
2.3.1.2 我国健康易感动物未接种疫苗可能性 该病目前尚无有效的疫苗可用于预防接种,澳大利亚、新西兰等国家均采用血清学监测结合扑杀阳性动物来净化该病并取得了成功[41-42]。也有很多研究者试图从持续感染的细胞系中提取BLV制备灭活疫苗,尽管有些产生了一定的免疫保护,但由于保护性抗体滴度下降过快或存在潜在的传播疫病风险,因此还没有稳定可靠的商品化疫苗上市[43-47]。在新型疫苗的探索过程中,有研究者使用重组牛痘病毒作为载体的BLV疫苗,虽然能同时诱导体液免疫和细胞免疫,但在实验过程中仅能降低人工感染绵羊体内前病毒的载量[48];同样,DNA疫苗虽然在短时间能产生强烈的免疫反应,但最终也不能产生可靠的保护效果[49]。鉴于国内尚无商品化的BLV疫苗可供使用,因此可以认为我国健康易感动物未接种疫苗的可能性为“高”,不确定度为“低”。
2.3.1.3 我国易感动物接触该病原的可能性 该病的病原BLV自然状况下可感染牛(包括瘤牛及水牛)[50],也可人工感染绵羊[22]、羊驼[51]等动物,其传播方式有垂直传播和水平传播,垂直传播即感染母牛通过胎盘、产道或哺乳将该病传给胎牛或犊牛[52]。本案例中仅讨论乌拉圭进口屠宰用牛,所进口的牛不作繁殖种用,在临床检查时均已对妊娠期母牛予以剔除,因此可忽略其垂直传播带来的风险。而水平传播途径主要通过手术器械交叉使用[41]、吸血昆虫叮咬[53]或与感染牛分泌物、排泄物接触[54]感染。一项2013年的调查表明,尽管日本的牛场已基本避免重复使用注射针头和直肠检查塑料手套等手术器械[41],然而同实验室调查显示,日本奶牛和肉牛群中BLV的阳性率分别是1980-1982年的报道的10倍和4倍[55],可见除手术器械交叉感染外,其他传播途径造成牛群感染BLV更为严重。乌拉圭输华牛部分用于急宰销售,几乎不会与其他动物接触,我国也明令禁止向反刍动物饲料中添加动物源性成分,因此多数牛不具备与我国易感动物直接接触的可能。然而有研究发现,在感染BLV的牛相邻圈舍饲养的健康牛感染的危险系数明显升高,在间隔4~6个月的二次检测中即可发现健康牛遭受感染[56],说明无需直接接触也会造成BLV的传播。本研究认为这很有可能是通过吸血昆虫进行传播。据报道,蚊、虻、蜱、厩蝇、角蝇等多种吸血昆虫均可传播BLV[57],而我国蚊[58]、虻[59]、蜱[60]种类丰富、分布广泛,给BLV的暴露提供了机械性传播的虫媒。考虑到进口牛中存在青年牛、架子牛,在后续的育肥饲养、运输销售、分群混群等过程中存在着通过水平传播途径将携带的BLV暴露给我国易感动物的可能,因此认为乌拉圭输华牛将BLV暴露给我国易感动物的可能性为“中”,不确定度为“中”。根据风险可能性描述合并规则(表6),两次逐级评估可得出EBL的暴露风险为“中”(图4)
2.3.2 牛病毒性腹泻的暴露评估
2.3.2.1 我国健康易感动物比例 1983年,我国首次分离并鉴定了该病的病原BVDV[61],此后,我国多个省市自治区都有相关报道,何小丽等[62]对宁夏地区的BVDV流行病学调查显示抗原阳性率为0.3%;2018年,勃林格殷格翰公司调查显示,我国46.7%牛场抗原呈阳性,其中PI牛的数量约占2.2%。其他研究也表明我国牛群体和个体感染率处于很高的水平。刘泽宇等[63]对吉林某牛场157份血清样本进行BVDV检测,发现抗原阳性率达到12.1%;张信军等[64]对江苏省5个市和不同地区11个牛场的100份血清样品进行了BVDV抗原和抗体的检测,其中有15%的样本呈现抗原阳性而抗体阴性,分析认为这些牛可能是处于检测窗口期或PI牛;孙文梅等[65]对上海市规模牛场的BVDV监测发现,2016年和2017年抗原阳性率分别为12.7%和16%,呈现逐年上升的趋势;新疆地区牛抗原阳性率甚至高达39.06%~43%[66-67]。综上,可以认为我国健康易感BVDV动物比例为“中”,不确定度为“低”。
2.3.2.2 我国健康易感动物无免疫保护可能性 BVD的预防可以使用灭活或减毒苗,但无法区分野毒感染给血清学监测带来难度[68]。现今的疫病控制措施对疫苗的要求已经从减轻或预防BVDV引起的消化道、呼吸道临床症状转变为预防胎牛受感染形成PI牛,但是研究发现一些经注册的疫苗并不能完全有效阻断胎盘感染途径,最高有15%的胎牛可能无法获得保护[69-71]。同时由于BVDV存在两种生物型及多种基因型和亚型,疫苗的生产厂商只能生产单价或有限种类的多价疫苗,而且疫苗对同源的毒株保护效力通常都优于其他型毒株[72],因此可能无法对其他型毒株提供充足的保护力。有研究证明,BVDV1aNADL疫苗仅能在实验室条件下对BVDV2型毒株产生保护,对BVDV2型野毒株无法产生交叉保护[73],所以疫苗的选择和免疫策略需要根据当地BVDV流行情况和动物健康状况进行选择才能起到良好的保护作用,处于急性感染期的牛可能会产生免疫抑制,此时进行免疫接种可能导致免疫失败。疫苗的接种率也是评价有无免疫保护的重要因素,据统计,进口来源国乌拉圭仅有3%肉牛群定期接种[24],而美国2004年以来许多州自发组织的BVD的控制计划中80%的牛接种BVDV灭活或减毒苗,使得动物阳性率逐步得到控制[74](USAD2007)。我国尚未有类似欧洲国家严格的BVDV防控净化措施实施,生产者趋利避害的博弈心理可能导致我国牛群的疫苗接种情况不容乐观,BVDV的广泛流行也说明我国有相当部分的牛并无定期接种BVDV疫苗。综上,可以认为我国健康易感动物无免疫保护的可能性为“高”,不确定度为“中”。
2.3.2.3 我国易感动物接触该病原的可能性 BVD是由BVDV引起的一类消化、呼吸、生殖系统损害的疫病[31]。BVDV与猪瘟病毒、绵羊边界病毒同属黄病毒科瘟病毒属,且具有血清学交叉反应,因此除各种牛外,猪、绵羊、山羊、鹿等多种家畜及野生动物都可感染[75-76]。BVDV的传播主要是水平途径以及垂直途径,口鼻接触患病动物的排泄物、分泌物或被污染的饮水、饲料是引起感染的主要方式,温度适合情况下BVDV可以在粪便或土壤中存活2周以上[77],鲜有报道其可通过空气传播[78]。牛群中的PI牛是主要的传染源,其不易检出且终身可向外界排毒造成牛群中重复感染[79-80]。此外,过高的种群密度也会造成BVDV的迅速传播,一项调查显示,在超过500头数的牛群中抗原阳性率可高达12.8%[74],从乌拉圭进口牛主要依靠轮船装运,每批次进口头数多、装运船只的空间过小将增大群体密度,可能为BVDV提供良好传播条件。同样,吸血昆虫[81]、共用的诊疗器械[78]、受污染的疫苗[68]等也是重要的传播媒介。综上,BVDV的易感动物种类丰富、传播途径多样,进口感染牛在我国隔离场期间,可能通过间接途径感染隔离场周围的家畜及野生易感动物,其中青年牛、架子牛在后续的育肥饲养、运输销售、分群混群等过程中,也存在着将携带的BVDV暴露给我国易感动物的可能,因此认为乌拉圭输华牛将BVDV暴露给我国易感动物的可能性为“中”,不确定度为“中”。
根据风险可能性描述合并规则,2次逐级评估可得出BVD的暴露风险为“中”。
2.4 后果评估
2.4.1 牛地方流行性白血病的后果评估 2岁以下的牛感染BLV后多数并不表现临床症状,随着感染时间延长,病程复杂多变,3~6岁的牛发病率较高。早期临床症状常表现为持续性淋巴细胞增多症且持续较长时间,研究认为仅有5%左右的感染牛会发展成淋巴肉瘤或其他肿瘤,发生淋巴肉瘤的牛中约有5%的牛呈急性经过,因内出血而突然死亡。肉牛的养殖周期较短,即使发生感染也很少表现临床症状,因此认为对动物发病率死亡率的影响为“次要”。
有研究认为BLV的感染对奶牛群体产奶量有影响[82-83],尤其对处于高产期的牛群影响更为显著[84]。此外感染BLV的牛产出的奶中体细胞数升高,导致乳品品质下降[85],甚至还有研究发现,在未经加工的牛乳中可检测到BLV核酸[86];有报道称,BLV可能与人类乳腺癌发病有关[87],对公共卫生和食品安全有着潜在的风险。同时,BLV的感染会使奶牛寿命缩短或因生产性能下降而提前淘汰[88-89]。因此认为对动物生产性能影响为“严重”。
目前,国际公认检疫结合扑杀是逐渐净化该病的方法,后续还需要进行长期持续的血清学监测,这无疑增添了饲养管理的成本。澳大利亚和新西兰用该方法,历经30年左右才实现该病净化[42]。牛发生死亡或淘汰、母牛的产犊间隔延长、产奶量降低及乳品质量降低都将造成一定的经济损失,可认为对经济的影响为“严重”。
BLV传播的方式限定了其仅能通过垂直传播、直接接触、媒介传播进行,在不发生大规模的长途运输、混群饲养的情况下,其流行范围可认为“地区”。
依据外来牛携带的BLV对我国易感动物感染发病、生产性能、经济影响结合影响范围,依据表5将EBL的风险等级判为“C/D/D”,参照SNT2486-2010标准中描述:如果一个以上的风险因素的评价结果是“D”,其后果可评估为“中”,即进口乌拉圭肉牛将EBL传入我国导致的后果评估为“中”。
2.4.2 牛病毒性腹泻的后果评估 多数非妊娠牛感染BVDV后呈现一过性感染,从感染后3天开始形成暂时性的病毒血症,几乎不表现临床症状,通常在2周后能够自愈[90],也有少数牛出现急性高热、腹泻、跛行等症状,低于7月龄的牛易发生急性呼吸道症状导致死亡[91];因此认为对动物发病死亡率的影响为“次要”。
对于妊娠期或有妊娠计划的牛而言,BVDV的急性感染还会导致受孕率降低、胚胎早期死亡[92]、流产和胎牛先天性缺陷[93];此外BVDV还会降低种用公牛的精子活力及密度,增高精子畸形概率[94],降低受精率[95];母牛在妊娠25天~90天感染BVDV还会造成胎牛形成PI牛[96-97],PI牛可造成牛群中循环感染。因此对于动物生产性能的影响为“严重”。
除直接感染牛造成发病和死亡,BVDV还可通过自然感染或污染疫苗等途径造成猪的感染[98-99],据报道北美地区猪群BVDV感染率可达2%~40%[100]。自然感染的猪可出现类似低毒力猪瘟感染引起的发热、嗜睡、腹泻、败血症、消化道炎症等症状,部分猪可能发生死亡,妊娠母猪感染可产下PI仔猪[101]。而且BVDV与猪瘟病毒存在抗原交叉性,给猪瘟的诊断和检测造成了一定的干扰[102]。同样,由于和羊边界病毒也存在抗原交叉性,BVDV同样可以感染山羊,引起生殖障碍以及产下PI羊羔[103-104]。因此可认为BVDV的其他影响为“次要”。
BVDV对环境抵抗力强,传播方式复杂多样,且能感染多种家畜和野生动物,我国自1980年首次发现该病,近40年来已在我国各省市自治区广泛分布[63-67,105-106],可认为其流行范围为“全国”。
在以上分析基础上,依据表5将BVD的风险等级评估为“D/E/D”,参照SNT2486-2010标准中描述:如果只有一个风险因素的评价结果是“E”,其余风险因素评价结果是“D”或不全是“D”,其后果可评估为“高”,即进口乌拉圭肉牛将BVD传入我国导致的后果评估为“中”。
2.5 最终风险定性结果
2.5.1 牛地方流行性白血病的最终风险定性结果 根据表6合并释放与暴露风险,可得出EBL的释放和暴露综合风险为“很低”。再与其后果评估风险合并,最终乌拉圭输华牛引入EBL的风险评估为“很低”(图4)。
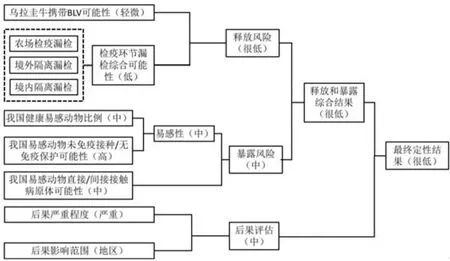
图4 乌拉圭输华肉牛传入EBL的定性风险评估结果Fig.4 Qualitative risk assessment results of transmitting EBL by beef cattle imported from Uruguay
2.5.2 牛病毒性腹泻的最终风险定性结果 根据表6风险评估原则合并释放与暴露风险,可得出BVD的释放和暴露综合风险为“可忽略”。再与其后果评估风险合并,最终得出乌拉圭输华牛引入BVD的风险评估为“可忽略”(图5)。

图5 乌拉圭输华肉牛传入BVD风险评估结果图Fig.5 Qualitative risk assessment results of transmitting BVD by beef cattle imported from Uruguay
3 讨论
本研究通过对乌拉圭输华肉牛携带EBL和BVD入境、传播、致病过程中各个环节进行梳理,对其释放、暴露风险及后果严重性进行了评估,EBL释放和暴露风险分别为“很低”和“中”,后果严重程度为“中”,最终得出乌拉圭输华肉牛引入EBL的定性评估结果为“很低”;BVD释放和暴露风险分别为“可忽略”和“中”,后果严重程度为“高”,最终得出乌拉圭输华肉牛引入BVD的定性评估结果为“可忽略”。
在现有动物卫生状况下,依据贸易规定检疫流程进行操作,乌拉圭牛携带EBL进入我国境内可能性“很低”,且具有大量文献及详实数据佐证,不确定度“低”。只要我国在进口贸易过程中把控好各个检疫环节,避免人为操作因素引起的漏检,对灰区样本采用数字PCR或其他更为灵敏的方法进行复检,就可大大降低该病入境可能,降低释放风险进而从整体上降低该病最终风险。
EBL目前尚无有效的疫苗可用于防控,而我国存在着大量的易感牛群,其传播模式决定了其通常呈现散发或地方性流行,所以乌拉圭输华牛将该病暴露给我国易感牛群的可能性为“中等”,且随着国内牛的贸易、运输进行,会使国内牛群阳性率逐步上升,净化控制难度增加。因此降低暴露风险可以从以下方面进行:第一,输华牛中需要育肥饲养的青年牛、架子牛应减少运输次数,杜绝与我国牛群混群饲养;第二,做好牛群厩舍的灭蚊、灭蝇以及牛的体外驱虫工作,阻断昆虫媒介;第三,耳标打孔器、直肠检查手套等器械应避免交叉使用。
BVD最终定性结果为“可忽略”的主要原因,是由于当地该病流行率较低和我国现行隔离检疫措施合理可靠、抽样检测方法科学有效,使得释放风险大大降低。然而,我国易感动物的免疫接种不够普及使得暴露风险评估为“中”。由于BVDV可感染多种家畜、引起动物发病死亡、生产性能下降,而且其传播途径多样,可造成大范围流行,带来的后果评为“高”。因此需要对进口来源国该病流行率的动态变化保持密切关注,避免因流行率升高导致释放风险升高而引入该病。
定性风险评估由于受到事件不确定性及数据丰富程度的影响,虽然有时不足以很好的量化风险,但仍不失为缺少数据时良好的评估手段[107]。本研究通过对乌拉圭输华肉牛各个环节进行梳理、收集数据及文献报道、逐步分析,为收集详实的数据、开展其定量风险评估打下良好基础。
