迷迭香酸通过调控自噬抑制高糖诱导的HRMEC血管生成
2020-11-17李蓉陈琳李亚马雅玲周凌霄
李蓉,陈琳,李亚,马雅玲,周凌霄
糖尿病的全球患病率正逐年快速增长,已成为继心脑血管疾病及肿瘤之后的第三位危害人类健康的慢性非传染性疾病[1]。糖尿病并发症是糖尿病患者发病和死亡的主要原因,其中,糖尿病性视网膜病变(diabetic retinopathy,DR)是糖尿病最常见的微血管并发症[2]。临床上将DR分为非增殖性糖尿病视网膜病变 (nonproliferative diabetic retinopathy,NPDR)和增殖性糖尿病视网膜病变 (proliferative diabetic retinopathy,PDR)两大类,视网膜新生血管(retinal neovascularization,RNV)的形成是疾病发展为PDR的标志,其继发的玻璃体积血和视网膜脱离是患者视力丧失的主要原因[3]。
迷迭香酸(rosrarinicacid,RA)是一种天然水溶性的多酚羟基化合物,广泛分布于唇形科、紫草科、葫芦科等植物中[4]。研究[5-6]表明,RA具有抗氧化、抗炎、免疫调节、抗肿瘤、抗菌和抗病毒等多种药理作用。在很多疾病中显现出极大的治疗潜能,然而,RA是否对DR有效尚缺乏研究。自噬是广泛存在于各种真核细胞内的一种溶酶体依赖性降解途径,是细胞进行自我保护的一种重要机制,在维持细胞存活、更新、物质再利用和内环境稳定等机体生理过程中起着非常重要的作用[7-8]。已有研究[9-10]证实,自噬参与RNV的血管形成过程。基于此,本研究观察RA对高糖条件下的人视网膜微血管内皮细胞(human retinal microvascular endothelial cells,HRMEC)增殖、迁移和管腔形成的作用以及其与自噬之间的关系,旨在阐明RA对DR的效应及机制。
1 材料与方法
1.1 材料与仪器
人视网膜微血管内皮细胞(HRMEC)(上海中乔新舟生物科技有限公司,中国)。M199培养基、胎牛血清及0.25%胰酶(Gibco公司,美国);青链霉素(索莱宝公司,中国);迷迭香酸(RA)(上海恒斐生物科技有限公司,中国);MTT(Sigma公司,美国);二甲基亚砜(DMSO)(Amresco公司,美国);Transwell小室、Matrigel(BD公司,美国)。细胞RIPA裂解液、BCA蛋白浓度测定试剂盒(碧云天生物技术有限公司);PVDF膜(0.45 μm,Millipore公司,美国);兔多抗LC3-II/LC3-I(14/16KD,Affinity公司,美国);兔单抗Beclin-1(52KD,Abcam公司,英国);HRP标记羊抗兔二抗(武汉博士德生物工程有限公司);ECL底物液(北京普利莱基因技术有限公司)。CO2恒温培养箱(MCO-15AC型,SANYO,日本);倒置相差显微镜(IX51型,Olympus,日本);低速离心机(5702R型,Eppendorf,美国);全自动酶标仪(Multiskan MK3型,Thermoscientific,美国);透射电子显微镜(HT7700-SS型,HITACHI公司,日本)。
1.2 方法
1.2.1细胞培养 将解冻后的细胞转移至含有5 ml M199培养基的离心管中,离心收集细胞,弃上清,用含10%胎牛血清和1%青链霉素双抗的M199培养基悬浮细胞,接种到培养皿中,吹打混匀,在5%CO2、37℃充分湿化条件下培养。当细胞的密度达到80%时,按1:3的比例传代。
1.2.2细胞分组及处理将细胞随机分为5组。正常对照组(NC组):在低糖培养基中培养;高糖组(HG组):在培养基中加入30 mmol/L D-葡萄糖进行培养;低浓度RA组(LC组):培养基中加入25 μmol/L RA+30 mmol/L D-葡萄糖进行培养;中浓度RA组(MC组):培养基中加入50 μmol/L RA+30 mmol/L D-葡萄糖进行培养;高浓度RA组(HC组):培养基中加入100 μmol/L RA+30 mmol/L D-葡萄糖进行培养。所有细胞均在5%CO2、37℃充分湿化条件下培养。
1.3 观察指标
1.3.1MTT法检测细胞增殖 将HRMEC体外培养于含10%胎牛血清和1%青链霉素双抗的M199培养基中,在5%CO2、37℃充分湿化条件下的培养箱中培养。取指数期生长的细胞,先用M199完全培养基将细胞配置成单个细胞悬液,然后采用倍比稀释法,调节细胞的浓度为5×104个/ml,最后将调节好浓度的细胞悬液接种于96孔板,每孔100 μl。将接种细胞的96孔板放入培养箱内培养过夜,吸出旧培养基,按照不同分组加入相应的试剂。同时,分别设调零孔和对照组,把加好样的96孔板置于培养箱中培养48 h。每孔加入10 μl MTT(5 g/L),继续培养4 h后终止培养,小心弃掉上清液,然后每孔加入150 μl DMSO,置摇床上低速振荡10 min后在酶联免疫检测仪568 nm处测量每孔的OD值。根据公式计算细胞的增殖率:增值率(%)=(OD实验组-OD对照组)/(OD对照组-OD空白组)×100%。其中,空白组及调零孔仅含有培养基而没有接种细胞,对照组用M199完全培养基按常规方法培养细胞。
1.3.2Transwell法检测细胞迁移 取生长状态良好的细胞,制备单细胞悬液,计数后按照每孔5×105个接入6孔板,5%CO2、37℃充分湿化条件下培养过夜。0.25%胰酶消化细胞,终止消化后离心,用无血清培养基调整细胞密度至2×105个/ml。在配套的24孔板孔内加入800 μl含10%胎牛血清的M199培养基,将Transwell小室放进24孔中,确保没有气泡(每组设3个复孔)。取无血清细胞悬液200 μl加入Transwell小室的上室中,常规培养48 h。取出上室,将未穿膜的上室内细胞用湿棉签擦去,70%冰乙醇固定细胞1 h。移到0.5%结晶紫染液的孔中染色20 min。蒸馏水冲洗,风干小室,剪下小室膜,晾干,二甲苯和中性树胶(按1:1的比例)封片。干燥后置于正置显微镜下随机选择3个高倍视野拍照,计算穿过Transwell小室膜的平均细胞个数。
1.3.3Matrigel基质胶法检测细胞管腔形成提前1 d将-20℃保存的Matrigel基质胶置于4℃环境中解冻,在24孔板中加入200 μl Matrigel基质胶,放入37℃、5%CO2培养箱中凝固待用。取各组培养48 h的细胞,0.25%胰酶消化,然后用无血清M199培养基重悬至2×105个/ml,按1 ml/孔加入到铺有Matrigel基质胶的24孔板中,每组3孔,于37℃、5%CO2培养箱中培养,隔2 h观察1次,当管腔形成时立即于显微镜下拍照(一般为6~8 h,≥3个细胞/分支),随机选取100倍下的3个视野,用Image软件对管腔形成数进行计算,取平均值。
1.3.4透射电镜观察自噬泡 各处理组细胞培养48 h,0.25%胰酶消化,离心收集细胞,用2.5%戊二醛固定6 h,无菌PBS缓冲液漂洗2次,然后用1%锇酸固定2 h,连续梯度乙醇法细胞脱水,Embed-812媒介环氧树脂包埋48 h,制备60 nm超薄切片,经醋酸铀及枸橼酸铅染色,待切片干燥后在透射电子显微镜下观察细胞内超微结构的形态学改变,以判断细胞自噬泡(自噬小体、自噬溶酶体)的形成情况。自噬小体多为双层或多层膜性液泡状结构,里面包含胞浆成分,如核糖体、线粒体等。自噬溶酶体多为单层膜,胞浆成分大多消失、降解,无完整结构。
1.3.5Western blot法检测自噬蛋白LC3、Beclin-1的表达 取处于对数生长期且生长良好的HRMEC接种于六孔板(5×105个/孔)中培养24 h后,根据不同分组处理细胞,培养48 h,终止药物处理,收集细胞。将其置于含蛋白酶抑制剂的RIPA裂解液中,冰上裂解30 min,12000 r/min离心5 min后取上清,BCA法进行蛋白定量。取20 μg蛋白与5×上样缓冲液混合,97℃煮沸变性10 min,10%的SDS-聚丙烯酰胺凝胶进行电泳分离,电转移法转至PVDF膜上,以含5%脱脂奶粉的TBST溶液室温封闭2 h,再分别与兔多抗LC3-II和LC3-I (1:1000)、兔单抗Beclin-1(1:2000)4℃孵育过夜,TBST溶液洗涤后和相应的二抗(HRP标记,1:50000)37℃孵育2 h,ECL显色,X线压片曝光30~180 s,扫描胶片,BandScan软件分析胶片灰度值。
1.4 统计学方法
采用SPSS 19.0软件进行数据统计分析,实验数据以均数±标准差()表示,多组间比较采取方差分析,两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 RA对高糖条件下HRMEC增殖的影响
各组细胞增殖率分别为:NC组(99.97±0.88)%、HG组(162.73±0.66)%、LC组(153.13±1.92)%、MC组(147.59±2.00)%、HC组(132.27±0.97)%。5组之间比较,差异具有统计学意义(F=915.843,P=0.000)。与NC组比较,其他4组细胞增殖率均增加(tHG=-98.465,tLC=-43.633,tMC=-37.679,tHC=-42.703,均P=0.000);与HG组比较,LC组、MC组、HC组细胞增殖率均降低(tLC=8.198,P=0.001;tMC=12.427,P=0.000;tHC=44.898,P=0.000);与LC组比较,MC组、HC组细胞增殖率降低(tMC=3.461,P=0.026;tHC=16.817,P=0.000);与MC组比较,HC组细胞增殖率降低(t=11.921,P=0.000),差异均有统计学意义。增殖率随着RA浓度的升高而降低(图1)。
2.2 RA对高糖条件下HRMEC迁移的影响

图1 各组HRMEC形态图(×100)及增殖能力比较。1A-1E细胞形态图。1A正常对照组;1B高糖组;1C低浓度RA组;1D中浓度RA组;1E高浓度RA组。1F各组细胞增殖能力比较。NC正常对照组;HG高糖组;LC低浓度RA组;MC中浓度RA组;HC高浓度RA组
各组细胞迁移数(个)分别为:NC组(41.00±5.29)、HG组(118.67±2.52)、LC组(78.67±3.06)、MC组(67.33±3.06)、HC组(53.67±4.93)。5组之间比较,差异具有统计学意义(F=171.709,P=0.000)。与NC组比较,其他4组的细胞迁移数均增加(tHG=-22.958,P=0.000;tLC=-10.677,P=0.000;tMC=-7.465,P=0.002;tHC=-3.033,P=0.039);与HG组比较,LC组、MC组、HC组细胞迁移数均降低(tLC=17.504,tMC=22.463,tHC=20.330,均P=0.000);与LC组比较,MC组、HC组细胞迁移数降低 (tMC=4.543,P=0.010;tHC=7.463,P=0.002);与MC组比较,HC组细胞迁移数降低(t=4.080,P=0.015),差异均有统计学意义。迁移数随着RA浓度的升高而降低(图2)。
2.3 RA对高糖条件下HRMEC管腔形成的影响
各组细胞管腔形成数(个)分别为:NC组(48.33±2.08)、HG组(95.67±5.51)、LC组(83.33±2.52)、MC组(69.67±2.52)、HC组(58.67±1.53)。5组之间比较,差异具有统计学意义(F=107.829,P=0.000)。与NC组比较,其他4组细胞管腔形成数均增加(tHG=-13.924,P=0.000;tLC=-18.562,P=0.000;tMC=-11.314,P=0.000;tHC=-6.932,P=0.002)。与HG组相比,LC组、MC组、HC组细胞管腔形成数均降低(tLC=3.528,P=0.024;tMC=7.437,P=0.002;tHC=11.213,P=0.000);与LC组比较,MC组、HC组细胞管腔形成数均降低(tMC=6.651,P=0.003;tHC=14.513,P=0.000);与MC组比较,HC组细胞管腔形成数降低(t=6.472,P=0.003),差异均有统计学意义。管腔形成数随着RA浓度的升高而降低(图3)。

图2 各组HRMEC迁移情况(×200)及迁移能力比较。2A-2E细胞迁移情况。2A正常对照组;2B高糖组;2C低浓度RA组;2D中浓度RA组;2E高浓度RA组。2F各组细胞迁移能力比较。NC组正常对照组;HG高糖组;LC低浓度RA组;MC中浓度RA组;HC高浓度RA组

图3 各组HRMEC管腔形成情况(×100)及形成能力比较。3A-3E细胞管腔形成情况。3A正常对照组;3B高糖组;3C低浓度RA组;3D中浓度RA组;3E高浓度RA组。3F各组细胞管腔形成能力比较。NC正常对照组;HG高糖组;LC低浓度RA组;MC中浓度RA组;HC高浓度RA组
2.4 RA对高糖条件下HRMEC自噬泡的影响
在透射电镜下可以观测到各组HRMEC细胞内超微结构的形态变化。实验结果显示,NC组中细胞内有多个自噬体和(或)自噬溶酶体存在,与NC相比较,HG组细胞质内自噬泡明显增多,LC、MC和HC组也能找到自噬泡存在,但镜下自噬泡总体已较HG组减少,且RA浓度越高,自噬泡越少,显示出RA具有较强的抑制自噬泡形成的作用(图4)。
2.5 RA对高糖条件下HRMEC自噬蛋白LC3、Beclin-1表达的影响
各组细胞LC3-II/LC3-I比值、Beclin-1蛋白表达依次分别为:NC组 (0.20±0.01)(0.12±0.01);HG组(0.78±0.01)(0.76±0.01);LC组(0.51±0.01)(0.54±0.03);MC组(0.45±0.02)(0.37±0.03);HC组(0.33±0.02)(0.20±0.02)。
LC3-II/LC3-I比值:5组之间比较,差异具有统计学意义(F=809.942,P=0.000)。与NC组比较,其他4组均增加(tHG=-86.500,P=0.000;tLC=-37.967,P=0.000;tMC=-23.401,P=0.000;tHC=-10.070,P=0.000);与HG组相比,LC组、MC组、HC组均降低(tLC=40.000,tMC=35.002,tHC=37.165,均P=0.000);与LC组比较,MC组、HC组均降低(tMC=6.008,P=0.004;tHC=13.943,P=0.000);与MC组比较,HC组降低(t=8.030,P=0.001),差异均有统计学意义。LC3-II/LC3-I比值随着RA浓度的升高而降低(图5A、5B)。
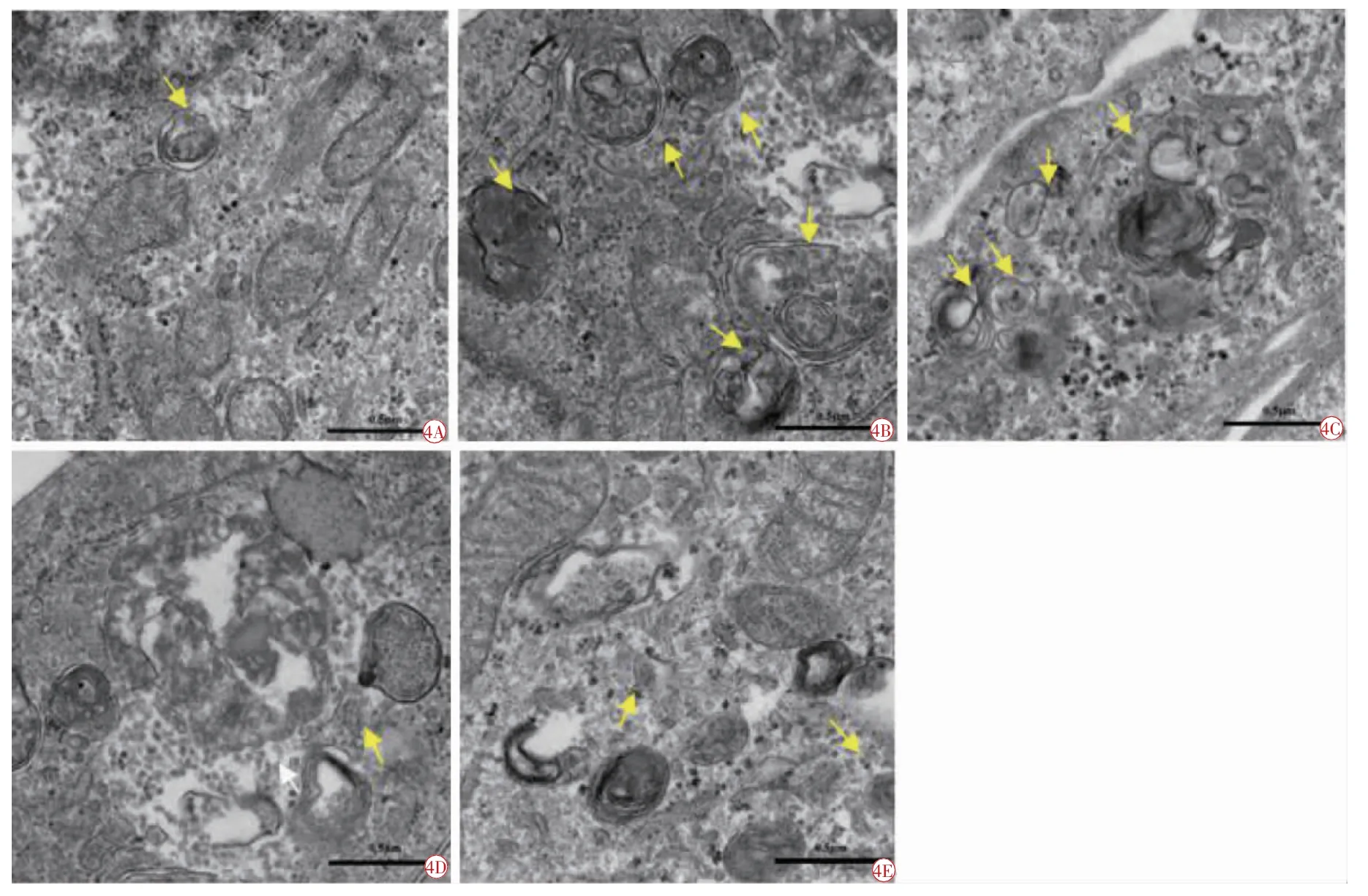
图4 电镜下各组HRMEC自噬泡的形成情况(×100)。4A正常对照组;4B高糖组;4C低浓度RA组;4D中浓度RA组;4E高浓度RA组。自噬体(双层膜)或自噬溶酶体(单层膜)(黄色箭头)
Beclin-1表达:5组之间比较,差异具有统计学意义(F=574.808,P=0.000)。与NC组比较,其他4组表达均增加(tHG=-85.865,P=0.000;tLC=-28.174,P=0.000;tMC=-16.203,P=0.000;tHC=-9.192,P=0.000)。与HG组比较,LC组、MC组、HC组表达均降低(tLC=13.762,tMC=23.200,tHC=50.051,均P=0.000);与LC组比较,MC组、HC组表达均降低(tMC=7.906,P=0.001;tHC=19.612,P=0.000);与MC组比较,HC组表达降低(t=9.449,P=0.000),差异均有统计学意义。Beclin-1表达随着RA浓度的升高而降低 (图5A、5C)。
3 讨论
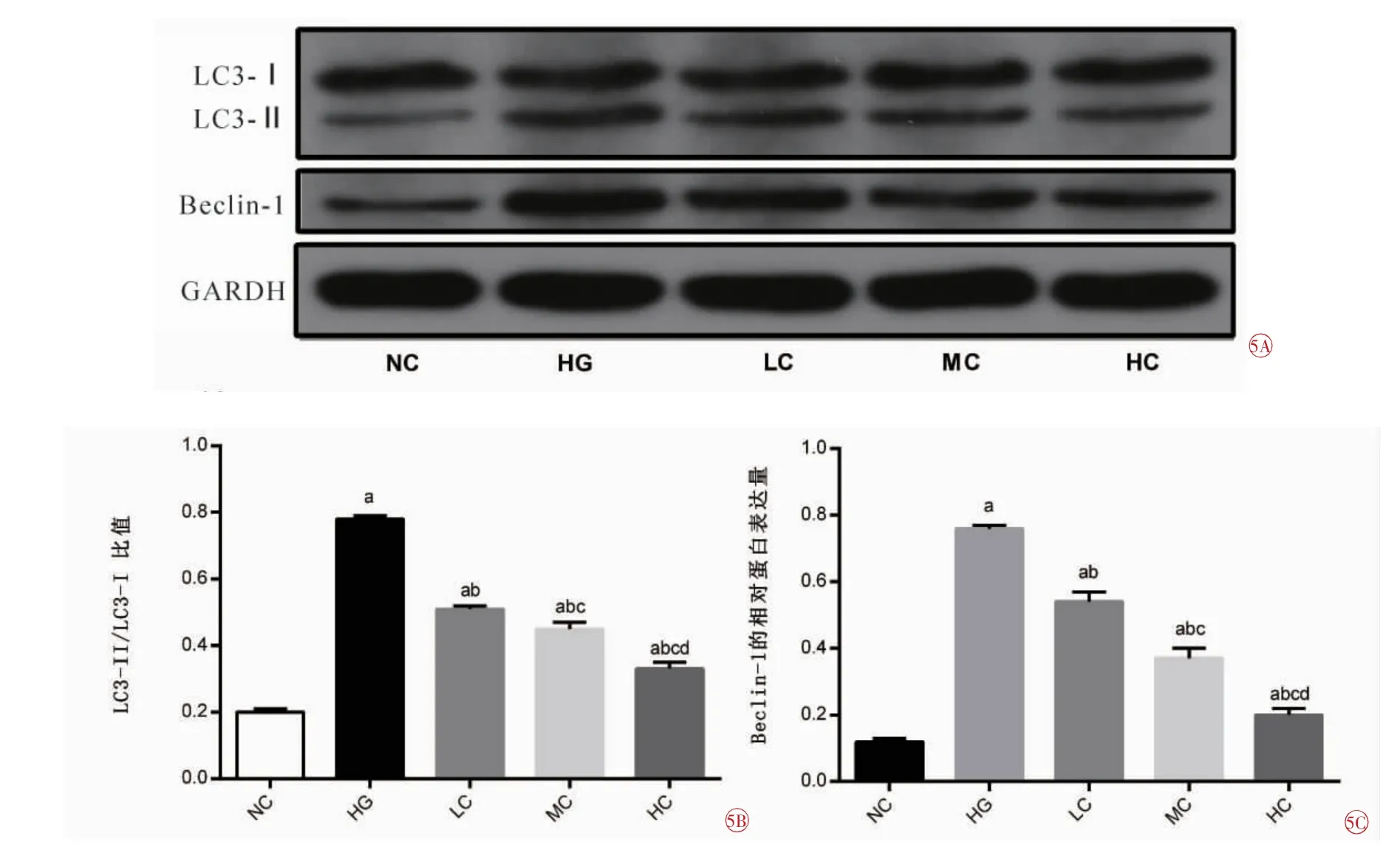
图5 Western blot法检测各组HRMEC LC3、Beclin-1表达的比较。5A各组细胞LC3、Beclin-1的表达水平;5B各组细胞LC3-II/LC3-I比值表达的比较;5C各组细胞Beclin-1表达的比较。NC正常对照组;HG高糖组;LC低浓度RA组;MC中浓度RA组;HC高浓度RA组
DR是由糖尿病引起的特征性病变,具有较高的发病率和致盲率。据相关报道,糖尿病病程超过10年的患者出现DR的几率约为60%,病程超过15年出现DR的几率约为75%~80%。DR是全球范围内青壮年劳动力人群致盲的首要原因,也是我国主要的致盲眼病之一[11-12]。DR的病理生理特点为视网膜毛细血管扩张、血管通透性增强、内皮细胞基底膜增厚、周细胞丧失、毛细血管闭塞,导致视网膜缺血、缺氧,刺激促血管内皮生长因子 (vascular endothelial growth factor,VEGF)的形成与释放,从而产生新生血管。病理性新生血管,是由于内皮结构不稳定,引起血管渗漏,导致或加重视网膜出血、水肿,甚至引起玻璃体积血,积血长期不吸收,在玻璃体腔或视网膜表面形成机化膜,牵拉视网膜,最终导致视网膜神经元和神经胶质细胞的解剖和功能改变,严重危害视功能[13-14]。目前,临床用于治疗DR的方法主要有药物、激光、玻璃体手术等,其中药物和激光治疗适用范围较广,安全性较高[15]。然而,尽管近年来对于DR的治疗已经取得了重大进展,但由于DR的病理机制复杂,这些治疗方法并非对所有患者奏效。因此,仍迫切需要对DR的发生机制进行更全面的研究和开发新的治疗策略。
在PDR的发生发展中,RNV被认为是最重要的环节之一。VEGF作为一种关键的调节因子在DR发病机制中的作用已得到公认,对于PDR和威胁视力的糖尿病黄斑水肿,大量强有力的证据支持使用玻璃体腔注射抗VEGF药物进行治疗[16-17]。然而,玻璃体腔注射抗VEGF药物存在促进PDR患眼视网膜纤维化的风险[18]。RA是一些中草药的主要活性成分,在迷迭香、鼠尾草和紫苏等植物中广泛分布。在大力发展民族医药研究的今天,RA以其抗炎、抗氧化、抗肿瘤等多方面的药理作用得到了国内外学者的广泛关注,其各种药理学活性在体内相互关联,共同发挥治疗疾病的作用[19-21]。本研究发现,RA能明显抑制高糖条件下的视网膜血管内皮细胞增殖、迁移和管腔形成过程,且抑制作用随着药物浓度的升高而增强,提示RA可能也具有治疗PDR的潜能。Kim等[22]在小鼠氧诱导的视网膜病变模型中的研究表明,RA可以显著抑制视网膜内皮细胞增殖,且呈剂量依赖性,此外RA还能有效抑制细胞管腔形成,与本研究结果一致。另外,利用HRMEC作为观察对象,也提示RA对DR等增殖性视网膜疾病具有治疗潜能。
自噬是近年来医学研究的热点,它是一种自体的自我吞噬,是细胞清除受损或多余细胞器、并能适应外界环境压力来维持生存的过程。自噬是非常重要的细胞内平衡过程,包括一系列连续的步骤,这些步骤对于降解和回收细胞质物质是必不可少的。自噬基本上是一种适应性反应,在应激状态下保证衰老和受损细胞器的生理周转,从而通过各种信号通路控制细胞命运[23]。虽然各种代谢紊乱与DR的发病有关,但由于这种多因素疾病的复杂性,任何因素与DR之间的联系都是可疑的。大量研究[10,24-26]已证实,高糖会上调自噬水平,自噬功能障碍与DR及其RNV的发病机制密切相关。电镜是观察、检验自噬现象的“金标准”,可以观察到自噬泡的形态特征,但由于应用透射电镜观察自噬泡形态对实验设备和实验者的技能与辨别能力要求较高,而且无法直接观察活细胞,所以还需与其他检测方法互相补充,对自噬现象的发生与改变进行总体评价[27]。因此,本研究利用电镜观察自噬泡和Western blot检测自噬关键蛋白两种方法对细胞的自噬水平进行了研究。哺乳动物LC3是最常用的自噬分子标记物,具有两种亚型,LC3-Ⅰ位于胞质内,LC3-Ⅱ位于自噬体膜。当自噬激活时,LC3-Ⅰ与磷脂酰乙醇胺偶联生成LC3-Ⅱ,可通过Western blot法检测LC3-II/LC3-I的表达水平,以反映自噬体的数量[28]。Beclin-1是一种其他自噬蛋白基因参与自噬形成过程的必须成分,也常被用作自噬标记分子[28]。与既往研究相符,本研究也发现高糖可以上调视网膜血管内皮细胞自噬,表现为自噬泡的增多和自噬标记蛋白LC3及Beclin-1的蛋白表达增强。同时,各浓度RA联合高糖处理的细胞表现出自噬下调,即与高糖组对比,其细胞内自噬泡减少、LC3及Beclin-1的蛋白表达减弱。以上研究结果提示,自噬信号通路在DR的RNV形成中扮演重要角色,RA通过抑制该信号通路抑制RNV的形成。
RA广泛的药理作用使其具有巨大的医用前景,但RA的部分药理效应仍未完全阐明,有待后期进一步的探索。本研究提示抑制自噬信号通路可能是RA抑制高糖条件下视网膜血管形成的机制之一。然而,体外研究结果不能完全代表疾病的真实情况,RA是否能对DR和RNV发挥治疗作用,还需要利用动物疾病模型甚至患者进行深入研究。
