基于生物信息学分析结直肠癌STIM1高频突变介导的免疫抵抗模式及其分子机制
2020-11-17袁浩钟华戈严林海唐卫中
袁浩 钟华戈 严林海 唐卫中
作者单位:530021 南宁 广西医科大学附属肿瘤医院结直肠外科
免疫治疗是结直肠癌(colorectal cancer,CRC)的治疗方案之一[1]。结直肠癌的共识分子亚型(CMS)基于肿瘤属性对患者进行了分类,其中CMS1(免疫型)亚型中大多数患者具有强烈的免疫细胞浸润,且该部分人群对免疫治疗敏感[2]。但CMS显示仅有14%的人群属于免疫型[2],而这一比例在中国人群中可能更低。而且与传统的癌症治疗方法一样,许多最初基于免疫治疗效果良好的患者最终会耐药和复发。因此,免疫抵抗成为CRC免疫治疗中面临的难题。有研究发现肿瘤组织T细胞浸润增加是免疫抵抗的重要影响因素之一[3]。肿瘤微环境中调节性T细胞浸润的预后价值和免疫抑制效能也已被广泛认可[4-6]。因此,如何解决CRC高T细胞浸润导致的免疫抵抗成为免疫治疗的重大挑战。STIM1蛋白是一个Ca2+传感器,可感应内质网中的Ca2+负载并控制其储存损耗。STIM1促进Orai蛋白管控Ca2+流入钙离子储存库(SCOE)已被报道与免疫细胞激活、成熟和运动有关[7-8]。STIM1过表达也与非小细胞肺癌、乳腺癌、结直肠癌和前列腺癌进展及较差的预后相关[9-12]。以上研究提示STIM1可能参与免疫抵抗而导致肿瘤进展[13],但此机制在CRC中未见报道。本研究旨在通过免疫浸润和单细胞测序探讨STIM1促进免疫抵抗的机制及其作为治疗靶点和生物学标志物的潜力。
1 材料与方法
1.1 临床样本
收集2019年1月至2020年1月广西医科大学附属肿瘤医院收治的36例经病理学检查确诊的CRC患者组织和血液样本。使用Solarbio公司提取试剂盒提取基因组DNA,保存至-80℃冰箱备用。本研究经医院伦理委员批准,患者知情同意。
1.2 NGS突变检测
采用illumina二代测序平台检测。将400 ng组织DNA、引物、接头(adapter)和标签(barcode)、酶和缓冲液配成50 μL PCR体系后进行PCR完成建库,对产物进行纯化、定量(每个文库600 ng,按比例混合文库)后通过杂交捕获的方法结合目标区域探针,杂交好的文库进行纯化、定量(每个pool为4 nm),按照样本需求的数据量上机测序(Nextseq 550),对样本的中靶率、均一性、测序深度等参数进行质控判断,满足测序需求的样本用Variant Caller进行突变分析,并与Cosmic等数据库数据进行比对,然后用IGV对结果进行二次查阅。以突变丰度>5%作为STIM1基因检测的丰度截断值[14-17]。
1.3 GSEA数据库分析免疫特征
GSEA 数据库(https://www.gsea-msigdb.org/gsea/index.jsp)通过基因集探索分子机制。利用Explore the Molecular Signatures Database(MSigDB)中的 Search Gene Sets键输入关键词“STIM1”,选定人属、免疫特征和所有数据来源进行搜索。找到与研究基因最相关的两个集合,然后进行分子事件描述,并使用GraphPad Prism绘图。
1.4 TIMER数据库分析免疫浸润
利用 TIMER 数据库(https://cistro.shinyapps.io/timer/)分析CRC的免疫浸润。使用Diff Exp模块分析STIM1在癌组织及其邻近正常组织中的表达差异;Correlation模块分析STIM1与RELA、JUN的相关性;SCNA模块分析STIM1拷贝数变异(CNVs)与免疫浸润水平的关系;Gene模块分析STIM1与免疫细胞的相关性;Survival模块分析免疫细胞(B细胞、CD4+T细胞、CD8+T细胞、巨噬细胞、中性粒细胞和树突状细胞)与CRC生存的相关性(Kaplan-Meier分析)。
1.5 CancerSEA数据库分析基因功能
CancerSEA 数 据 库(http://biocc.hrbmu.edu.cn/CancerSEA/)是一个旨在单细胞水平上全面探索癌细胞的不同功能状态的多功能网站,涉及14个细胞功能状态。利用Serach页面搜索STIM1、RELA和JUN,选择肿瘤类型“CRC”,分析CRC中STIM1、RELA和JUN的功能,并对CRC单细胞数据集的详细信息进行挖掘。
1.6 蛋白质相互作用网络(PPI)的构建
使用Cytoscape中的Universal Interaction Database Client键入关键词“STIM1”,选中所有数据来源进行基因关联分析。获得STIM1相关的PPI网络,其结果经筛选得出人属相关基因。该簇基因使用Cytoscape内置插件Reactome F1进行功能聚类分析,经筛选获得免疫相关分类的基因并集。然后采用STRING数据库(http://string-db.org/)将筛选的基因集进行PPI网络构建。
2 结果
2.1 NGS突变频谱描述
基于基因突变频谱分析结果显示,CRC患者特异性最高基因为11号染色体上的STIM1,突变频率为97.2%(35/36)。其中35例STIM1突变患者中introns碱基置换均突变(突变类型为c.1138-52A>C),3′UTR碱基置换突变33例(突变类型为c.*367G>A)。在GSEA数据库中检索与STIM1相关的免疫基因集,结果显示,基因集GSE360_L_DONOVANI_VS_L_MAJOR_MAC_UP 与目的基因重合的 STIM1、ABCB1、MSH2、YES1、CTNNB1突变占比分别为 97.22%、83.33%、8.33%、2.78%、0(图 1A),基因集 GSE360_CTRL_VS_L_DONOVANI_MAC_UP与目的基因重合的STIM1、CDA、ESR1、GSTP1、ZFHX3、GNA11 突变占比分别为97.22%、72.22%、44.44%、30.56、2.78%、0(图 1B)。
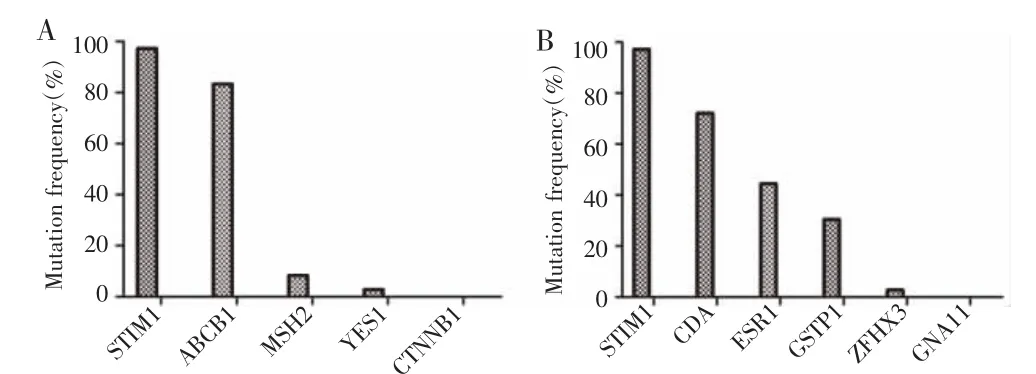
图1 GSEA基因集中重合基因的突变频率Fig.1 Mutation frequency of overlapping genes in GSEA gene set
2.2 STIM1与免疫浸润的相关性
基于TIMER数据库分析STIM1与免疫浸润程度的相关性,分别测定B细胞、CD8+T细胞、CD4+T细胞、巨噬细胞、中性粒细胞和树突状细胞的浸润水平,结果显示,STIM1 mRNA在结肠癌患者中的表达与CD4+T 细胞(r=0.554,P<0.001)、巨噬细胞(r=0.417,P<0.001)、树突状细胞(r=0.360,P<0.001)、中性粒细胞(r=0.282,P<0.001)和 B 细胞(r=0.180,P<0.001)的浸润水平相关(图2A)。Kaplan-Meier分析结果显示,CD4+T细胞和巨噬细胞浸润水平越高,患者预后越差,但差异无统计学意义(P>0.05)(图2B)。
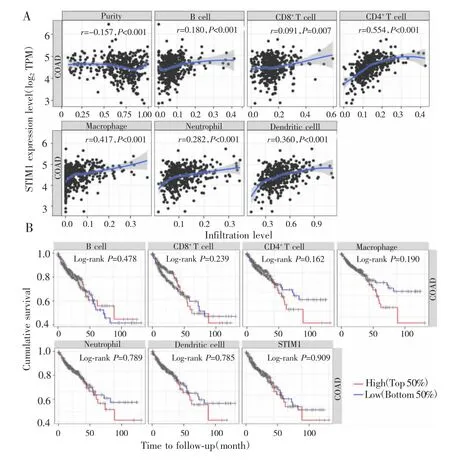
图2 STIM1与免疫浸润及预后的相关性Fig.2 Correlation of STIM1 with immune infiltration and prognosis
2.3 基于单细胞RNA测序技术的CRC中STIM1、RELA和JUN分析
EXP0051是一个结直肠癌单细胞数据集,包含CancerSEA中的290个细胞,分析STIM1在EXP0051中的功能,结果显示,干细胞特性、转移、分化和侵袭与 STIM1 高度相关(r=-0.76,-0.61,0.57,-0.66;均P<0.05)(图 3A)。
将RELA和JUN纳入EXP0051单细胞数据集中分析。在CRC单细胞中,相关分析显示RELA功能与缺氧(r=0.32,P<0.05)和炎症(r=0.30,P<0.05)有关;JUN功能与静止(r=0.42,P<0.05)、炎症(r=0.41,P<0.05)、缺氧(r=0.39,P<0.05)和分化(r=0.31,P<0.05)有关(图3B~C)。
2.4 STIM1与RELA、JUN相互作用在免疫通路中发挥作用
为进一步探索STIM1在CRC中的调控机制,对STIM1进行基因关联性分析,在Cytoscape中得到与STIM1相关的85个人属基因。通过Reactome数据库对STIM1相关的85个人属基因进行功能聚类分析,结果显示STIM1与免疫系统高度相关(适应性免疫系统、固有免疫系统、免疫系统中的细胞因子信号转导和免疫反应蛋白类泛素化修饰)。对4种免疫功能分类取并集后利用STRING数据库构建PPI网络,结果显示RELA、JUN与STIM1相关(图4A),RELA、JUN与 CD4+T 细胞均呈正相关(r=0.565,0.319;均 P<0.05)(图4B)。
基于TIMER数据库对STIM1、RELA和JUN进行相关性分析,结果显示,RELA、JUN均与STIM1呈正相关(r=0.579,0.223;均 P<0.05),RELA 与 JUN 亦呈正相关(r=0.286,P<0.05)(图4C)。以上结果提示,STIM1可通过RELA和JUN在免疫系统尤其在炎症中发挥作用。
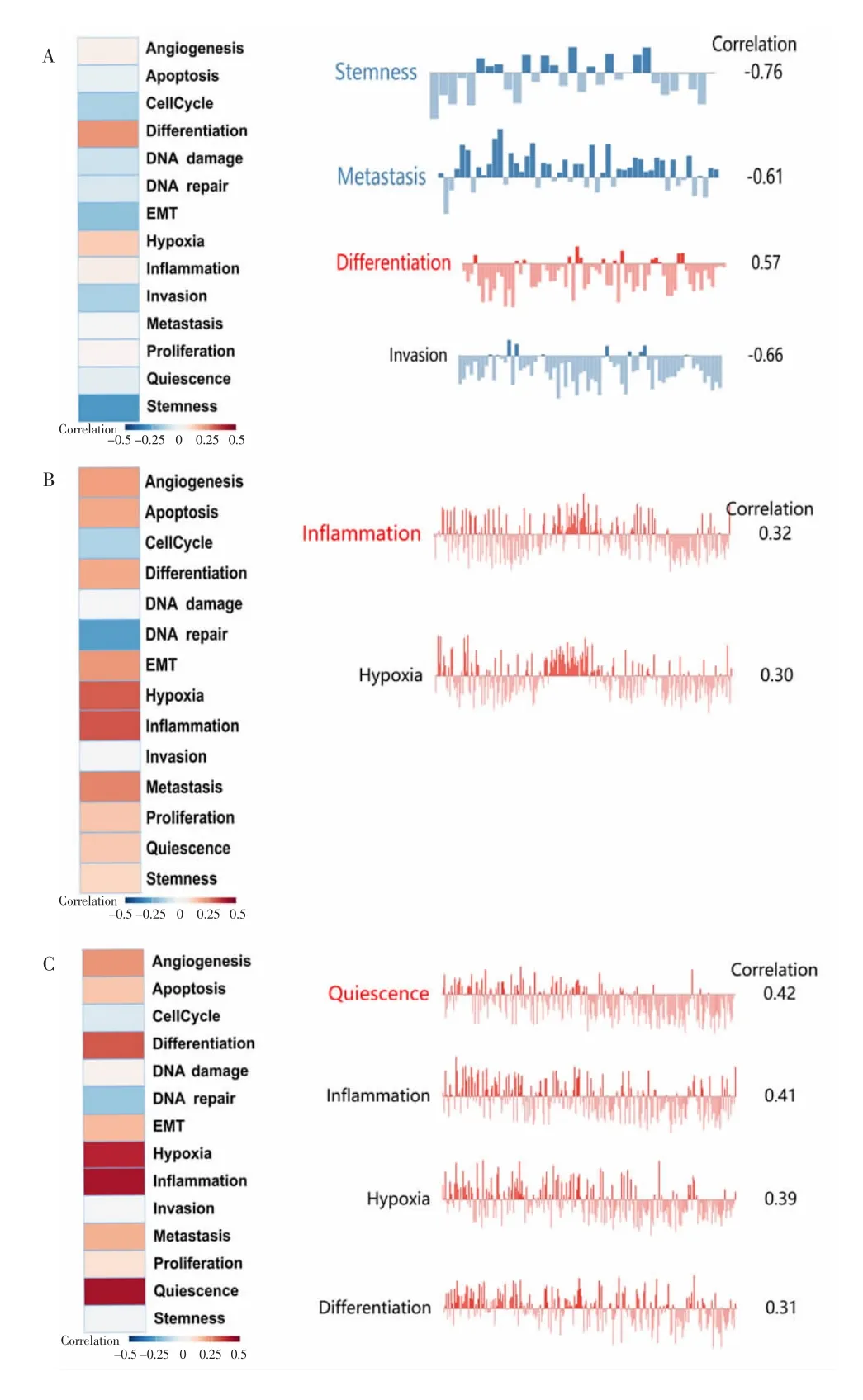
图3 CRC中STIM1、RELA、JUN与功能状态之间的相关性Fig.3 Correlation between STIM1,RELA,JUN and functional states in CRC
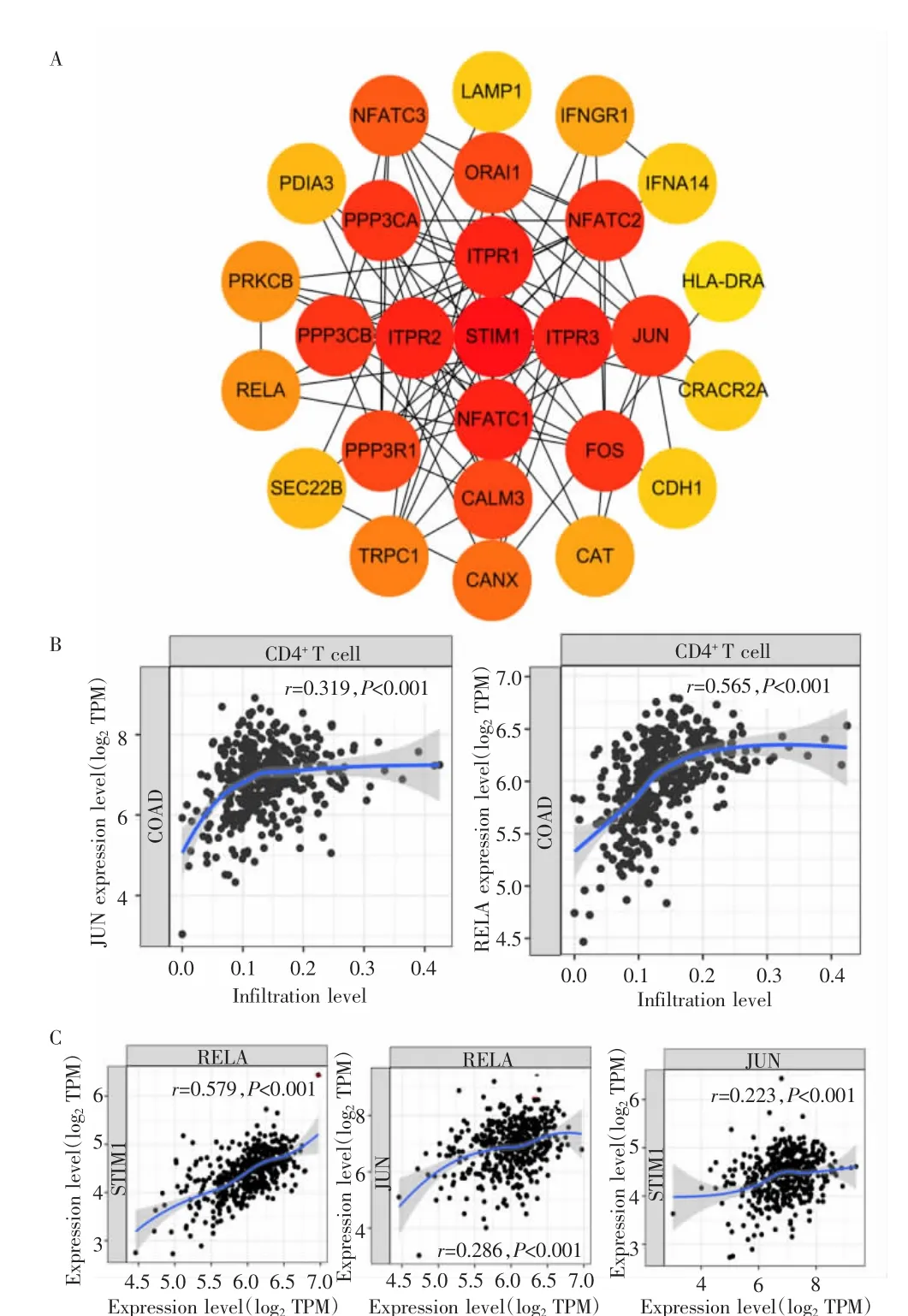
图4 STIM1与RELA、JUN的相关性Fig.4 Correlation between STIM1 and RELA,and JUN
3 讨论
手术、放疗、化疗及分子靶向治疗是CRC主要的治疗手段。作为一种免疫源性肿瘤,CRC的免疫治疗亦逐渐引起关注。但是免疫治疗并不是所有肿瘤、所有患者均适用,如何富集有效人群是面临的难题,免疫抵抗也成为研究热点之一。为探讨CRC基因突变频谱及其介导的CRC免疫抵抗,本研究首先采用NGS技术检测CRC患者组织和血液样本中的基因突变情况,经筛选发现STIM1为高频突变基因,进一步在GSEA数据库中检索与STIM1相关的免疫基因集也发现与目的基因重合的STIM1突变频率较高,说明STIM1可能在免疫通路中占据更多关键节点,在免疫系统中起重要作用。
有研究发现STIM1可通过SOCE介导Ca2+进入免疫受体细胞(包括T细胞、B细胞和肥大细胞),而Ca2+进入内质网是免疫细胞激活的关键因素[16-17]。为探讨STIM1与免疫浸润程度的相关性,本研究基于TIMER数据库进行分析,结果发现STIM1与结肠癌中的B细胞、CD4+T细胞、树突状细胞、中性粒细胞和巨噬细胞浸润水平均呈正相关,且CD4+T细胞和巨噬细胞浸润水平越高,提示患者预后越差,说明STIM1可能具有促进CRC免疫抵抗的作用。癌症的免疫反应较为复杂,一般从巨噬细胞获得肿瘤细胞抗原,然后树突状细胞将该抗原呈递至CD8+T细胞,CD8+T细胞进一步激活CD4+T细胞并产生记忆细胞,被激活的CD4+T细胞最后完成对肿瘤细胞的杀伤。而这一系列过程中任何一处微小错误都将导致肿瘤细胞的免疫抵抗。肿瘤细胞分泌趋化因子等细胞因子吸引免疫细胞在肿瘤及微环境浸润,但浸润的免疫细胞未能对肿瘤细胞造成有效杀伤,主要原因在于肿瘤的低免疫原性、肿瘤抗原封闭、肿瘤细胞低表达MHC分子和缺乏共刺激分子,甚至包括肿瘤微环境的细胞外基质发生结构和功能变化等,以上因素均可导致免疫呈递和CD4+T细胞识别过程受阻。因此,STIM1与CD4+T细胞浸润具有相关性,可能是由于STIM1控制CD4+T细胞的Ca2+流入内质网,使CD4+T细胞兴奋性和运动能力增强,从而导致更多的CD4+T细胞浸润。
也有研究报道与STIM1相关的RELA和JUN可产生炎症和免疫抑制基质从而促进癌症进展[18-19]。本研究基于EXP0051单细胞数据集分析发现RELA与JUN主要通过缺氧、炎症、分化和静止相关途径发挥作用,STIM1、RELA和JUN之间的相关性以及三者与CD4+T细胞免疫浸润的显著相关表明STIM1可能通过RELA、JUN和CD4+T细胞影响CRC预后。RELA、JUN与STIM1启动子存在时间依赖性,其共表达有助于STIM1表达[18-19]。同时,RELA和JUN也可以进一步诱导炎症发生,致使更多的CD4+T细胞向肿瘤汇集。当CD4+T细胞浸润于肿瘤及其微环境但并未杀伤肿瘤细胞时,CD4+T细胞介导的炎症反应和分泌的某些细胞因子将有助于肿瘤进展。调节性T细胞是CD4+T细胞一种亚型,该亚型亦可通过抑制抗肿瘤免疫细胞功能促进癌症进展。而RELA、JUN和STIM1也可能促进CD4+T细胞该亚型的表达,从而显示为总CD4+T细胞浸润水平升高,而升高的调节性T细胞可抑制其他免疫细胞活性从而达到免疫抵抗的目的。
综上所述,STIM1可促进CRC免疫抵抗,STIM1、RELA和JUN两两显著相关,且与CD4+T细胞高度相关,而高CD4+T细胞浸润水平与较差预后有关,STIM1与JUN、RELA共同参与的调控网络可能是CRC免疫抵抗发生的机制。STIM1可能作为CRC免疫抵抗中的治疗靶点和预后生物标志物,STIM1与免疫细胞浸润联合有望更精确地评估预后。
