不畏浮云遮望眼,只缘身在此山中——化学反应速率的深度分析
2020-11-17湖南周学兴易富饶
湖南 周学兴 易富饶
一、问题的提出
化学反应原理是高中化学中的重要模块,难度相对较大。研究近几年全国卷的高考题可知,化学反应原理题是必考题型之一,以石油化工业等领域关于气体的研究取得的成果为背景,重点考查盖斯定律的应用,化学反应速率与化学平衡和平衡常数等计算及其影响因素,涉及方面广,综合性强,同时结合电化学、电解质溶液等内容进行考查。纵观2015—2019全国卷在化学反应原理题中的考点内容分布,见表1、表2。

表1 2017—2019年全国卷化学反应原理题考点及知识点汇总

表2 2015—2016年全国卷化学反应原理题考点及知识点汇总
通过表格对比分析,全国Ⅰ卷试题的呈现形式与考查角度较为新颖,Ⅱ卷、Ⅲ卷略显稳重。其中化学反应速率的考查均属于高频考点。而高中阶段学生对什么是平均化学反应速率与瞬时化学反应速率、瞬时化学反应净速率等易混淆物理量的掌握情况不容乐观,以及在c-t曲线、p-t曲线或表格中能否通过斜率或平均反应速率来判断温度或压强等的大小关系存在迷思。下面笔者将从定量计算与定性分析的角度对化学反应速率进行全方位阐述。
1 定量看速率

(1)Shibata曾做过下列实验:
①使纯H2缓慢地通过处于721℃下的过量氧化钴CoO(s),氧化钴部分被还原为金属钴(Co),平衡后气体中H2的物质的量分数为0.025 0。
②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.019 2。根据上述实验结果判断,还原CoO(s)为Co(s)的倾向是CO________(填“大于”或“小于”)H2。
(2)721℃时,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应,则平衡时体系中H2的物质的量分数为________(填标号)。
A.<0.25 B.0.25 C.0.25~0.50
D.0.50 E.>0.50
(4)Shoichi研究了467℃、489℃时水煤气变换中CO和H2分压随时间变化关系(如图所示),催化剂为氧化铁,实验初始时体系中的pH2O和pCO相等、pCO2和pH2相等。

(4)问通过p-t图像的斜率或者30~90 min的平均反应速率来反馈温度的高低,明显是不明智的,因为本题还有压强是变量,在双重变量下,不能直接用斜率分析。那么在图像中我们应该如何分析速率问题呢,且看近年来高考题中是如何考查这些问题的。
1.1 厘清计算公式

1.2 平均化学反应速率——“净”平均反应速率
某个时间段内的物质的物质的量浓度变化情况为平均化学反应速率,高一阶段的同学往往先接触此类计算。对于可逆反应而言,存在正逆反应速率,当一个化学反应正在正向进行时,反应物同时存在消耗和生成,那么平均化学反应速率,实际上是“净”平均反应速率。


(1)比较第2 min反应温度T(2)与第8 min反应温度T(8)的高低:T(2)________(填“<”“>”或“=”)T(8)。
(2)比较产物CO在2~3 min、5~6 min和12~13 min时平均反应速率[平均反应速率分别以v(2~3)、v(5~6)、v(12~13)表示]的大小____________。
(3)比较反应物COCl2在5~6 min和15~16 min时平均反应速率的大小:v(5~6)________(填“<”“>”或“=”)v(15~16),原因是________________________________________________。
【答案】(1)<
(2)v(5~6)>v(2~3)=v(12~13)
(3)> 在相同温度时,该反应的反应物浓度越高,反应速率越大
由此题可知,可逆反应达到化学平衡时,各物质的浓度等不再改变,平均化学反应速率根据公式计算自然为0。同时表明,c-t图,需要从单位时间内浓度变化情况比较分析出外界因素的改变情况。
1.3 净“瞬时”化学反应速率
可逆反应中,c-t曲线或是p-t曲线中的浓度、压强变化,均为“净”变化,即“消耗与生成同时存在下的净变化情况”。那么当问及图像中某点的速率时,实指净“瞬时”化学反应速率,即净瞬时速率=v正-v逆。
【例2】(2019·全国卷Ⅱ·27节选)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是________(填标号)。
A.T1>T2
B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率
D.b点时二聚体的浓度为0.45 mol·L-1

【答案】CD
例2中的B项中a、c点反应速率实指瞬时净反应速率=v正-v逆,由于a、c点具有不同温度、不同浓度的双重变量情况,无法做出判断。我们直接看两点的斜率即可。a点的斜率>c点的斜率,即反应速率va>vc。某点的反应速率,指的是瞬时净反应速率=v正-v逆=斜率。
1.4 比较v正、v逆的大小
比较v正、v逆的大小很少涉及定量计算,往往可能存在以下两种比较方式:
1.不同点的v正、v逆:比较外界因素,不应看斜率。
2.同(某)点的v正、v逆:移动方向或进行方向,Qc与K比较。


②tm时,v正________(填“大于”“小于”或“等于”)v逆。
③tm时v逆________(填“大于”“小于”或“等于”)tn时v逆,理由是________________________________________________。
【答案】大于 小于tm时生成物浓度较低
1.5 速率常数与平衡常数的关系
【例4】(2015·全国卷Ⅰ·28节选)碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
Bodensteins研究了下列反应:
在716 K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
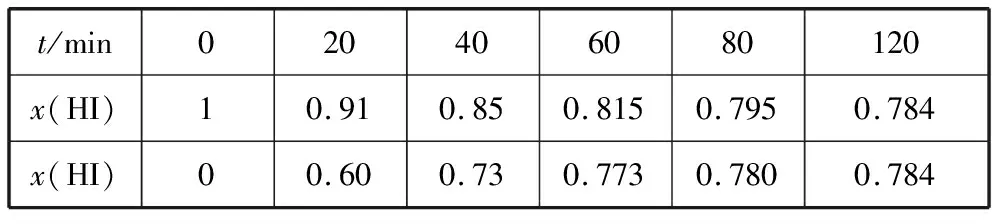
t/min020406080120x(HI)10.910.850.8150.7950.784x(HI)00.600.730.7730.7800.784
(2)上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为________(以K和k正表示)。若k正=0.002 7 min-1,在t=40 min时,v正=________min-1。


2 定性看速率
v正与v逆的大小需要从外界因素的改变情况中进行定性比较,明确外界因素与速率的关系。
2.1 温度与速率的关系
【例5】(2018·全国卷Ⅱ·27节选)CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:

积碳反应CH4(g) C(s)+2H2(g)消碳反应CO2(g)+C(s) 2CO(g)ΔH/(kJ·mol-1)75172活化能/(kJ·mol-1)催化剂X3391催化剂Y4372
①由上表判断,催化剂X________(填“优于”或“劣于”)Y,理由是________________________________________________。
在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图所示。升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是________(填标号)。
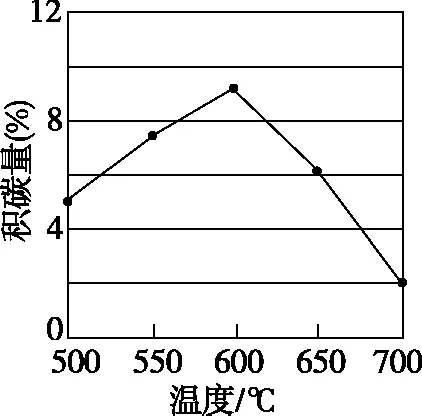
A.K积、K消均增加
B.v积减小,v消增加
C.K积减小,K消增加
D.v消增加的倍数比v积增加的倍数大
【答案】(2)①劣于 相对于催化剂X,催化剂Y积碳反应的活化能大,积碳反应的速率小;而消碳反应活化能相对小,消碳反应速率大 AD
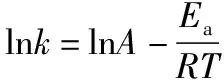

由能量变化图可知,在一个吸热反应中,v吸>v放,Ea(吸热)>Ea(放热),Ea越大,受温度影响变化程度越大。
2.2 浓度(压强)与速率的关系
结合速率方程[v正=k正ca(A)·cb(B)、v逆=k逆cc(G)·cd(H);v正=k正pa(A)·pb(B)、v逆=k逆pc(G)·pd(H)]可知,①浓度(压强)与化学反应速率成正比;②若浓度的幂等于0(并非每个反应都是基元反应,故浓度的幂不一定是方程式的系数,但是高中还是喜欢考查是系数的),则该反应是一个“匀速反应”,即化学反应速率(瞬时)与浓度无关。
【例6】(2014·全国卷Ⅰ·9)已知分解1 mol H2O2放出热量98 kJ。在含少量I-的溶液中,H2O2分解的机理为


下列有关该反应的说法正确的是
( )
A.反应速率与I-的浓度有关
B.IO-也是该反应的催化剂
C.反应活化能等于98 kJ·mol-1
D.v(H2O2)=v(H2O)=v(O2)
【答案】A
一般化学反应速率取决于慢反应的速率,故A项正确。IO-的浓度对反应速率几乎不产生影响。故题干给予某反应的速率方程时,方程中的物质的浓度往往出现在慢反应中。
2.3 催化剂与速率的关系

3 原创试题
对CO2的综合利用意义深远,可有效减缓温室效应。
(1)由合成气(组成为H2、CO和少量的CO2)直接制备甲醇,主要过程涉及以下反应:



则ΔH3=________kJ·mol-1;已知反应ⅱ的ΔS=-0.18 kJ·mol-1·K-1,则________(“高温”或“低温”)有利于反应ⅱ自发进行。
(2)恒压条件下,发生反应ⅱ,该反应的速率方程为v正=k正x(CO2)·x3(H2),v逆=k逆x(CH3OH)·x(H2O),k正、k逆为速率常数且只与温度有关,x为物质的量分数(也称摩尔分数)。
①摩尔分数平衡常数Kx=________(以k正、k逆表示)(摩尔分数平衡常数即用摩尔分数代替物质的量浓度的平衡常数)。
②达到平衡时,升高温度,k正、k逆均增大,增大倍数较大的是________,由此请用文字描述当温度改变时,正、逆反应活化能(Ea)与k正、k逆变化的关系________。
③我国科学家使用Pd-Cu双金属合金作催化剂,研究反应ⅱ。利用计算机模拟,反应历程如图所示(*表示被催化剂吸附的物种),TS1表示过渡态1。

通过降低步骤________(填步骤编号)的能垒(活化能),进一步提高该反应的反应速率。
(3)利用焦炭与水蒸气在恒容密闭容器中反应制合成气的主要反应的lgKp(Kp是以分压表示的平衡常数)与温度的关系如图所示。


②等物质的量的CO和H2O发生反应ⅲ,b点时,CO的转化率=________。北京大学马丁教授等研究了在Au/a-MoC催化作用下,反应相同时间,温度与CO转化率的关系,如图所示。
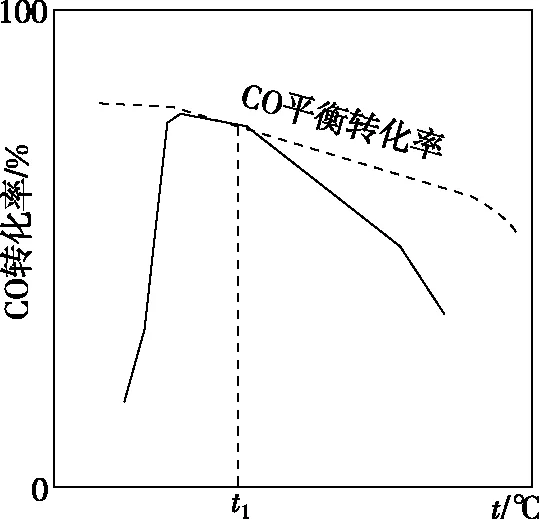
分析温度升高至t1后,CO转化率降低的原因是________________________________________________。
【答案】(1)-41.1 低温

(3)①1 ②0.50或50% 温度升高,催化剂活性降低(失活)
化学反应原理题在命制原创试题过程中要注重以下几个方面:一是要体现前沿性,让学生感悟学科前沿发展方向,通过试题激发学生学习化学的兴趣;二是要体现挑战性,让学生在具有高度挑战性的学习任务中整合知识、提升能力;三是要体现趣味性,让学生在完成学术情境问题中感悟化学之趣、化学之美。试题通过不断进阶情境素材的陌生度来考查有关热力学、动力学等问题。试题在关注理解与辨析、分析与推测能力的同时,还要考查学生归纳与论证、探究与创新的能力。在必备知识上,试题遵循研究的一般思路,从热力学盖斯定律计算、速率常数与平衡常数的关系、平衡常数的计算、动力学反应机理及反应历程等角度进行设问,素材呈现形式有平衡常数与温度图像、催化性能与温度图像、动力学反应历程与活化能关系图,学生需要在内容及思维创新的学术情境中创新性运用知识,提升归纳与论证、探究与创新等关键能力。

