2020年高考全国卷Ⅲ化学试卷的特点分析与命题导向
2020-11-17云南沈艳华
云南 沈艳华
2014年,《国务院关于深化考试招生制度改革的实施意见》对高考内容提出了新的改革要求;2017年,教育部颁布《2017版普通高中课程标准》,将基础教育提高到了“学科核心素养”层次,这样的调整势必引发《普通高等学校招生全国统一考试大纲》的大规模修订;2019年11月,教育部考试中心发布《中国高考评价体系》和《中国高考评价体系说明》,明确指出高考“一核四层四翼”的考查关系:“一核”即高考评价体系,它通过确立“立德树人、服务选才、引导教学”四个核心立场,回答了“为什么考”的问题;通过“学科素养、核心价值、必备知识、关键能力”四层考查目标,明确了高考“考什么”的问题;通过“基础性、综合性、应用性、创新性”四翼考查要求,明确了“怎么考”的问题。大政方针下的高考试卷究竟以什么样的姿态面世?它对我们的教学又有什么样的引导和启示?下面以2020年高考化学全国卷Ⅲ的试题分析,来窥视高考命题导向。
一、2020年高考全国卷Ⅲ化学试卷的特点分析与命题导向
1.以“必备知识”为内容,体现高考的“基础性”
“化学”又称“变化之学”,元素性质及方程式的书写自然是高考命题考核的重中之重。全卷12道题,除第9题外共11道题涉及元素的化学性质与反应。可以说试题以元素性质和化学反应为主线,完整串联全卷,真正体现了化学学科的变化观念与平衡思想:
第26题以含氯消毒剂为背景,考查浓盐酸的挥发性、MnO2的氧化性、Cl2与水的可逆反应、Cl2与NaOH、KOH溶液反应因温度不同可能导致产物不同的影响、Cl2与Na2S的氧化还原反应、Cl2与Ca(OH)2溶液的反应;第27题以含镍催化剂制备硫酸镍为背景,涉及油脂的碱性水解,金属铝及其氧化物与强碱溶液的反应,NaAlO2、铁及其氧化物与稀硫酸的反应、H2O2与Fe2+的氧化还原反应,镍镉电池总反应;第28题以二氧化碳的综合利用为背景,涉及二氧化碳催化加氢合成乙烯的信息方程式书写。
元素及其化合物的性质与反应是化学学科最经典的基础知识。全卷以变化观、守恒观立足,共涉及42种元素及其化合物或官能团的性质考查。此外,试卷以仪器识别、加热方式的选择、尾气处理、分离提纯、萃取为考查角度,落实基本仪器、基础实验操作的实践考核;以基础官能团的性质、微粒物质的量的计算、喷泉实验的原理、离子方程式书写、电化学原理及电极反应、物质结构推断与非金属性强弱比较、原子半径大小比较、氧化性强弱比较、温度与压强对平衡的影响、平衡常数计算、催化剂的性质、对角线规则、化学键的分类、配位键的形成原理、杂化类型的判断、电负性大小比较、等电子体的判断、静电作用力对物质性质的影响、晶体密度的计算、有机物的命名、官能团的名称、手性碳的判断、同分异构体的书写等考查方式,完美诠释了高考化学的“基础性”。
2.以“关键能力”为内容,体现高考的“综合性”
《中国高考评价体系》基于学科素养导向,结合学生认知发展实际,确立了三个方面的关键能力群:以认识世界为核心的知识获取能力群,即识别考点的能力考查;以解决实际问题为核心的实践操作能力群;涵盖了各种关键思维能力的思维认知能力群。全国卷Ⅲ充分体现了理解与辨析能力、分析与推测能力、归纳与论证等能力的考查。例如:第8题和第36题设计了官能团的识别与性质推演,这是“宏观辨识与微观探析”素养在有机化学部分的体现,它需要考生有分类与归纳能力,并能从官能团的结构分析出一类化合物的性质,并且比较出不同反应顺序对官能团物质性质的影响。此外,有机流程的分析包括结构模型、分子式、用已知反应比对未知反应等证据信息的应用,这是“变化观念与平衡思想”“证据推理和模型认知”“科学探究与创新意识”的综合考查。再如,第11题离子方程式书写的正误判断:
对于下列实验,能正确描述其反应的离子方程式是



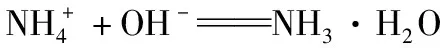
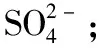
化学实验能力包含实验操作能力与实验思维能力,试卷第26题中两种能力均有体现:
氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置(部分装置省略)制备KClO3和NaClO,探究其氧化还原性质。
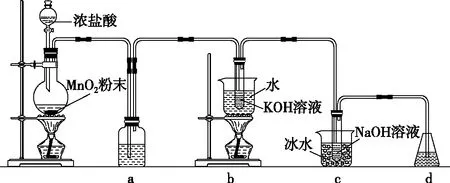
回答下列问题:
(1)盛放MnO2粉末的仪器名称是________,a中的试剂为________。
(2)b中采用的加热方式是________,c中化学反应的离子方程式是______________________________,采用冰水浴冷却的目的是________。
(3)d的作用是____________,可选用试剂________(填标号)。
A.Na2S B.NaCl C.Ca(OH)2D.H2SO4
(4)反应结束后,取出b中试管,经冷却结晶________,________,干燥,得到KClO3晶体。
(5)取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入CCl4振荡,静置后CCl4层显________色。可知该条件下KClO3的氧化能力________NaClO(填“大于”或“小于”)。
本题设置了仪器的识别、试剂的选择(a中的试剂是什么)、试剂的功能(d可选用什么试剂)、现象的观察(静置后CCl4层显什么色)均属于实验操作能力的考查;而操作的分析(b中采用的加热方式是什么)、方案的设计(反应结束后,取出b中试管,经冷却结晶,________,干燥,得到KClO3晶体)、结论的得出(该条件下KClO3与NaClO的氧化能力比较大小)则属于实验思维能力的考查。此外,试题还设置了实验操作调节能力的考查(温度的控制),充分挖掘了实验关键能力考查角度。虽然试题中所涉及的实验仪器及装置图都是高中化学很常见的,但考生需要结合题设,从自己掌握的知识模型中提取相关信息进行整合重组,才能完美作答。
3.以“学科素养”为内容,体现高考的“应用性”
《中国高考评价体系》将学科素养指标分为三块九类:
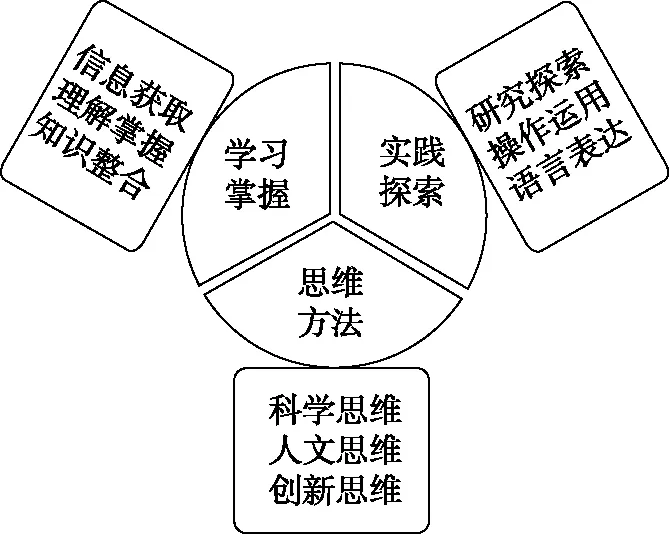
学科素养指标体系
第27题为无机综合题:
某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体(NiSO4·7H2O):
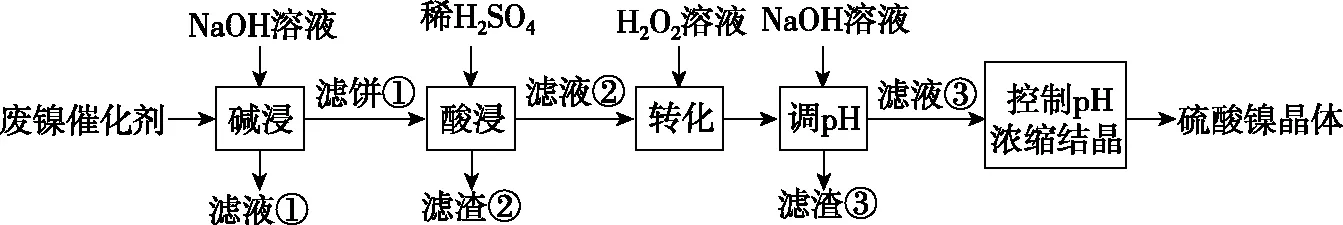
溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
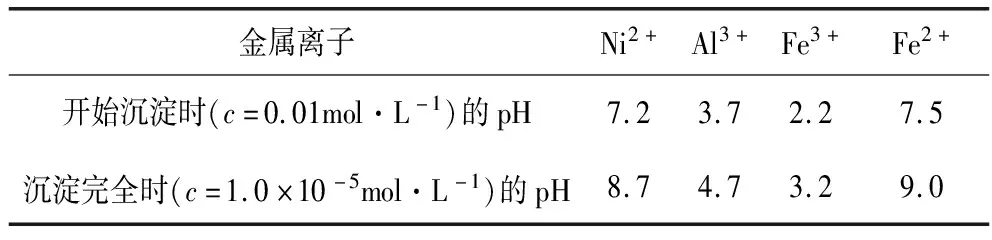
金属离子Ni2+Al3+Fe3+Fe2+开始沉淀时(c=0.01mol·L-1)的pH沉淀完全时(c=1.0×10-5mol·L-1)的pH7.28.73.74.72.23.27.59.0
回答下列问题:
(1)“碱浸”中NaOH的两个作用分别是________。为回收金属,用稀硫酸将“滤液①”调为中性,生成沉淀。写出该反应的离子方程式______________________________。
(2)“滤液②”中含有的金属离子是________。
(4)利用上述表格数据,计算Ni(OH)2的Ksp=________(列出计算式)。如果“转化”后的溶液中Ni2+浓度为1.0 mol·L-1,则“调pH”应控制的pH范围是________。
(5)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式______________________________。
(6)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是________。
试题本意是考查“Ni、Al、Fe及其氧化物,谁与氢氧化钠溶液会反应。”“Ni、Fe及其氧化物,谁与稀硫酸会反应。”“已知Ni2+浓度与OH-浓度,如何计算Ksp。”但这样的信息需要学生从流程中、表格中获取。此外,中学化学并没有学过金属镍的性质及价态,需要考生应用守恒观判断出镍元素一直处于流程主线中未损失,同时具备全局观,加入的四种试剂中只有H2O2具有强氧化性,若含镍化合物与过氧化氢反应后呈现高价态,后面没有还原剂将其还原为NiSO4·7H2O。镍元素在溶液中一直保持+2价,因此,H2O2的作用是氧化Fe2+为Fe3+,进而推知第二次加入氢氧化钠溶液的作用是沉淀Fe3+。试题第(3)问、第(6)问考查试剂的作用、流程的评价,需要考生运用开放性、创新性的思维方式,组织相关学科知识,来应对真实而复杂的问题情境。
第28题为理论综合题:
二氧化碳催化加氢合成乙烯是综合利用CO2的热点研究领域。回答下列问题:
(1)CO2催化加氢生成乙烯和水的反应中,产物的物质的量之比n(C2H4)∶n(H2O)=________。当反应达到平衡时,若增大压强,则n(C2H4)________(填“变大”“变小”或“不变”)。
(2)理论计算表明,原料初始组成n(CO2)∶n(H2)=1∶3,在体系压强为0.1 MPa,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。
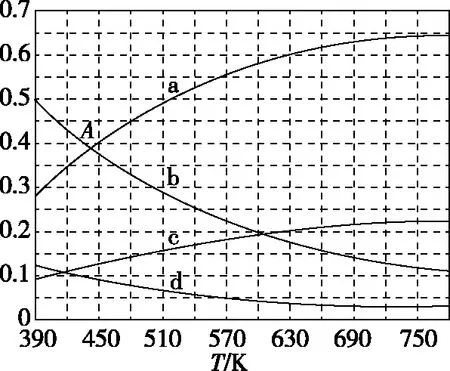
图中,表示C2H4、CO2变化的曲线分别是________、________。CO2催化加氢合成C2H4反应的ΔH________0(填“大于”或“小于”)。
(3)根据图中点A(440 K,0.39),计算该温度时反应的平衡常数Kp=________(MPa)-3(列出计算式。以分压表示,分压=总压×物质的量分数)。
(4)二氧化碳催化加氢合成乙烯反应往往伴随副反应,生成C3H6、C3H8、C4H8等低碳烃。一定温度和压强条件下,为了提高反应速率和乙烯选择性,应当________________________________________________。
试题充分考查了基于图像的数据获取能力与图像推理能力,它需要考生先根据信息写出CO2催化加氢生成乙烯和水的反应方程式,再根据方程式配平系数,进行压强对平衡的影响分析,最后得出“增压,平衡正向移动,n(C2H4)变大”的结论;并通过图像,调取所学知识“反应变化量之比等于化学计量数之比”,进行归纳、演绎,最终确定每条曲线所代表的物质;试卷第(3)问给出分压的定义,要求考生在获取新信息的同时,能够将新信息与“三段式”计算的旧知识进行整合,方可算出点A的平衡常数Kp。
第35题则是以一段台阶式的阅读材料,考查信息的阅读与整合能力,不需要对知识死记硬背,试题娓娓道来,讲述一个结构决定性质的事实,试题做完,道理自明:
(1)H、B、N中,原子半径最大的是________。根据对角线规则,B的一些化学性质与元素________的相似。

(3)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),电负性大小顺序是________。与NH3BH3原子总数相等的等电子体是________(写分子式),其熔点比NH3BH3________(填“高”或“低”),原因是在NH3BH3分子之间,存在________________________________________,也称“双氢键”。
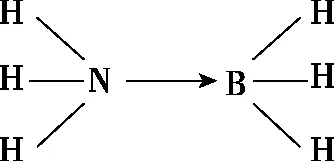
4.以“核心价值”为内容,体现高考的“政治性”与“思想性”
全国卷Ⅲ在题目背景物质的选取及题干信息的设计上,既有学科素养的挖掘,又有社会文化的浸润。例如:第7题以宋代《千里江山图》中典型绘画颜料蓝铜矿为背景,在考查学生对化学知识的掌握和应用的同时,浸润中华优秀传统文化,激发学生的爱国热情;第8题以新型局部镇痛药金丝桃苷为背景,渗透有机化学科学的重大贡献;第12题以目前储电能力最高的碱性硼化钒(VB2)—空气电池为背景,激发学生热爱科学、探索科学的强烈欲望,无声润泽考生心灵;第26题以含氯消毒剂的制备为背景,将“科学精神与社会责任”融于试卷,传播化学在生产生活中的重要作用;第27题以废弃催化剂制备硫酸镍晶体为背景、第28题以CO2的回收利用为背景,均在潜移默化中灌输资源再利用与回收价值;第35题以氨硼烷最便捷的一种脱氢反应为背景,情景真实,尊重客观规律,展示化学前沿。充分发挥试题的科学育人功能。
二、2020年高考全国卷Ⅲ化学试卷命题导向引发的新一轮备考启示
1.夯实基础,强化必备知识
高中化学必备知识包含化学用语与概念、理化变化与反应规律、性质与应用、实验操作与设计、实验原理与方法五个维度进行构建。化学用语包含元素符号与核素符号;电子式与结构式、结构简式;化学方程式与离子方程式、热化学方程式等;物质转化与应用包含典型无机物(含钠、镁、铝、铁、氯、碳、氮、硫8种元素单质及其化合物)和有机物(烷烃、烯烃、卤代烃、醇、醛、羧酸、酯类、酚类)的性质及其转化;理化变化与反应规律包含三态变化及电化学、热力学、动力学、电解质溶液等化学变化;物质结构与性质包含原子结构、分子结构、晶体结构、化学键、氢键、范德华力;实验原理与方法包含实验基础知识(基本仪器、名称、安全标识)、实验基本操作、物质的检验、分离和提纯、定性与定量分析等。
扎实牢靠的基础知识是学生求真理、悟道理、明事理的坚实基础,这在任何一次测试与总复习中都是立足之本。也是我们复习备考的核心所在。
2.创设情景,构筑核心素养
知识与素养之间需要搭建“情景”的桥梁,方可让学生从此岸到彼岸,而高考也是一个“情景”,因此核心素养在高考试卷中的具体体现就是问题解决的能力,这种能力决定了学生不仅要学习基础知识和基本技能,还需要习得解决问题的方法、步骤和意志,方能远离“一讲就懂、一做就错、一考就倒”的噩梦。

