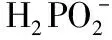工艺流程中物质分离提纯方法盘点
2020-11-17山东孙海清
山东 孙海清
工艺流程题是高考化学常见的题型,主要包含原料预处理、核心化学反应、分离提纯、获得产品四大步,其中物质的分离提纯是非常重要的一环,该步骤涉及的知识面广、方法新颖,命题方式灵活,这令很多同学感到头疼,笔者就物质分离提纯常见的方法进行总结,以期提高同学们分析、解决相关问题的能力。
一、结晶法
热的饱和溶液冷却后溶质因溶解度降低导致溶液过饱和,从而溶质以晶体的形式析出,这一过程叫结晶,具体的题型又分为以下两类:
1.单一溶质或两种溶质(其中一种为少量杂质)
当溶质(或主物质)溶解度受温度影响较小或溶解度随温度升高而减小时,析出晶体的方法是蒸发结晶、趁热过滤、洗涤、干燥。当溶质(或主物质)溶解度受温度影响变化大且溶解度随温度升高而增大时,析出晶体的方法是蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
如:NaCl与KNO3溶解度曲线如图所示:如果要除去NaCl溶液中的少量KNO3杂质,得到NaCl晶体,则采用蒸发结晶、趁热过滤、洗涤、干燥的方法;如果要除去KNO3溶液中的少量NaCl杂质,得到KNO3晶体,则采用蒸发浓缩、冷却结晶、过滤、洗涤、干燥的方法。

2.两种溶质大量共存
在这种情况下首先进行蒸发浓缩、趁热过滤,得到固体与滤液,接着对滤液进行冷却结晶、过滤操作,又得到固体,第一次得到的固体是溶解度随温度变化不大或者溶解度随温度升高而减小的溶质,第二次得到的固体是溶解度随温度变化大的固体。
【例1】(2011·江苏卷·19改编)高氯酸铵NH4ClO4是复合火箭推进剂的重要成分,实验室可通过下列反应制取。
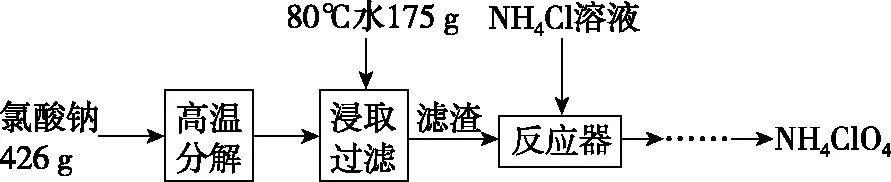

(1)反应得到的混合溶液中NH4ClO4和NaCl的质量分数分别为0.30和0.15,在90℃把混合液加热浓缩,有固体析出,该固体的主要成分是________。
(2)若要从上述混合溶液中获得较多NH4ClO4晶体,要进行的实验操作依次为(填操作名称)________、________、________、冰水洗涤、干燥。用冰水洗涤的目的是____________________。
【答案】(1)NaCl (2)蒸发浓缩 冷却结晶 过滤 减少洗涤过程中NH4ClO4晶体的损失
【解析】(1)混合溶液中NH4ClO4和NaCl的质量分数分别为0.30和0.15,该混合液中有四种溶质:NH4ClO4、NaCl、NH4Cl、NaClO4,但在90℃时NaCl的溶解度最小,故该温度下析出的主要固体是NaCl。(2)由图可知,NH4ClO4的溶解度受温度影响很大,NaCl溶解度受温度影响不大,NH4Cl、NaClO4的溶解度受温度影响也很大,但相同温度下,它们溶解度远大于NH4ClO4,故从混合溶液中获得较多NH4ClO4晶体的实验操作依次为蒸发浓缩、冷却结晶、过滤、并用冰水洗涤、干燥。
二、化学沉淀法

【例2】软锰矿的主要成分为MnO2,还含有Fe2O3、MgO、Al2O3、CaO、SiO2等杂质,工业上用软锰矿制取MnSO4·H2O的流程如图:
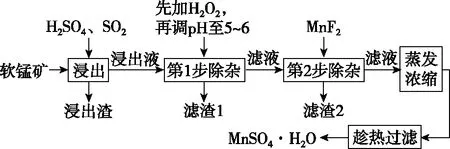
已知:①部分金属阳离子完全沉淀时的pH如表:
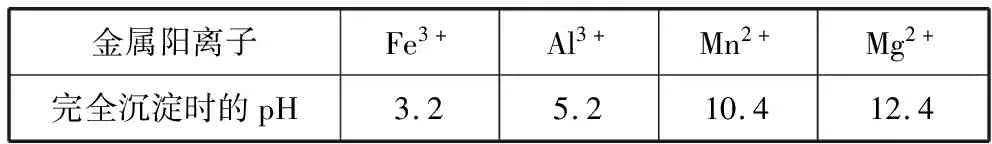
金属阳离子Fe3+Al3+Mn2+Mg2+完全沉淀时的pH3.25.210.412.4
②温度高于27℃时,MnSO4晶体的溶解度随温度的升高而逐渐降低。
(1)第1步除杂中加入H2O2的目的是________________________________________________。
(2)第1步除杂中形成滤渣1的主要成分为________(填化学式),调pH至5~6所加的试剂,可选择________(填以下试剂的序号字母)。
a.CaO b.MgO c.Al2O3d.氨水
(3)第2步除杂,主要是将Ca2+、Mg2+转化为相应氟化物沉淀除去,写出MnF2除去Mg2+的离子方程式:____________________。
(已知:MnF2的Ksp=5.3×10-3;CaF2的Ksp=1.5×10-10;MgF2的Ksp=7.4×10-11)
(4)采用“趁热过滤”操作的原因是________________________________________________。


三、萃取与反萃取法
反萃取法是用反萃取剂使被萃取物从负载有机相返回水相的过程。为萃取的逆过程,反萃取时所使用的水相溶液称为反萃取剂。当一些杂质离子和所需离子共存时,杂质离子又难以除掉,先用萃取技术把需要的物质萃取到有机层中,弃去杂质离子,再用反萃取技术把所需要的离子从有机相萃取到水相。在考试题中萃取与反萃取一般联用,其落脚点是化学平衡的移动。
【例3】V2O5广泛用于冶金、化工等行业,主要用于冶炼钒铁、用作冶金添加剂,占V2O5总消耗量的80%以上,其次是用作有机化工的催化剂。为了增加V2O5的利用率,我们从废钒催化剂(主要成分为V2O5、VOSO4、K2SO4、SiO2和Fe2O3等)中回收V2O5的一种生产工艺流程示意图如下:

(1)①中废渣的主要成分是________________________________________;
①中V2O5发生反应的离子方程式为________________________________________________。

②中萃取时必须加入适量碱,其原因是________________________________________;
③中反萃取操作时加入的x试剂为________________________________________________。
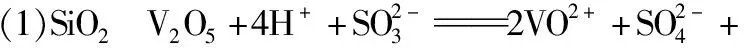
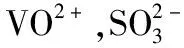
四、离子交换树脂法
当所需要的离子与杂质离子共存而杂质离子又难以除掉(如Na+、K+)时,可以用离子交换树脂进行离子交换,吸附所需要的离子,然后根据已知反应使化学平衡逆向移动,重新生成所需要的离子,这一步称为洗脱,离子吸附与离子洗脱归根到底还是化学平衡的移动。
【例4】(2016·全国卷Ⅲ·28节选)以硅藻土为载体的五氧化二钒(V2O5)是接触法生产硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为
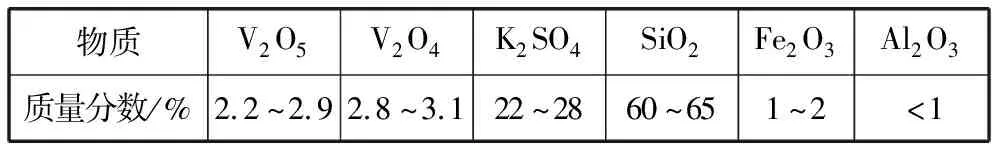
物质V2O5V2O4K2SO4SiO2Fe2O3Al2O3质量分数/%2.2~2.92.8~3.122~2860~651~2<1
以下是一种废钒催化剂回收工艺路线:

回答下列问题:
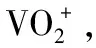
(3)“流出液”中阳离子最多的是________。
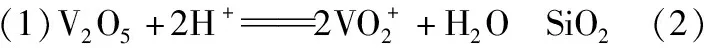
(3)K+
五、电解法
除掉一些易发生氧化还原反应的离子还可以用电解法,该法的基本原理是将杂质离子通过电解过程在阴、阳两极分别发生还原反应和氧化反应转化成气体或者沉淀从而除掉,如将CN-在阳极上氧化为氮气除掉,将Fe2+在阳极上氧化为Fe3+形成Fe(OH)3沉淀除掉等。如果将电解池与阴、阳离子交换膜联用,交换膜本身就有单向通过作用,可有效地去除某些杂质离子。
【例5】(2014·新课标全国卷Ⅰ·27改编)次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性。
(1)早期采用“三室电渗析法”制备H3PO2,其工作原理如图所示,其缺点是产品中混有杂质________,该杂质产生的原因是________________________________________________。
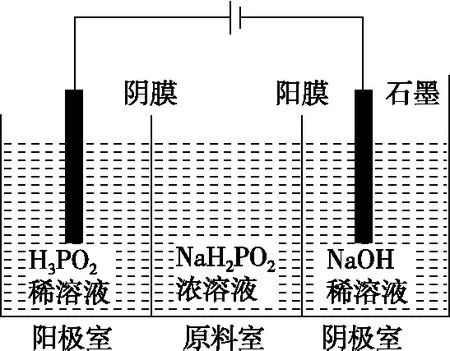
(2)后来制取H3PO2采用“四室电渗析法”,工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):

①写出阳极的电极反应式:____________________。
②分析产品室可得到H3PO2的原因:________________________________________________。