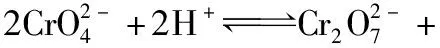溶解度曲线在高考中的拓展与应用
2020-11-17安徽尉言勋
安徽 尉言勋 徐 楠
溶解度是初中知识,在高中化学中没有进行专题学习,但近几年的高考试题中多次考查。溶解度和溶度积都可以表示物质的溶解能力,但它们是两个既有联系又有区别的不同概念。二者本质相同,只是采用的衡量标准不同,可以相互转化。所谓溶解度,是指在一定温度下,某固体物质在100 g溶剂里(通常为水)达到饱和状态时所溶解的质量,在未注明的情况下,通常溶解度指的是物质在水溶液中的溶解度。难溶物质的溶解度还可以用物质的量浓度表示。
一、基本理论介绍
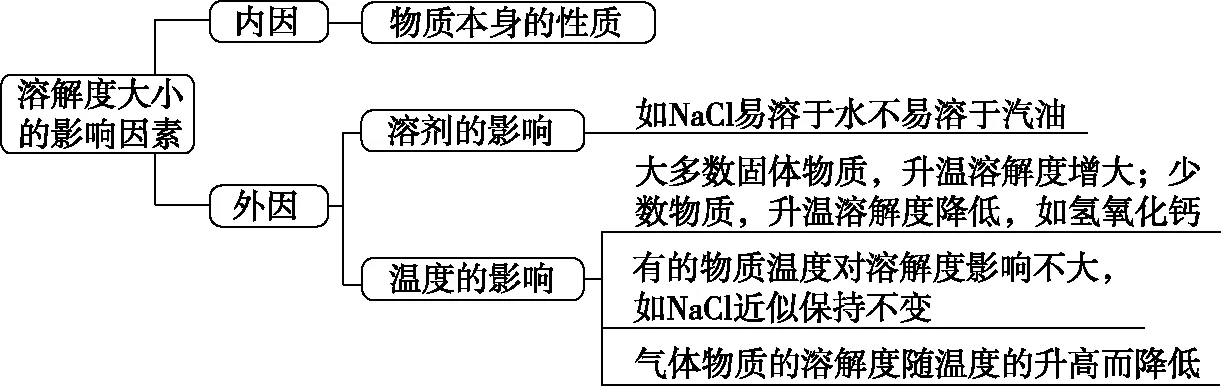
1.溶解度大小的影响因素
2.溶解度曲线
溶解度与温度的对应关系可以用溶解度曲线来表示。溶解度曲线上的任意一点表示平衡状态时溶液的组成,通过读取曲线上的数值可以获得物质在某温度下的溶解度,并比较不同物质在同一温度下的溶解度大小。例如KNO3的溶解度随温度的升高而迅速增大,而Na2SO4、Ce2(SO4)3的溶解度却随温度的升高而减小。对于液体而言,随温度的升高,溶质的溶解度增大,这是因为温度升高,溶液分子间间距增大,更加容易相互进入分子的间隙中。对于气体而言,温度升高,气体从溶液中逸出,溶解度减小。
(1)定义:用纵坐标表示溶解度,横坐标表示温度,根据同种物质在不同温度下的溶解度绘制出来的曲线。
(2)意义:
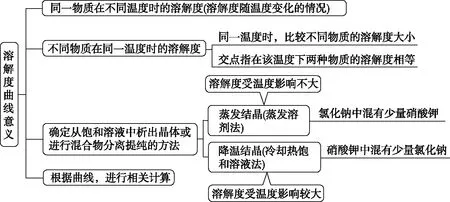
(3)典型曲线
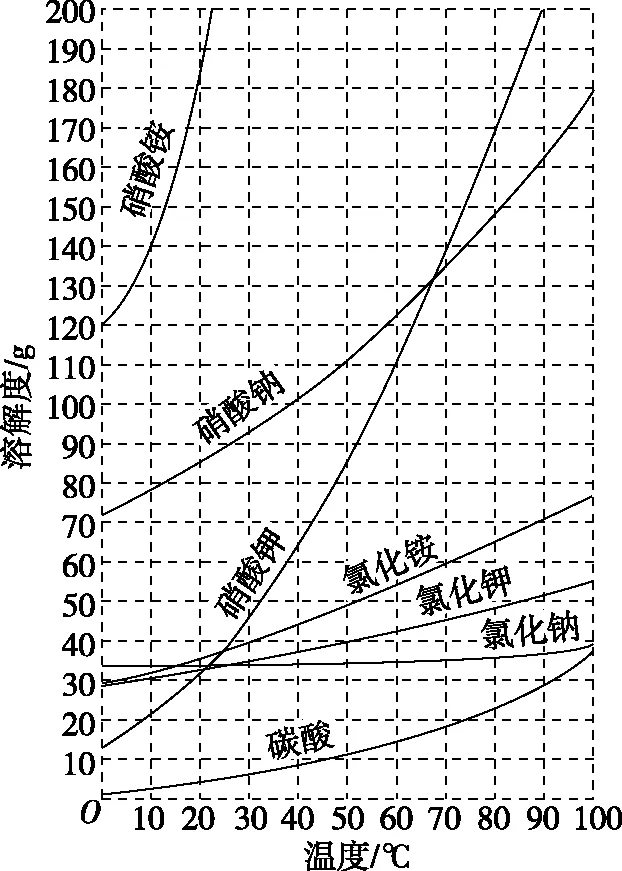
3.溶解度曲线上的点、线、面
(1)点的意义
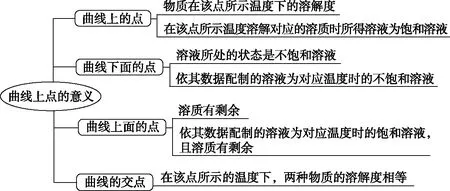
(2)线的意义及应用

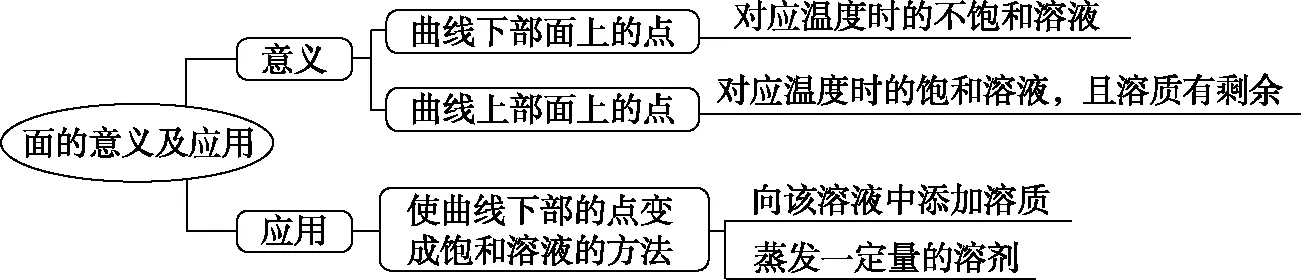
(3)面的意义及应用
4.溶解度与溶度积

溶度积是一个平衡常数,只与温度有关。在溶度积的计算中,离子浓度必须是物质的量浓度,其单位为mol·L-1;而溶解度的单位有g/100 g水、g·L-1、mol·L-1。计算时一般要先将难溶电解质的溶解度S的单位换算为mol·L-1。难溶物质饱和溶液浓度极低时,溶液密度可以认为是水的密度,溶液体积与溶液质量在数值上相等。可由溶解度先求出溶液的物质的量浓度,再计算溶液的Ksp。
(1)AB型(比如:AgCl、AgBr、AgI等)

溶解度:SS
(2)AB2型(比如:Mg(OH)2、Cu(OH)2等,可类推A2B型)

溶解度:S2S
(3)AB3型(比如:Al(OH)3、Fe(OH)3等,可类推A3B型)

溶解度:S3S
说明:对于同种类型化合物而言,Ksp越大,则S越大。但对于不同种类型化合物之间,不能根据Ksp来比较S的大小。
二、典例解析
1.溶解度的概念
【例1】分别取等质量80℃的甲、乙两种化合物的饱和溶液,降温至20℃后,所析出的甲的质量比乙的大(甲和乙均无结晶水)。下列关于甲、乙溶解度的叙述中一定正确的是
( )
A.20℃时,乙的溶解度比甲的大
B.80℃时,甲的溶解度比乙的大
C.温度对乙的溶解度影响较大
D.温度对甲的溶解度影响较大
【答案】D
【解析】降温至20℃后,所析出的甲的质量比乙的大,只能说明甲物质的溶解度受温度影响大,乙物质的溶解度受温度影响小,不能通过析出晶体的多少来比较某一具体温度时两种物质溶解度大小。
【点评】解答本题关键是要知道降温为什么会析出晶体,是因为温度变化引起溶质的溶解度减小,减小的越多,溶质析出的就越多。
2.溶解度曲线的考查
【例2】已知四种盐的溶解度(S)曲线如图所示,下列说法不正确的是
( )
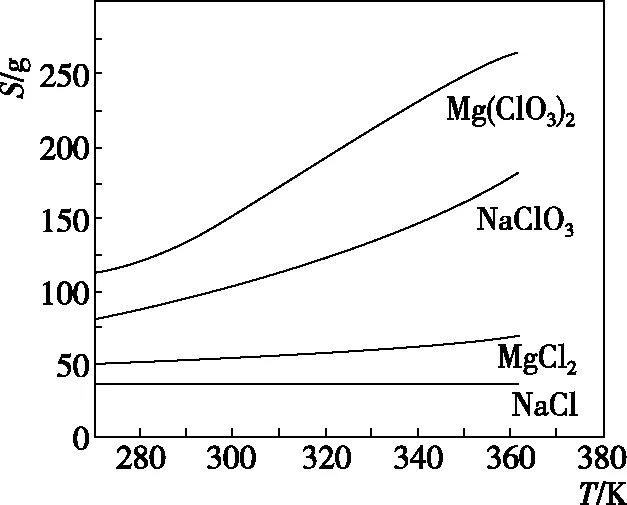
A.将NaCl溶液蒸干可得NaCl固体
B.将MgCl2溶液蒸干可得MgCl2固体
C.Mg(ClO3)2中混有少量NaCl杂质,可用重结晶法提纯
D.可用MgCl2和NaClO3制备Mg(ClO3)2
【答案】B

【点评】掌握溶解度曲线的意义及应用,结合题意灵活分析解答问题;重点考查学生提取图中有效信息的能力,根据图像中各物质的溶解度变化情况,再结合相关选项进行分析。
3.与溶度积结合的考查
【例3】(2014·全国卷Ⅰ·11)溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误的是
( )
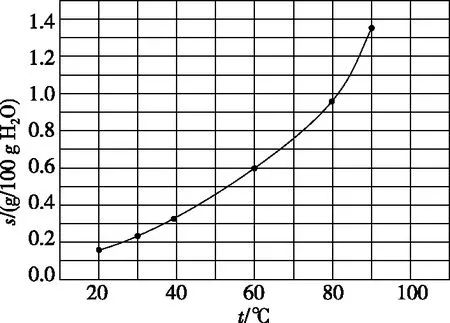
A.溴酸银的溶解是放热过程
B.温度升高时溴酸银溶解速度加快
C.60℃时溴酸银的Ksp约等于6×10-4
D.若硝酸钾中含有少量溴酸银,可用重结晶法提纯
【答案】A
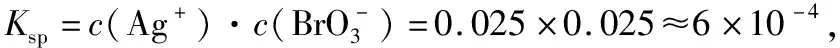
【点评】溶解度指“100克溶剂中溶解溶质的最大质量数”或者“1 L溶液中溶解物质的最大物质的量数”。解答本题时应注意以下两点:①由图像分析横、纵坐标及曲线的意义;②注意Ksp计算公式中应代入物质的量浓度。
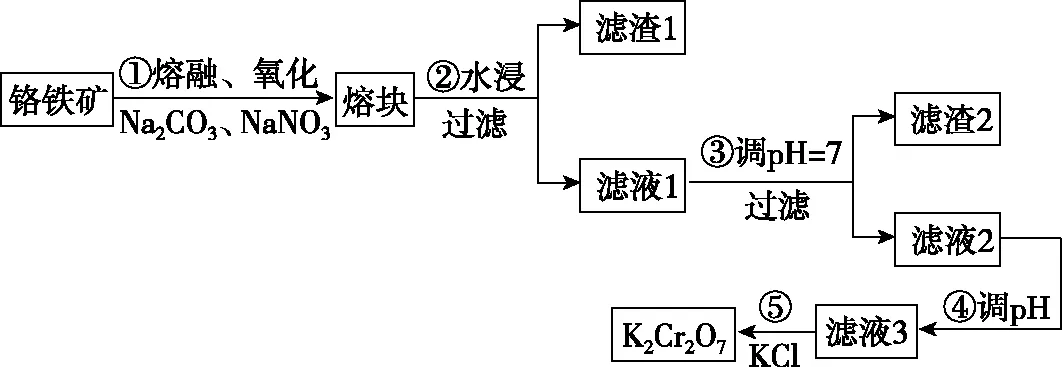
【例4】(2019·全国卷Ⅱ·12)绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是
( )
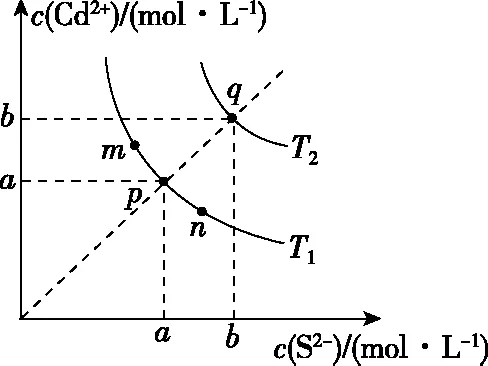
A.图中a和b分别为T1、T2温度下CdS在水中的溶解度
B.图中各点对应的Ksp的关系为Ksp(m)=Ksp(n) C.向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动 D.温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动 【答案】B 【解析】a、b分别表示温度为T1、T2时溶液中Cd2+和S2-的物质的量浓度,可间接表示对应温度下CdS在水中的溶解度,A项正确;Ksp只受温度影响,即m、n、p三点对应的Ksp相同,又T1 【点评】本题以“硫化镉(CdS)是一种难溶于水的黄色颜料”作为背景,考查沉淀溶解的平衡曲线分析。这是全国卷Ⅱ继2013年13题、2015年26题后,再次考查沉淀溶解平衡,与之前的差异是淡化了计算,没有涉及沉淀时pH的计算,重点考查图像分析,以及对概念的理解和平衡移动的思想,侧重考查考生从图像中读取信息的能力、识记、理解和判断能力。 4.工艺流程题中与分离、提纯结合的考查 【例5】(2017·全国卷Ⅲ·27节选)重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示: 回答下列问题: (1)步骤①的主要反应为 上述反应配平后FeO·Cr2O3与NaNO3的系数比为________。该步骤不能使用陶瓷容器,原因是________________________________________________。 (2)滤渣1中含量最多的金属元素是________,滤渣2的主要成分是________及含硅杂质。 (3)步骤④调滤液2的pH使之变________(填“大”或“小”),原因是______________________________(用离子方程式表示)。 (4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到________(填标号)得到的K2Cr2O7固体产品最多。 a.80℃ b.60℃ c.40℃ d.10℃ 步骤⑤的反应类型是________。 【答案】(1)2∶7 陶瓷在高温下会与Na2CO3反应 (2)Fe Al(OH)3 (4)d 复分解反应 【点评】本题以制备K2Cr2O7作为载体,考查物质的分离、提纯等相关知识。分析流程中发生的反应类型、混合物分离提纯方法为解答问题的关键,侧重考查提取信息和分析问题、解决问题的能力,注意元素化合物知识的应用与溶解度曲线的分析。