重组人骨靶向干扰素γ的骨靶向性和对巨噬细胞向破骨细胞分化的影响*
2020-11-16山东省医药生物技术研究中心山东第一医科大学山东省医学科学院国家卫生健康委生物技术药物重点实验室山东省罕少见病重点实验室山东济南250062
山东省医药生物技术研究中心/山东第一医科大学(山东省医学科学院)/国家卫生健康委生物技术药物重点实验室/山东省罕少见病重点实验室(山东 济南 250062)
王志宇 曹广祥 付加芳 宗工理 李俊玲 张佩佩 王世立
骨硬化病又称石骨症,是一种少见的全身性骨结构发育异常的先天性疾病,以骨密度增高、破骨细胞吸收功能障碍为主要特点[1]。2000年,美国FDA批准重组人干扰素γ(rhIFNγ-1b,商品名 Actimmune)上市用于治疗骨硬化病。资料显示,该药用于骨硬化病治疗存在周期长、副作用大等缺点,究其原因与药物的平均组织分布有关[2-4]。我们课题组拟制备能够靶向骨组织的干扰素γ。研究表明由天冬氨酸或谷氨酸组成的寡肽能够选择性输送至骨组织,并且在骨组织内长期保留[5]。已有研究证实偶联有上述酸性氨基酸寡肽的雌激素、左氧氟沙星、碱性磷酸酶、β-葡糖苷酸酶等药物能够选择性靶向骨组织,使药物在骨组织内富集[6-8]。基于上述酸性氨基酸寡肽的骨靶向系统,是否能够应用于干扰素,使IFNγ更多富集于骨组织,目前尚不清楚。
将10个天冬氨酸残基连接于人干扰素γ羧基端,在大肠杆菌内融合表达并纯化[9]。本研究探讨纯化获得的重组人干扰素γ在体外的生物学活性,包括是否具有骨靶向性以及是否能够促进破骨细胞分化。
1 材料与方法
1.1 主要试剂rhIFNγ-D10和rhIFNγ为本实验室制备;RANKL(PeproTech)纳米羟基磷灰石(nHAP,Sigma);BCA蛋白浓度测定试剂盒(碧云天);TRAP染色试剂盒(Sigma);DMEM培养基(Gibco);胎牛血清(四季青)。
1.2 细胞的传代培养小鼠巨噬细胞株RAW264.7(ATCC,美国)用含有10%FBS的DMEM(高糖)培养基,于37℃、5%CO2的细胞培养箱中培养。细胞融合度达到90%以上时,按1:3细胞传代。不使用胰酶消化细胞,加入5mL培养基直接从壁上吹下细胞,转入新的细胞培养瓶,确保细胞贴壁后融合度在25%~50%。
1.3 TRAP破骨细胞染色将RAW264.7细胞(1×105个/mL)接种于24孔细胞培养板,分为RANKL(终浓度100ng/mL)、RANKL+rhIFNγ-D10(分别为100ng/mL和30ng/mL)、RANKL+rhIFNγ(100ng/mL和30ng/mL)、rhIFNγ-D10(30ng/mL)和rhIFNγ(30ng/mL)五个组,每组3个重复孔。加药后隔天更换含有上述细胞因子的新鲜培养液,于诱导后的第4天,按照TRAP试剂盒使用说明对细胞进行染色,利用倒置荧光显微镜(100×)观察各组细胞TRAP染色情况。
1.4 重组人骨靶向干扰素γ(rhIFNγ-D10)的亲骨性评价羟基磷灰石是骨基质的主要成分,本研究采用羟基磷灰石吸附法[10]评价蛋白的体外亲骨性。以纳米羟基磷灰石作为吸附介质,使其与待测蛋白溶液(C0)充分相互作用,除去吸附介质后用BCA(Bicinchoninine acid assay)法测定作用后蛋白溶液的浓度(Ca)。蛋白与羟基磷灰石亲和性的大小通过吸附率计算,公式为:吸附率=(C0-Ca)/C0×100%。
具体方法为:吸取浓度为50μg/mL和100μg/mL的rhIFNγ-D10和rhIFNγ蛋白溶液各5mL,分别加入nHAP 15mg,超声分散5min后,室温下剧烈振摇90 min。另设1×PBS溶液为空白对照组。取溶液过滤并收集所有滤液,BCA法检测并计算滤液中未吸附的蛋白浓度值(μg/mL),根据上述公式计算不同蛋白的吸附率。
1.5 统计学方法所有数据采用SPSS13.0统计软件分析,结果表示为(±s)。实验结果采用配对t检验方法分析。P<0.05为差异具有统计学意义。
2 结 果
2.1 不同种类干扰素对R A W 2 6 4.7 巨噬细胞分化为破骨细胞的影响分别用R A N K L、RANKL+rhIFNγ-D10、RANKL+rhIFNγ、rhIFNγ-D10和rhIFNγ诱导刺激RAW264.7巨噬细胞,并于诱导的第4天采用TRAP细胞染色法检测不同蛋白因子对促巨噬细胞分化为破骨细胞的作用。结果显示,RANKL组在诱导的第4天出现明显的TRAP染色阳性破骨细胞,RANKL+rhIFNγ-D10组和RANKL+rhIFNγ组诱导TRAP染色阳性破骨细胞明显少于RANKL组,rhIFNγ-D10组和rhIFNγ组没有诱导产生TRAP染色阳性破骨细胞。以上结果表明:干扰素包括骨靶向干扰素(rhIFNγ-D10)和非骨靶向干扰素(rhIFNγ)在RANKL存在的前提下,对RANKL促进巨噬细胞向破骨细胞分化具有明显的抑制作用。随机挑选各组第4天的3个视野观察TRAP染色阳性破骨细胞,结果如图1。
2.2 重组人骨靶向干扰素rhIFNγ-D10的亲骨性评价将50μg/mL和100μg/mL(C0)的rhIFNγ-D10、rhIFNγ溶液各5mL,于室温剧烈振荡条件下与超声分散后的羟基磷灰石15mg结合90min。结合后过滤,取滤液BCA法测定溶液中未结合的各蛋白浓度(Ca)。根据公式1.4计算各蛋白吸附率。结果显示,起始浓度为50μg/mL的rhIFNγ-D10组和rhIFNγ组吸附后浓度分别为22.71μg/mL和42.44μg/mL,根据公式计算吸附率分别为54.24%和15.13%,两组差异具有统计学意义(P<0.05),如图2。起始浓度为100μg/mL的rhIFNγ-D10组和rhIFNγ组吸附后浓度分别为46.68μg/mL和86.14μg/mL,根据公式计算吸附率分别为53.32%和13.86%,两组差异具有统计学意义(P<0.05),如图2。以上结果表明:前期制备的重组人骨靶向干扰素(rhIFNγ-D10)具有良好的骨靶向性。

图1 rhIFNγ-D10和rhIFNγ对RAW264.7巨噬细胞分化形成破骨细胞的影响。
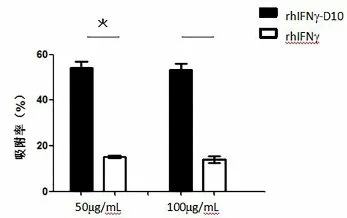
图2 不同浓度的rhIFNγ-D10和rhIFNγ对羟基磷灰石的吸附率。
3 讨 论
骨靶向药物不仅能够提高治疗有效性,而且明显降低毒副作用。其靶向策略主要包括两大类,其一为靶向整个骨组织;其二为特异性地靶向骨细胞,如成骨细胞、破骨细胞等。大多数骨靶向药物靶向骨基质的主要成分羟基磷灰石,包括带负电荷的氨基酸寡肽或二膦酸盐[11]。本研究将10个天冬氨酸寡肽偶联干扰素γ羧基末端,在大肠杆菌原核表达系统表达并纯化[9],其纯化产物经体外羟基磷灰石结合试验表征,证实具有明显的骨靶向性。目前骨靶向药物已用于骨关节炎(OA)、骨质疏松以及骨代谢性发育不良等疾病的治疗[11]。骨靶向性干扰素在动物体内的骨靶向性以及用于骨硬化症等骨疾病的治疗效果有待进一步研究。
2000年美国FDA批准干扰素γ用于骨硬化症治疗,但其机理尚不阐明。干扰素是骨免疫系统重要的细胞因子,其中干扰素γ为II型干扰素。目前认为干扰素-γ在促进破骨细胞形成过程中具有双重作用,抑制或促进破骨细胞分化取决于局部环境中细胞因子的种类与浓度。有研究表明干扰素-γ通过诱导泛素依赖的TRAF6信号分子降解抑制RANK介导的破骨细胞分化[12]。干扰素-γ受体缺陷小鼠体内破骨细胞数量增多并表现出明显骨丢失[12]。此外,干扰素-γ在感染、炎症、雌激素缺乏等病理条件下间接促进破骨细胞形成,但干扰素-γ对破骨细胞形成的直接作用鲜有研究报道[13]。本研究发现在未加入RANKL的实验组,干扰素-γ对破骨细胞没有明显的直接抑制或促进分化作用,但在RANKL促进破骨分化过程中表现出一定的抑制作用,对破骨细胞分化的免疫调控有了新的补充。
综上所述,在羧基末端偶联10个天冬氨酸多肽的骨靶向系统,可有效将干扰素γ靶向至骨组织。本研究利用大肠杆菌表达系统表达的干扰素γ及干扰素γ-D10(即骨靶向干扰素γ)均未显示对巨噬细胞分化为破骨细胞的促进作用。与之相反,在破骨细胞诱导因子RANKL诱导破骨细胞分化过程中,两者均显示一定的抑制作用,其具体的分子调控机制目前鲜有报道。骨硬化症是一种以破骨细胞骨吸收功能障碍为特征的遗传性骨病,本研究初步研究结果表明,干扰素γ及骨靶向干扰素γ对破骨细胞分化有抑制作用,可能不适合骨硬化症治疗,此研究结果与Imel等[14]研究报道一致。此外,乳腺癌、肺癌骨转移过程中,破骨细胞骨吸收功能过度增强[15],本研究发现干扰素γ对破骨细胞分化的抑制作用提示可将干扰素γ用于防治肿瘤骨转移,但具体应用有待进一步深入研究。
