干扰MAP3K1基因对山羊毛囊干细胞增殖和凋亡的影响
2020-11-16马金亮冯云奎张柳明李拥军
马金亮,王 健,冯云奎,王 强,张柳明,李拥军
(扬州大学动物科学与技术学院,江苏省动物遗传繁育与分子设计重点实验室,江苏 扬州 225009)
毛囊作为皮肤附属物,在皮肤内环境平衡中发挥重要作用。20世纪80年代,首次通过同位素标记法确认小鼠毛囊干细胞(Hair follicle stem cell,HFSCs)位置和特征[1]。HFSCs为研究干细胞可塑性优良细胞系[2],其在毛囊发育和再生中发挥重要作用[3-4]。探索山羊HFSCs生物学特性及影响其生长发育相关因素和分子机制,可为促进羊毛生产经济效益提供有利价值。
长江三角洲白山羊,又称海门山羊,是产出优质笔料毛的山羊品种,其颈脊部毛发属于三类毛,色白弹性好,为制作高档毛笔的原材料[5]。目前,关于长江三角洲白山羊优质笔料毛性状形成的研究主要集中在宏观领域,分子机制研究相对缺乏,扬州大学近年不断探索优质笔料毛性状形成分子机制,早期研究发现,雄激素分泌和冷应激可激活参与毛发生长形成阶段某些蛋白质合成(如纤维蛋白原),促进优质笔料毛形成[6-7]。Guo等通过对长江三角洲白山羊优质笔料毛型和非优质笔料毛型山羊颈脊部皮肤组织转录组测序结果发现,优质笔料毛皮肤组织中MAP3K1差异表达并显著上调[8]。本研究以MAP3K1为目的基因,探索干扰其表达后对长江三角洲白山羊HFSCs增殖和凋亡的影响。
MAP3K1为MAPK(丝裂原活化蛋白激酶)家族重要成员,作为信号传导调节因子,可特异性激活MAPKs[9]。MAP3K1基因编码的蛋白MEKK1具有多种生物学功能,MEKK1为MAPK信号通路关键节点,可调控ERK1/2、JNK、p38等因子[10-12],参与细胞增殖、凋亡、分化、迁移和侵袭等生理过程,对细胞存活和生长发挥重要调控作用。Hu等研究发现,沉默MAP3K1基因表达可显著抑制人类乳腺癌细胞周期,成纤维细胞MAP3K1基因缺失可阻碍细胞迁移和侵袭能力[13]。除此之外,MAP3K1在调节小鼠胚胎眼睑闭合分子回路中也发挥关键作用[14]。除MAP3K1相关报道外,其参与的MAPK信号通路也是调控毛囊生长发育关键通路[15]。然而,关于MAP3K1基因对山羊毛囊生长发育的作用机制尚不清楚,因此,本研究利用shRNA技术探究MAP3K1在长江三角洲白山羊HFSCs中功能,为优质笔料毛形成分子机制提供科学参考。
1 材料与方法
1.1 试验材料
长江三角洲白山羊HFSCs由扬州大学江苏省动物遗传繁育与分子设计重点实验室分离培养;DMEM高糖培养基、优质胎牛血清(FBS)、Opti-MEM和0.25%胰蛋白酶消化液均购自美国Gibco公司;Cell Counting Kit-8(CCK-8)细胞增殖-毒性检测试剂盒购自日本同仁公司;EdU细胞增殖检测(成像检测试剂盒)购自广州锐博生物科技有限公司;HiScriptIII RT SuperMix For qPCR和ChamQ Universal SYBR qPCR Master Mix均购自南京诺唯赞生物科技股份有限公司;流式细胞周期和细胞凋亡检测试剂盒均购自上海碧云天生物技术有限公司。
1.2 方法
1.2.1 HFSCs分离和培养
试验用HFSCs分离、培养、鉴定方法参照文献[16],简要过程为:取白山羊胎羊颈脊部皮肤2 cm×2 cm,生理盐水冲洗3次,75%酒精浸泡1 min;用含5%双抗PBS清洗3次后放入无血清DMEM中;将组织块用手术刀切成2 mm×2 mm小块;加入0.25%胰酶于37℃培养箱中消化90 min;去除胰酶,加入含10%FBS、1%双抗DMEM培养液清洗2次,终止消化;挑取毛囊,1 200 r·min-1离心再消化30 min,最后经破碎和过筛获得原代HFSCs并开展后续试验。
1.2.2 干扰载体构建
针对MAP3K1基因设计3个干扰靶点,构建至Pdna316-ZsGreen-ShRN腺病毒干扰载体。首先,稀释已合成引物,每组取22.5 μL引物、5 μL 10×退火缓冲液(1 mol·L-1NaCl,100 mmol·L-1Tris-HCl,pH 7.4)于洁净Eppendorf管中,混合均匀;置于100℃沸水中缓慢降至室温,PstI和BamHⅠ双酶切;16℃连接2 h,将连接产物转化到DH5α感受态细胞中,挑取单克隆抽提质粒酶切鉴定。
1.2.3 引物设计合成
根据GenBank数据库中已知山羊各基因序列,利用Primer Premier 5.0软件分别设计MAP3K1基因,细胞增殖相关基因PCNA、CDK1和CCND2,细胞凋亡相关基因Bax和Bcl-2以及内参基因GAPDH引物,引物序列见表1。引物均由上海生工生物公司合成,MAP3K1干扰片段由武汉金开瑞生物工程有限公司设计合成。
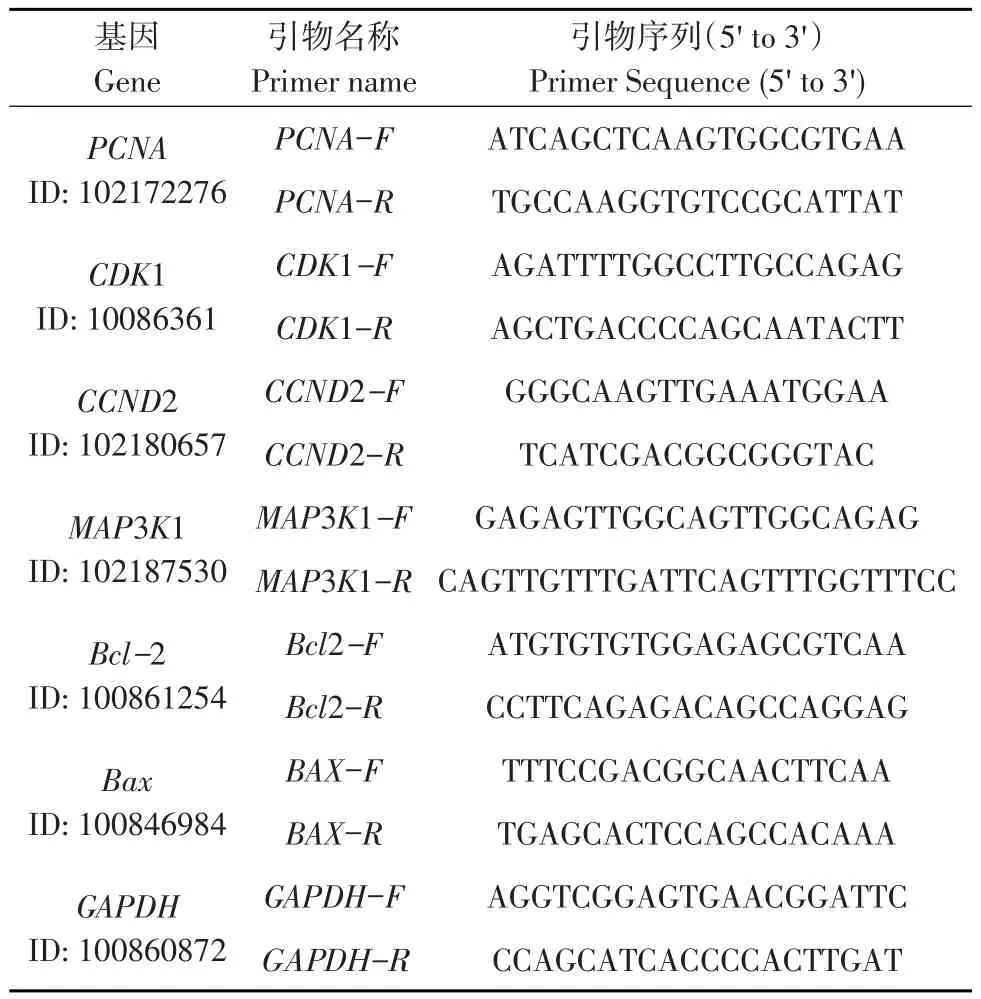
表1 引物序列Table 1 Primer sequences
1.2.4 细胞转染及RNA提取和cDNA合成
取对数生长期HFSCs并接种于6孔培养板,待细胞生长密度达50%~70%时,分别转染shRNA干扰组和阴性对照组(Control组)。转染48 h后,弃去细胞培养液,PBS清洗2遍,利用Trizol法分别提取不同处理组细胞总RNA,测定其浓度后反转录成cDNA。首先加入4×gDNA wiper Mix 4 μL、模板RNA 1 μg、RNase-Free ddH2O至总体积16 μL、42℃ 2 min;再加入5×HiScript III qRT SuperMix 4 μL,与第一步反应液16 μL混合,37 ℃ 15 min、85℃5 s。cDNA于-20℃保存备用。
1.2.5 RT-qPCR检测相关基因表达水平
不同处理组转染48 h后提取RNA,应用实时荧光定量PCR技术检测干扰效率及增殖和凋亡相关基因mRNA表达水平。PCR反应体系15 μL:2×ChamQ Universal SYBR qPCR Master Mix 10 μL,上、下游引物各 0.6 μL,ddH2O 3.2 μL,cDNA 0.6 μL。反应程序:第一步预变性95℃30 s;第二步循环反应95℃10 s,60℃30 s,共40个循环;第三步融解曲线95℃15 s,60℃1 min,95℃15 s。每个样品3次重复,以GAPDH为内参基因,运用2-ΔΔCt方法计算目的基因相对表达量,组间差异利用Origin 7.5(Origin Lab,美国)作数据分析。
1.2.6 CCK-8检测细胞增殖能力
将细胞接种于96孔培养板中,每孔添加100 μL培养基,每组9个独立重复。37℃、5%CO2培养48 h后,每孔加入CCK-8试剂10 μL,继续培养4 h后酶标仪检测OD450nm值。
1.2.7 EdU细胞增殖检测
取对数生长期细胞接种于24孔培养板中,转染各处理组,每组3个独立重复。根据EdU细胞增殖检测试剂盒说明书,转染6 h后,10 μmol·L-1EdU细胞完全培养基继续37℃、5%CO2培养24 h。随后细胞固定、Apollo和DNA染色,荧光显微镜观测,Image J作图像处理。
1.2.8 流式细胞仪法检测细胞周期及细胞凋亡
根据碧云天细胞周期检测试剂盒分析不同处理组对HFSCs细胞周期的影响。首先,将细胞接种于6孔培养板中,转染48 h后将细胞培养液收集到离心管中备用,胰酶消化细胞3 min;加入上一步收集的细胞培养液终止消化并室温1 000 g离心5 min;去除上清液,加入1 mL预冷PBS重悬细胞,转移至1.5 mL离心管中再次1 000 g离心5 min;小心吸出上清,加入1 mL预冷70%乙醇,轻轻吹打混匀,4℃固定12~24 h;1 000 g离心5 min后吸去上清,加入1 mL预冷PBS重悬细胞,再次离心沉淀细胞;小心吸去上清,每管加入0.5 mL碘化丙啶染色液,37℃避光温浴30 min。使用流式细胞仪检测细胞周期。
根据碧云天Annexin V-FITC细胞凋亡检测试剂盒分析不同处理组细胞凋亡率。将细胞接种6孔培养板中,48 h后将细胞培养液吸至离心管,PBS洗涤细胞1次,加入胰酶消化细胞3 min;加入上一步收集的细胞培养液,吹打细胞,1 000 g离心5 min,弃上清,PBS重悬细胞并计数;取5~10万重悬细胞,1 000 g离心5 min,弃上清,加入195 μL Annexin V-FITC结合液重悬细胞;加入5 μL Annexin V-FITC,混匀;加入 10 μL PI染色液,混匀;室温避光10~20 min后立即使用流式细胞仪检测细胞凋亡情况。
1.2.9 统计学分析
所有数据均以平均值(M)±标准误(SEM)表示,每个试验至少3个独立生物重复。采用SPSS 24.0软件(IBM,美国)作单因素方差分析,使用Origin 7.5和SPSS 24.0软件作样本独立性t检验。P<0.05为差异显著,P<0.01为差异极显著,*P<0.05,**P<0.01。
2 结果与分析
2.1 MAP3K1干扰效率检测
将HFSCs传代培养并铺板于6孔培养板中,分别转染MAP3K1-sh1、MAP3K1-sh2、MAP3K1-sh3和阴性对照(Control组),48 h后提取RNA,利用RT-qPCR法检测干扰效率,结果见图1。由图1可知,与对照组相比,MAP3K1-sh2干扰效率最佳,干扰效率高达70%(P<0.01)。因此后续功能试验选用MAP3K1-sh2作为MAP3K1基因干扰载体。
2.2 干扰MAP3K1对增殖、凋亡相关基因mRNA表达水平的影响
以GAPDH为内参基因,运用RT-qPCR技术研究shRNA干扰MAP3K1基因对增殖和凋亡相关基因mRNA表达量的影响。由图2可知,与对照组相比,MAP3K1-sh2组增殖相关基因PCNA、CDK1、CCND2相对表达量显著降低(P<0.05),促凋亡基因Bax相对表达量显著上升(P<0.05),抗凋亡基因Bcl-2相对表达量极显著降低(P<0.01)。由此推测,干扰MAP3K1基因表达,显著抑制HFSCs增殖,促进HFSCs凋亡。
2.3 干扰MAP3K1基因抑制山羊HFSCs增殖
通过CCK-8、EdU和细胞周期试验探讨干扰MAP3K1基因表达对HFSCs增殖的影响,结果如图3所示。采用CCK-8法检测HFSCs增殖能力,干扰MAP3K1基因后,细胞增殖受到抑制,OD450nm值显著下降(P<0.05)(见图3A)。
EdU试剂盒检测细胞增殖能力发现MAP3K1-sh2组比对照组HFSCs阳性细胞率显著下降(P<0.05)(见图3B,C)。利用流式细胞仪检测细胞周期结果发现,对照组G0/G1、S、G2/M期细胞数量分别为79.75%、12.77%和7.48%(见图3D);MAP3K1-sh2组G0/G1、S、G2/M期细胞数量分别为77.64%、14.63%和7.73%(见图3E)。
与对照组相比,G0/G1期细胞数量下降,S期细胞数量上升,且差异极显著(P<0.01),表明细胞被阻滞在S期。以上结果表明,干扰MAP3K1基因表达显著抑制HFSCs增殖。
2.4 干扰MAP3K1基因促进山羊HFSCs凋亡
利用流式细胞仪检测细胞凋亡率,MAP3K1-sh2组活细胞数量(90.48%)相比于对照组(94.36%)显著下降,而总细胞凋亡率MAP3K1-sh2组(8.7%)相较于对照组(4.98%)差异极显著上升(P<0.01),表明干扰MAP3K1基因显著促进HFSCs凋亡。
3 讨论与结论
HFSCs与其他成体干细胞相同,具有慢周期性、未分化性、可诱导性和较强的体外增殖能力等。HFSCs可分化为表皮、皮脂腺、毛囊,对表皮再生和修复、毛色形成以及毛发再生起重要作用[17]。毛囊控制毛发生长,毛发脱落、生长和修复依赖于HFSCs增殖、分化和迁移,且皮肤组织结构状态和毛囊性状对羊毛品质和产量有较大影响[18]。因此,近年来对HFSCs生物学研究成为科研热点。
MAP3K1为MAPK信号通路上游调控因子,可参与多种组织和细胞类型的生物学反应。研究表明,MAPK信号通路参与并调控毛囊生长发育,促进HFSCs增殖和分化[19],课题组前期转录组测序结果同样表明,MAPK信号通路参与毛囊生长发育。而转录组测序结果发现,在前20位差异表达基因中MAPK信号通路包含3个关键基因,分别为MAP3K1、DUSP1和DUSP6,推测MAP3K1对长江三角洲白山羊优质笔料毛性状形成起重要作用[20]。目前MAP3K1对山羊HFSCs增殖、凋亡影响尚不清楚,但MAP3K1对细胞具有促进或抑制凋亡的双重作用[21],通过激活MAP2K4/7-JNK-JUN,MAP2K1/2-ERK/12和NF-κB促进细胞存活,而全长MAP3K1基因调节细胞迁移和促生存信号传导,其caspase-3介导裂解产生C末端结构域,促进细胞凋亡[22-23]。除促进细胞生存或凋亡外,MAP3K1还调节各种细胞类型运动和迁移。例如,在新生小鼠中敲除MAP3K1基因导致上皮细胞迁移缺陷,造成眼睑无法闭合[24];缺乏MAP3K1胚胎成纤维细胞和干细胞则运动性能受损,而MAP3K1过表达可诱导板状伪足样结构形成[25];在视网膜发育过程中,MAP3K1缺失促进胶质细胞增殖和凋亡[26],而MAP3K1基因下调,显著抑制B6小鼠眼睑角质形成细胞增殖和迁移,影响细胞生物学行为[27]。
本研究成功从长江三角洲白山羊颈脊部分离并培养HFSCs,通过体外细胞试验发现,干扰MAP3K1基因表达,干扰效率达到70%,对HFSCs增殖具有显著抑制作用。研究表明,一些因子可通过激活MAPK信号通路阻断细胞周期,抑制细胞增殖[28]。本试验发现,下调MAP3K1基因表达后,显著抑制HFSCs增殖,细胞周期试验发现细胞被阻滞于S期,揭示MAP3K1基因参与HFSCs增殖调控。同样,细胞凋亡试验发现,干扰MAP3K1显著促进HFSCs细胞凋亡率,活细胞数量显著低于对照组,揭示MAP3K1基因参与HFSCs凋亡调控。研究为探索长江三角洲白山羊优质笔料毛的分子调控机制提供新见解。
