不同发育时期大豆豆荚性状QTL动态分析
2020-11-16滕卫丽郭志文郑立娜董莹莹张丹洋刘赫禹冯文婧韩英鹏李文滨
滕卫丽,郭志文,郑立娜,付 雪,王 博,董莹莹,张丹洋,刘赫禹,冯文婧,赵 雪,韩英鹏,李文滨
(东北农业大学大豆研究所,大豆生物学教育部重点实验室,农业农村部东北大豆生物学与遗传育种重点实验室,哈尔滨 150030)
大豆(Glycine max)是我国重要粮食和经济作物,其蛋白质和油分含量较高,不仅提供食用原料,还可用于加工副产品和饲料[1]。豆荚长度、宽度和厚度是影响大豆籽粒生长必要因素,同时也是影响大豆产量的重要农艺性状。
范秀凤等利用食用大豆杂交组合分析豆荚荚长、荚宽及荚厚与产量相关性,结果表明荚长和荚宽与产量呈正相关,荚厚与产量呈显著相关,与籽粒百粒重相关不显著[2]。韩立德等研究发现,荚长、荚宽和荚厚3个性状生长发育符合Logistic生长曲线,荚长、荚宽在花期后15 d左右快速增长,荚厚在30 d左右呈快速增长[3]。
为研究某一特定性状基因动态时空表达,Wu等采用动态QTL定位方法,利用水稻品种H359和Acc8558构建重组自交系群体,分析水稻分蘖数动态,检测到5个QTL位点在分蘖活跃期表达,均呈S型表达曲线[4]。Wu等利用条件分析法,探究控制白杨植株生长表观遗传QTL,检测到3个位于B、E和O连锁群,QTL对生长轨迹变化贡献明显[5]。Yan等分析不同时期水稻分蘖数动态,检测到15个非条件QTL、20个条件QTL,在非条件各时期和条件部分时期均检测到tn1-4,不同时期影响水稻分蘖QTL数量不同,且条件QTL映射可更好解释不同生长阶段遗传效应[6]。何慈信等利用水稻品种IR64和Azucena为亲本创建DH群体,分析不同时期叶挺动态QTL,检测到13个QTLs,其中在拔节期和抽穗期多次检测到Hls 1-2、Hls 3-3、Hls 2和Hls 4等4个条件QTLs[7]。周蓉等利用中豆29和中豆32构建重组自交系对大豆株高和茎粗作动态QTL定位,检测到19个茎粗QTLs分布在9个连锁群上,18个株高QTLs分布在11个连锁群上,在部分位点不同年份中重复表达,不同时期位点存在连续表达,株高与茎粗QTL存在共位性[8]。Sun等分析大豆主茎荚数和株高发育QTL发现,分布在6个连锁群中10个非条件QTL和3个连锁群中5个条件QTL与主茎荚数有关,分布在7个连锁组中13个非条件QTL和6个连锁群中12个条件QTL与株高有关,其中5个标记区间(satt509-satt251、sat_099-sat_113、sat_113-OPAW19_4、satt457-OPC10_85和sat_095-OPBA08_5)与主茎荚数发育和株高发育均有关[9]。
动态QTL分析已广泛应用在水稻、大豆等不同作物,鉴定出大量与产量、品质等相关性状条件和非条件QTL,但目前与大豆豆荚性状有关动态QTL研究鲜有报道。本研究利用东农46号与L-100杂交衍生的RIL群体,结合全基因组重测序技术,对大豆荚长、荚宽和荚厚等3个性状作动态QTL精确定位,以期为分子辅助育种提供依据。
1 材料与方法
1.1 试验材料
1.1.1 RIL群体
RIL群体由东北农业大学大豆研究所育成的东农46为母本和日本引进大豆种质L-100为父本杂交衍生的127个F2∶12代家系组成,种植在东北农业大学盆栽试验场,选择生长一致植株,每盆保苗3株,重复3次。
1.1.2 性状调查
记录亲本及群体各家系生育时期,自家系进入生殖生长到达R3期,将每个家系3个植株挂白牌并标记序号,黑白红三色细绳分别系在每个植株第10节间3个生长一致豆荚基部,每个家系固定测定9个豆荚。当每个家系达到R3~R8时,利用电子游标卡尺测量9个豆荚不同发育时期长度、宽度、厚度表型值,直至豆荚完全成熟。
1.2 大豆遗传图谱构建
东北农业大学大豆研究所大豆分子设计及全基因组编辑实验室利用全基因组重测序技术,对RIL群体127个家系作测序。将子代群体和父母本基因组序列作比对与调整,构建大豆遗传连锁图谱。该图谱覆盖20条染色体,总长为3 672.52 cM,各条染色体上图距126.29~286.25 cM,包含4 004个标记,每条染色体上标记数在124~295个标记之间,标记间平均距离为0.95 cM。
1.3 统计方法
利用Microsoft Excel 2013处理RIL群体各家系豆荚荚长、荚宽和荚厚表型数据,利用SPSS Statistics 17统计数据并分析相关性。
1.4 QTL分析
利用QTL IciMapping 4.1软件中完备区间作图法分析豆荚性状加性效应(ICIM-ADD)和上位性(ICIM-EPI)。QTL命名以Q+荚长、荚宽或荚厚英文缩写(PL、PW和PT)+对应染色体序号,如果一条染色体上出现多个位点,则染色体序号后添加序号,例如QPL-1-2表示在1号染色体上有第二个控制豆荚荚长QTL。
2 结果与分析
2.1 大豆RIL群体豆荚性状分析
2.1.1 大豆RIL群体豆荚性状表型值分析
表1列出大豆RIL群体及其亲本不同生育时期豆荚荚长、荚宽和荚厚表型数据。由表1可知,母本东农46属于大荚品种,父本L-100属于小荚品种,双亲在R3~R8等6个时期荚长、荚宽和荚厚均存在差异,且随时间推移差异逐渐增加,荚长和荚厚在R7时期均达到最大值,荚宽在R8时期达到最大值。RIL群体中豆荚性状在不同家系间存在较大变异度,在不同生育时期均存在超亲家系。从峰度和偏度可看出,不同生育时期豆荚性状偏度除R3时期外,其余各生育时期均<1,除荚长和荚宽峰度R3时期外,其余各生育时期均在正常范围内,各生育时期豆荚性状总体符合正态分布。

表1 亲本和RIL后代群体豆荚性状表型值分析Table 1 Phenotypic analysis of pod traits of parents and RIL populations
大豆RIL群体豆荚性状不同生育时期频数分布见图1。结果表明,3个性状不同生育时期群体内变异程度符合数量性状分布特点,均呈正态分布,可用于QTL定位。
2.1.2 大豆RIL群体豆荚性状表型相关分析
由表2可知,在P=0.01水平上,不同生育时期(R3~R8)豆荚荚长、荚宽和荚厚之间均存在极显著正相关,豆荚荚宽与荚厚之间也均存在极显著正相关。

表2 不同生育时期RIL群体豆荚性状表型相关分析Table 2 Phenotypic correlation analysis of pod traits RIL populations during different fertility periods
2.2 大豆RIL群体豆荚性状发育动态QTL分析
利用QTL IciMapping 4.1软件中完备区间作图法ICIM-ADD分析加性效应,选用的LOD阈值大于2.5;利用ICIM-EPI方法分析上位性,LOD阈值大于5,对豆荚3个性状作条件与非条件QTL定位。
2.2.1 豆荚性状非条件QTL定位
利用ICIM-ADD方法对豆荚荚长作非条件QTL定位,在5个生育时期均检测到相应QTL(见表3,图2)。在R3期检测到3个QTL,分别为QPL-1-1、QPL-1-2和QPL-11-1,解释4.35%~4.58%贡献率,加性效应为6.85~8.32,等位基因均来源于母本东农46。在R4期检测到4个QTL,分别为QPL-10-1、QPL-13-1、QPL-13-2和QPL-20-1,解释6.48%~12.70%贡献率,加性效应为-3.64~4.37,其中QPL-13-2位点贡献率最大,等位基因来源于父本L-100。在R6期检测到3个QTL,分别为QPL-4-1、QPL-12-1和QPL-16-1,解释7.83%~11.30%贡献率,加性效应为-1.38~2.18,其中QPL-16-1贡献率最大,等位基因来源于母本东农46。在R7期检测到5个QTL,为QPL-4-2、QPL-6-1、QPL-7-1、QPL-12-2和QPL-14-1,解释6.32%~11.17%贡献率,加性效应为-1.71~1.66,其中QPL-12-2贡献率最大,等位基因来源于父本L-100。在R8期检测到4个QTL,分别为QPL-6-2、QPL-7-1、QPL-12-2和QPL-14-2,解释7.31%~13.16%贡献率,加性效应为-1.92~1.83,其中QPL-12-3贡献率最大,等位基因来源父本L-100。
利用ICIM-ADD方法对豆荚荚宽作非条件QTL定位,3个时期均检测到相应QTL(见表4,图2)。在R4期检测到3个QTL,分别为QPW-6-1、QPW-16-1和QPW-20-1,解释9.36%~16.31%贡献率,加性效应为0.44~0.95,其中QPL-20-1贡献率最大,等位基因来源于母本东农46。在R5期检测到4个QTL,分别为QPW-5-1、QPW-1-1、QPW-14-1和QPW-19-1,解释8.92%~14.62%贡献率,加性效应为-0.66~0.33,其中QPW-14-1贡献率最大,等位基因来源于母本东农46。在R8期检测到1个QTL(QPW-8-1),贡献率为13.65%,加性效应为0.31,等位基因来源于母本东农46。
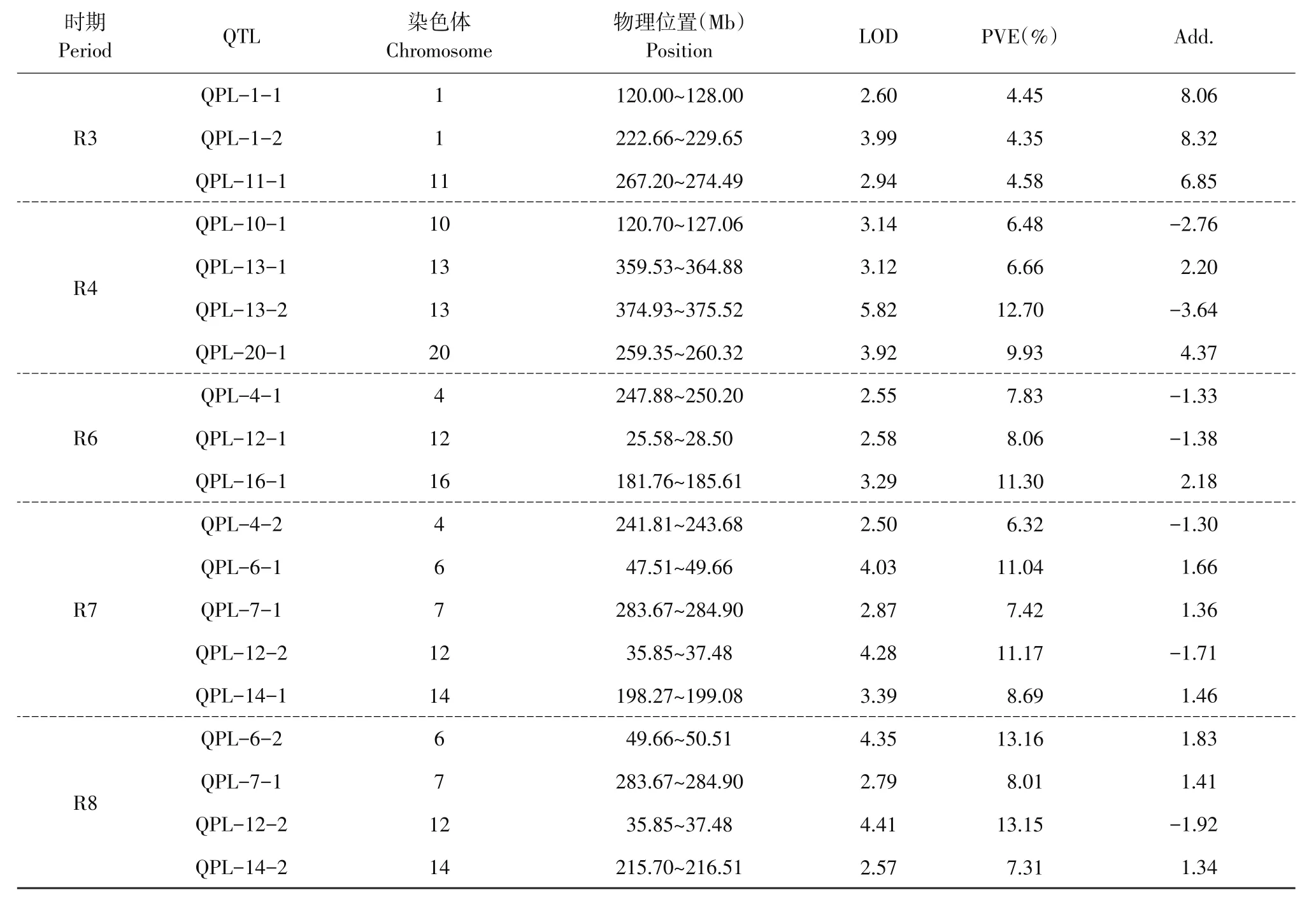
表3 不同生育时期RIL群体豆荚荚长非条件QTLs及其效应Table 3 Unconditional QTLs and their effects on pod length of RIL population during different fertility periods

表4 不同生育时期RIL群体豆荚荚宽非条件QTLs及其效应Table 4 Unconditional QTLs and their effects on pod width of RILpopulation during different fertility periods
利用ICIM-ADD方法对豆荚荚厚作非条件QTL定位,5个时期均检测到相对应QTL位点(见表5,图2)。在R3期检测到3个位点,分别为QPT-4-1、QPT-10-1和QPT-13-1,解释12.95%~25.52%贡献率,加性效应为-0.41~0.32,其中QPT-13-1贡献率最大,等位基因来源于父本L-100。R5期检测到3个位点,分别为QPT-1-1、QPT-1-2和QPT-11-1,解释9.12%~15.47%贡献率,加性效应为4.16~7.01,其中QPT-11-1贡献率最大,等效基因来源于父本L-100。R6期检测到1个位点(QPT-12-1),贡献率为10.46%,加性效应为-0.29,等位基因来源于母本东农46;R7期检测到4个位点,分别为QPT-1-3、QPT-10-1、QPT-12-2和QPT-14-1,解释6.54%~13.58%贡献率,加性效应为-0.46~0.30,其中QPT-12-2贡献率最大,为13.58%,等位基因均来源于母本东农46。R8期检测到2个位点,分别为QPT-10-2和QPT-12-3,贡献率分别为8.85%和12.87%,加性效应分别为-0.34和0.27,其中QPT-12-3贡献率最大,等位基因来源于母本东农46。
2.2.2 豆荚性状条件QTL定位
利用QTL IciMapping 4.1软件完备区间作图法对豆荚性状作条件QTL定位(见表6,图2),共检测到12个条件QTLs。其中1个与荚长相关QTL位点,为QPL-10-2,贡献率为13.74%,加性效应为正,动态增效基因来源于东农46;3个与荚宽相关QTL位点,解释4.86%~23.32%贡献率,其中QPL-20-1贡献率最大,为23.32%,位于20号染色体,表现为正效应,动态增效基因来源于东农46;8个与荚厚相关QTL位点,分别位于1、2、8、14、17和20号染色体,解释3.80%~21.92%贡献率,其中QPT-17-1贡献率最大,为21.92%,表现为负效应,动态增效基因来源于L-100。
2.3 豆荚性状上位性分析
利用完备区间作图法分析3个豆荚性状条件和非条件上位性效应,检测到143对荚长上位性QTL位点,其中条件上位性30对,解释2.11%~29.69%贡献率,主要集中在R6~R5和R8~R7阶段,非条件上位性113对,解释0.66%~23.92%贡献率,集中在R3期,总上位性效应为-9.10~7.20;检测到185对荚宽上位性QTL位点,其中条件上位性116对,解释0.58%~24.73%贡献率,集中在R6~R5阶段,非条件上位性69对,解释0.94%~22.16%贡献率,集中在R3期,总上位性效应为-1.70~1.72;检测到34对荚厚上位性QTL位点,其中条件上位性9对,解释14.99%~25.17%贡献率,非条件上位性25对,解释1.83%~24.82%贡献率,集中在R5期,总上位性效应为-0.83~0.67。

表5 不同生育时期RIL群体豆荚荚厚非条件QTLs及其效应Table 5 Unconditional QTLs and their effects on pod thickness of RIL population during different fertility periods

表6 大豆RIL群体豆荚性状条件QTLs及其效应Table 6 Conditional QTLs and their effects of pod traits of RIL population
3 讨 论
大豆豆荚从R3期开始生长到R8期脱水完全成熟,经历豆荚伸长、增宽,荚厚增加(鼓粒)和成熟三个阶段。在生物学上检测与豆荚荚长、荚宽和荚厚相关QTL位点,分析不同时期生物累积基因表达,充分揭示在豆荚生长发育过程中不同基因表达情况,可在生育时期某个特定阶段获得并剖析总体概况,估算每个时间间隔内净生物累积量和基因时序性表达[10]。
本研究在不同生育时期检测到豆荚性状40个非条件QTL和12个条件QTL。但6个生育时期未同时检测到位点,少数位点可多次检测,如在非条件下荚长R4时期和条件下R4~R3阶段均检测到QPL-20-1,与非条件下荚宽R4时期检测到QPW-20-1染色体位置、标记区间均相同;非条件下荚宽和荚厚分别在R7时期检测到染色体位置、标记区间均相同的QPW-1-1和QPT-1-3两个位点表达,表明存在一因多效作用。条件QTL检测到12个QTL,未在不同时期、性状间检测到相同QTL,说明控制豆荚生长基因具有时序性和选择性表达[11],这与刘宾等[12]检测到10个QTL无一位点在所有时空表达研究结果一致。
大豆豆荚生长发育时期,R3~R6期为豆荚荚长快速增长期[13],检测到QTL较多,而R3期检测出3个荚长QTL加性效应较高,可能与处于花荚生长衔接时期有关。在R7和R8期均检测到QPL-7-1、QPL-12-2,且QTL贡献率、加性效应均接近,可能与豆荚叶绿素、可溶性碳水化合物含量降低,豆荚对籽粒转运量降低有关[14]。荚宽检测到非条件QTL贡献率均较高,加性效应均较低,检测到条件QTL贡献率和加性效应值随时间推移而减小,与周蓉等研究大豆动态株高QTL在不同生育时期加性效应方向一致[8]。荚厚在R5期检测到非条件QTL加性效应最大,可能与R5期大豆处于鼓粒初期,初生根和侧生根快速生长间接促进豆荚籽粒生长,厚度开始增加有关[15-16]。
本研究在不同发育时期豆荚3个性状均检测到较多上位性效应位点,最多解释29.69%表型变异,表明在豆荚生长发育过程中,这些上位性QTL对豆荚生长影响较大[19]。但R3期荚长和荚宽与R6~R5阶段荚宽贡献率未达2%,可能是由于豆荚在R3期形成以及R6~R5阶段豆粒干物质快速积累时,涉及基因间相互作用多,但效应较低[13,18],而RIL材料还可能存在一定变异[19-20],导致基因间相互作用发生改变,对植株表型产生影响[21-22]。
与周蓉等研究大豆株高和茎粗检测到QTLs相比[8],本研究检测到非条件QTL和条件QTL相对较少,这可能与大豆生育后期降雨量较大,部分植株有落荚现象有关,另一方面可能与基因选择表达有关,环境因素影响植株豆荚表型变化从而适应外界条件[22]。
4 结 论
a.在豆荚3个性状发育过程中,共检测到40个非条件加性效应QTL,贡献率4.35%~25.52%;检测到12个条件加性效应QTL,贡献率3.80%~23.32%。
b.多个非条件和条件QTL在不同性状、不同时期被同时检测到,如QPL-7-1、QPL-12-2、QPL-20-1(QPW-20-1)、QPW-1-1(QPT-1-2)、QPW-14-1(QPL-14-1)和QPT-12-1,说明基因表达具有时空性和选择性。
c.检测到豆荚3个性状上位性效应,其中荚长143对,贡献率0.66%~29.69%;荚宽185对,贡献率0.58%~24.73%,荚厚34对,贡献率1.83%~25.17%,表明多基因效应在豆荚生长发育过程中具有重要作用。
