食品中赤藓红HPLC 检测方法优化
2020-11-14陆雅丽陈舒忆李美位
陆雅丽,万 程,许 斌,陈舒忆,刘 鑫,李美位
(1.贵阳市食品药品检验检测中心,贵州贵阳 550081;2.江西农业大学食品科学与工程学院,江西 南昌 330045)
0 引言
色素是一种食品添加剂,食用色素分为天然色素和合成色素2 种。合成色素价格低廉、稳定性好,在食品工业中被广泛应用,但是合成色素具有一定的毒性,对人体健康存在一定的危害作用[1-3]。杨娟艳等人[4]报道过餐饮食品中存在滥用合成色素的现象。因此,合成色素的检测对我国的食品质量安全的监管具有十分重要的意义。
国标GB 5009.35—2016《食品安全国家标准 食品中合成着色剂的测定》[5]中,赤藓红色素的检测不能和胭脂红等其他6 种色素采用同样的前处理方法,赤藓红色素单独的前处理过程无疑加重了检测工作。GB 5009.35—2016 检测胭脂红等6 种色素时采用聚酰胺吸附法,赤藓红色素的检测需要采用液-液分配法。在实际检测工作中发现,一些红糖等颜色深、糖分含量高的食品采用国标GB 5009.35—2016 检测赤藓红色素时,国标中的方法对赤藓红色素的前处理效果不理想,不仅赤藓红色素提取过程繁琐,更不能有效去除杂质(若最终上机的溶液不能有效去除杂质,对液相色谱柱的损耗较大),如果能把赤藓红和其他色素同时进行前处理,既简化了检测工作,还可以保护高值耗材-高效液相色谱柱,延长液相色谱柱的使用寿命。
选择食品色素中常见的胭脂红和日落黄,和赤藓红一同研究色素前处理过程,通过检测色素的回收率来验证色素前处理过程中是否有效。并通过试验研究前处理过程中各种试剂试药对色素回收率的影响,也为后期研究色素的质量标准研究提供支撑。
1 材料与方法
1.1 材料与试剂
赤藓红、胭脂红、日落黄,中国食品药品检定研究院提供;甲醇(色谱级)、甲酸、乙酸铵、无水乙醇、氨水、聚酰胺粉(100~200 目)。
1.2 仪器与设备
Agilent Infinity 1260 型高效液相色谱仪,上海和泰产品;Master-s 型纯水机;BSA224S 型天平;AISITE DFD-700 型水浴锅等。
1.3 试验方法
参照国标GB 5009.35—2016《食品安全国家标准食品中合成着色剂的测定》[5],样品溶液(由色素标准物质制成1 μg/mL 的溶液) 加柠檬酸溶液调pH 值至6,加热至60 ℃,将1 g 聚酰胺粉加少许水调成粥状,倒入样品溶液中,搅拌片刻,以G3 垂融漏斗抽滤,用60 ℃,pH 值为4 的水洗涤3~5 次,然后用甲醇-甲酸混合溶液洗涤3~5 次,再用水洗至中性,用乙醇- 氨水溶液- 水混合溶液解析3~5 次,直至色素完全解析,收集解析液,加乙酸中和,蒸发至近干,加水溶解,定容至5 mL。经0.45 μm 微孔滤膜过滤,置于高效液相色谱仪中进行分析。
该试验过程中60 ℃,pH 值为4 的水、甲醇-甲酸混合溶液是洗脱溶液,乙醇-氨水溶液-水混合溶液是解析溶液。
乙酸铵溶液(0.02 mol/L):称取1.54 g 乙酸铵,加水至1 000 mL 溶解,经0.45 μm 微孔滤膜过滤。
氨水溶液:量取氨水2 mL,加水至100 mL,混匀。
甲醇- 甲酸混合溶液:量取甲醇60 mL,甲酸40 mL,混匀。
柠檬酸溶液:称取20 g 柠檬酸,加水至100 mL,溶解混匀。
pH 值6 的水:水加柠檬酸溶液调pH 值到6。
pH 值4 的水:水加柠檬酸溶液调pH 值到4。
1.4 色谱条件
色谱柱:Diamonsil C18柱(4.6 mm×150 mm,5 μm),进样量10 μL,柱温35 ℃,紫外检测器波长254 nm,流动相梯度洗脱。
流动相梯度洗脱见表1。
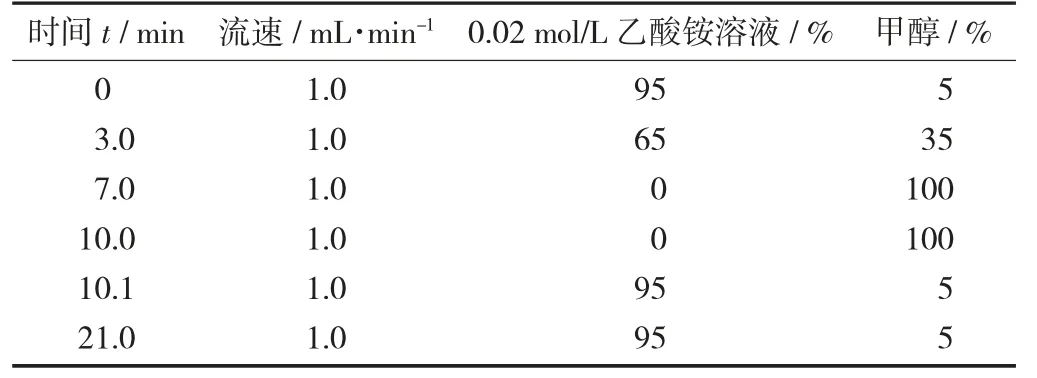
表1 流动相梯度洗脱
2 结果与分析
2.1 考查解析溶液对赤藓红色素回收率的影响
分别考查以下解析溶液:乙醇∶氨水溶液∶水=3∶1∶X,2∶1∶X,1∶1∶X,0∶1∶X,1∶0∶X。其中,水的比例X 均为10%,乙醇和氨水溶液共占90%,根据不同比例调整。按照1.3 的试验方法,因为考查解析溶液对回收率的影响,因此以G3 垂融漏斗抽滤后直接用解析溶液解析5 次,收集解析液,加乙酸中和,蒸发至近干,加水溶解,定容至5 mL。
该试验最终定容溶液的颜色差别较大,仅从最终定容溶液的颜色可判别出不同解析溶液对赤藓红色素的回收率的影响。试验结果表明,乙醇∶氨水溶液∶水= 2∶1∶X,即解析溶液为乙醇∶氨水溶液∶水= 60∶30∶10 时解析溶液对赤藓红色素的解析效果最好,赤藓红色素回收率最高。参照GB 5009.35—2016 中解析溶液是乙醇∶氨水溶液∶水= 70∶20∶10,因此选择乙醇∶氨水溶液∶水= 60∶30∶10 和乙醇∶氨水溶液∶水= 70∶20∶10 这2 种解析溶液进行后续的试验研究。
2.2 考查洗脱溶液和解析溶液对色素回收率的影响
国标GB 5009.35—2016 中60 ℃,pH 值4 的水等洗脱溶液的作用是洗去样品溶液中的糖等杂质,便于高效液相色谱分析。试验研究不同洗脱溶液和解析溶液对色素回收率的影响。
洗脱溶液考查60 ℃,pH 值4 的水、甲醇、甲醇∶甲酸= 6∶4、甲酸4 种溶液,解析溶液考查乙醇∶氨水溶液∶水= 60∶30∶10 和乙醇∶氨水溶液∶水= 70∶20∶10 两种溶液,并选用胭脂红、日落黄、赤藓红3 种色素制成混合色素样品溶液来考查不同洗脱溶液和解析溶液对各种色素回收率的影响,为精确测定色素的回收率,采用高效液相色谱仪测定最终定容溶液中的色素含量,检测不同前处理方法对色素回收率的影响。
色素回收率1 见表2。
试验结果表明,洗脱溶液为甲酸时,3 种色素的回收率均在62%以下,洗脱溶液为甲醇∶甲酸= 6∶4 混合溶液时,胭脂红和日落黄的回收率均在84%以上,但是赤藓红的回收率均在58%以下,通过对比其他2 组试验数据,洗脱溶液含甲酸时,赤藓红色素的回收率会明显降低。温度60 ℃,pH 值4 的水、甲醇2 种洗脱溶液得出的色素回收率均在81%以上。当洗脱溶液为甲醇,解析溶液为乙醇∶氨水溶液∶水= 60∶30∶10 时,3 种色素的回收率较高,洗脱溶液为60 ℃,pH 值4 的水、甲醇∶甲酸= 6∶4、甲酸,2 种解析溶液乙醇∶氨水溶液∶水= 60∶30∶10 和乙醇∶氨水溶液∶水= 70∶20∶10 对色素回收率的影响差别不明显。
2.3 进一步考查洗脱溶液和解析溶液对色素回收率的影响
综合试验2.2,表明60 ℃,pH 值4 的水和甲醇2 种洗脱溶液提取的色素回收率均在81%以上,因此考查60 ℃,pH 值4 的水和甲醇组合洗脱溶液对色素回收率的影响,为加强试验结果的对比性,用60 ℃,pH 值4 的水和甲醇2 种单一的洗脱溶液做对比试验,同时继续考查2 种不同解析溶液乙醇∶氨水溶液∶水比例为70∶20∶10 和60∶30∶10 对色素回收率的影响。
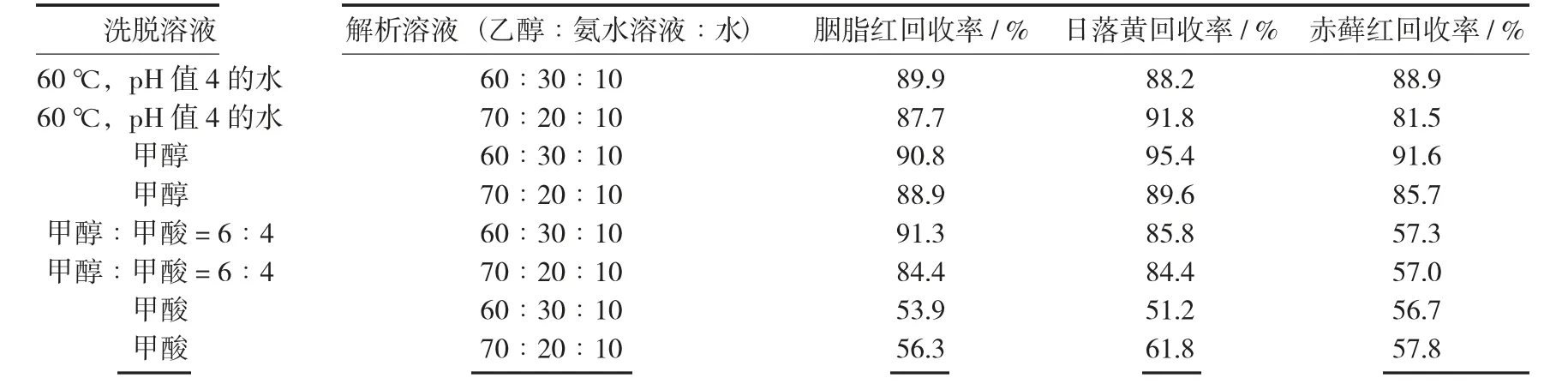
表2 色素回收率1
色素回收率2 见表3。
试验结果表明,洗脱溶液为甲醇,解析溶液为乙醇∶氨水溶液∶水= 60∶30∶10 时,3 种色素的回收率均最高。组合洗脱溶液的色素回收率没有单一洗脱溶液的色素回收率高,每增加一种洗脱溶液,色素的回收率会有所下降。上述试验中组合洗脱溶液和60 ℃,pH 值4 的水对赤藓红回收率影响较大。因此,含赤藓红的食品检测色素时可以采用甲醇作为洗脱溶液并用乙醇∶氨水溶液∶水= 60∶30∶10作为解析溶液。

表3 色素回收率2
3 结论
参照国标GB 5009.35—2016《食品安全国家标准 食品中合成着色剂的测定》,含赤藓红色素的食品检测色素时可以采用的前处理方法如下:用甲醇作为洗脱溶液,再用乙醇∶氨水溶液∶水= 60∶30∶10 作为解析溶液,该条件下胭脂红回收率为91.9%,日落黄回收率为94.2%,赤藓红回收率为92.6%。国标GB 5009.35—2016 检测赤藓红色素时,不能和胭脂红等色素采用同样的前处理方法是因为国标方法前处理过程中的洗脱溶液甲醇-甲酸混合溶液对赤藓红色素的损耗较大,其次是60 ℃,pH 值4 的水。因此,含有赤藓红色素的食品检测色素时前处理过程中应尽量避免这2 种溶液。色素检测前处理过程中每增加一种洗脱溶液,色素的回收率都会有所下降。因此,在保证色素检测结果准确的条件下应当尽可能减少前处理过程中洗脱溶液的种类和洗脱次数。
