环境污染物与肠道菌群互作关系的研究进展
2020-11-13冯宇希冯乃宪陈昕王一泽郭静婕莫测辉
冯宇希,冯乃宪,陈昕,王一泽,郭静婕,莫测辉
暨南大学生命科学与技术学院,广州 510632
在哺乳动物的胃肠道中,微生物的数量高达1012~1014个,是体内细胞的10倍以上[1-2]。人体肠道微生物基因组编码约有330万个非冗余微生物基因,约为人类基因组的150倍[1-3]。因此,肠道微生物也被称为人体的“第二基因组”[4]。肠道微生物主要由细菌、真菌、古菌、原生动物和病毒组成,其中,细菌是胃肠道中最重要的菌群,主要包括厚壁菌门、拟杆菌门、放线菌门、变形菌门、梭菌门和疣微菌门[5],成年人胃肠道微生物中99%以上的基因来自细菌。消化道不同部位的pH、免疫因子和消化酶类不同,其相应的微生物数量和组成存在较大差异,如细菌数量由高到低依次为盲肠和结肠(1010~1011CFU·mL-1)、小肠(107~108CFU·mL-1)、空肠(103~105CFU·mL-1)、十二指肠(103~104CFU·mL-1)、胃部(<104CFU·mL-1)[6-7]。研究表明,由于个体基因型、所处地理位置、生活方式和年龄的差异,其肠道微生物群落结构和多样性存在明显差异[4-8]。例如城市化程度越高,人体肠道微生物的多样性和丰富度越低,而偏远乡村居民的肠道微生物中普氏菌属所占的比例更高[9]。
作为人体的重要“代谢器官”[10],肠道微生物在维持宿主肠内平衡、调节机体各种生理活动等方面发挥着重要作用[11]。肠道微生物的主要功能可以归纳为:维护肠道上皮细胞的屏障功能(机械屏障、化学屏障、生物屏障和免疫屏障);抑制病原体粘附于肠道表面;调节免疫系统;代谢不易消化的食物,如植物多糖纤维素等;产生益生代谢产物,如短链脂肪酸(SCFAs)和维生素等[11-13]。肠道微生物失调可导致促炎症的肠腔内环境,引起代谢紊乱和慢性炎症。研究表明,克罗恩病、肥胖、糖尿病和癌症等疾病的发生与肠道菌群的改变密切相关[14]。另外,肝脏是人体最大的消化腺,与肠道具有密切的功能关系,肠道受损使肝脏直接暴露于肠源性内毒素,同样,肝脏正常的生理功能遭到破坏很大可能导致肠道功能紊乱[15]。肠道菌群与肠道和肝脏互作机制也越来越引起人们的关注。
目前,关于环境污染物对肠道菌群影响的研究主要集中于肠道菌群的结构和多样性,对于环境污染物、肠道微生物和宿主健康之间互作机制研究鲜有报道。环境污染物主要通过摄食进入人体消化道,其与肠道微生物相互作用,破坏肠道菌群稳态,导致机体代谢异常、营养吸收障碍和免疫系统功能紊乱等[16]。
随着宏基因组、宏代谢组、宏转录组和宏蛋白组技术的出现,让我们更清晰的认识到环境污染物与肠道微生物/宿主健康之间的因果关系。本文综述了不同环境污染物诱导肠道紊乱的机制,提出了以肠道菌群为靶器官分析污染物对宿主健康影响的关键步骤,为肠道微生物毒理学研究提供新的思路。
1 环境污染物对肠道微生物的影响(Effects of pollutant on gut microbiota)
1.1 重金属对肠道微生物的影响
由于持久性、生物富集性和微量致毒性,重金属已经成为全球环境污染问题[17]。多种重金属被世界卫生组织(WHO)和国际癌症研究机构(IARC)列为食品污染重点控制对象。近年来,关于重金属对肠道菌群影响的研究多有报道,以肠道菌群为研究对象,为评价重金属污染对人体健康威胁提供了一种新的思路。
1.1.1 Cd对肠道微生物的影响
Cd是自然环境中对人体和动物毒性最强的重金属之一,被联合国环境规划署列为全球性危险物质之首,并被WHO确定为优先控制食品污染物[18]。Cd暴露会引起宿主肠道菌群失调和代谢异常[19-23]。研究发现,Cd改变哺乳动物肠道菌群的群落结构,由于Cd的暴露,成年大鼠肠道内的厌氧菌、好氧菌和乳酸菌均显著减少,小鼠肠道微生物枝菌属(Alistipes)和内脏臭气杆菌(Odoribacter)的丰度显著增加,而柔膜细菌目(Mollicutes)和瘤胃球菌科(Ruminococcaceae)的丰度显著减少;另外,Cd污染造成肠道真核生物、细菌和病毒的丰度分别降低了0.14%、1.22%和2.52%,而古菌的丰度则增加了99.16%[24]。Cd污染改变了与肠道微生物碳代谢、蛋白质和氨基酸代谢及合成、葡萄糖代谢、氧化磷酸化、谷胱甘肽代谢相关的基因表达[23],其中,参与短链脂肪酸的关键基因拷贝数明显低于对照组,由于结肠短链脂肪酸水平明显下降,影响肠上皮细胞的能量供应、肠腔pH和电解质平衡、肠道高敏感和肠道动力的调节、抗炎及抗肿瘤作用等肠道生理功能,可能诱发肠道相关疾病[20-25]。
肠道微生物具有限制重金属进入机体内环境的功能。例如,用Cd灌胃6周的小鼠毒性实验结果表明,无菌小鼠肝脏、肾、血液和肠道的Cd含量是普通SPF小鼠的5倍~10倍,说明肠道微生物可以显著减少肠道重金属的生物利用度[26]。研究发现,普通SPF小鼠肠道组织内的金属硫蛋白相关基因Mt1和Mt2相对表达量较低,因此,重金属不易被运送至外周血液[26]。普通SPF小鼠与无菌小鼠在生理结构上也有不同,无菌小鼠上皮细胞周转降低[27],肠道蠕动缓慢,虽然主动吸收不受肠道微生物的影响,但被动吸收在无菌状态下会增加[28],这些因素都促使无菌小鼠比普通SPF小鼠组织器官内所累积的重金属要多。
1.1.2 As对肠道微生物的影响
人体As暴露的途径主要是通过摄入被污染的饮用水和食物,肠道菌群最易受到影响。研究发现,As暴露可以改变儿童肠道菌群丰度,高浓度As暴露的儿童粪便中变形菌门(Proteobacteria)的丰度高于低浓度As暴露相关菌群的丰度[29]。小鼠As暴露(10 mg·L-1)4周后,肠道微生物组成和代谢发生明显变化,其中,厚壁菌门(Firmicutes)丰度降低,拟杆菌门(Bacteroidetes)丰度增加,肠道中脂质代谢产物、含吲哚代谢产物、异黄酮代谢产物和胆汁酸代谢产物发生改变[30]。As和Fe共同暴露导致小鼠肠道菌群中乳杆菌(Lactobacillus)丰度增加,As或Fe单独暴露后,拟杆菌门(Bacteroidetes)、巴恩斯氏菌属(Barnesiella)和拟杆菌属(Bacteroides)菌属的丰度降低,表明Fe暴露能够拮抗As对肠道微生物影响[31]。胃肠道和肠道微生物模拟实验中,同样发现Fe对As代谢和毒性具有一定的拮抗作用[32]。Chi等[33]通过宏基因组技术研究了As对小鼠肠道微生物的影响机制,在碳水化合物代谢方面,丙酮酸发酵、短链脂肪酸合成和淀粉利用等方面发生了显著的变化。
1.1.3 Cr对肠道微生物的影响
Cr是环境中常见的重金属,通常有Cr(Ⅵ)和Cr(Ⅲ)2种形式[32]。其中,Cr(Ⅵ)被美国环境保护局(US EPA)列为A类人类致癌物和优先控制污染物[32]。与Cr(Ⅵ)不同,Cr(Ⅲ)通常用作动物和人体微量元素和营养元素,而且Cr(Ⅲ)的迁移性差,很难被人体吸收[34]。尽管Cr是人体的必需元素,但过量摄入会导致过敏反应以及肿瘤等。饮用水中Cr(Ⅵ)含量在1~10 mg·L-1时对人体是安全的,因为胃肠道能够将Cr(Ⅵ)转化为Cr(Ⅲ)[35]。大鼠经Cr(Ⅵ)(10 mg·L-1)暴露10周后,对其盲肠菌群进行富集培养,发现Cr(Ⅵ)能够刺激乳杆菌(Lactobacillus)、假单胞菌属(Pseudomonasspp.)和大肠杆菌(Escherichiacoli)等菌属的增长,可能起到Cr益生元的作用[36]。Wu等[37]的研究表明,7周1 mmol·L-1Cr(Ⅵ)处理下,小鼠肠道微生物中变形菌门、拟杆菌门和放线菌门发生了显著改变[37],说明Cr(Ⅵ)对肠道微生物具有一定的影响。
1.1.4 Pb对肠道微生物的影响
Pb能够中断机体能量的产生和其他代谢过程[38],而肠道微生物在机体代谢中起着至关重要的作用。Pb污染暴露导致成年雄性斑马鱼肠道中粘液体积增加,肠道微生物的丰富度和多样性显著变化。α-变形菌门(α-Proteobacteria)的丰度显著降低,厚壁菌门(Firmicutes)的丰度显著增加。微生物代谢产物分析结果显示,共有41种代谢产物显著变化,这些变化主要与果糖和脂类代谢、氨基酸代谢和核苷酸代谢的通路有关[39]。Pb暴露改变了肠道微生物群落结构/多样性,还对维生素E、胆汁酸、氮代谢、能量代谢、氧化应激和防御/解毒机制等多种代谢途径均有明显干扰[40]。Pb不但能对肠道微生物产生显著的影响,通过肠-肝轴影响肝脏脂质代谢相关的关键基因表达,导致肝脏代谢紊乱[39]。
肠道微生物可能通过主动摄入或被动吸收而减少重金属对机体的伤害。肠道微生物还可以通过多种方式抑制重金属从肠道向外周血液或组织扩散。肠道微生物对污染物的响应特征和外部环境中的微生物类似,它们可以通过细胞壁将重金属结合,如与肽聚糖和磷壁酸的离子交换反应,通过核形成的反应产生沉淀,与氮氧配体络合等。生物吸附、氧化和生物积累/酶还原是微生物与有毒金属相互作用的生物化学过程[41]。肠道微生物还可以维持肠道屏障的完整性,并且肠道微生物及其代谢产物可以调节肠道内环境,包括pH值、氧化平衡和酶活性等,这些均对肠道抵抗重金属污染的能力产生影响。以上研究结果显示,代谢产物是污染物诱导下肠道微生物健康评价的重要生物标记物。据报道,与机体碳水化合物、脂类和氨基酸代谢有关的代谢产物能够调控肠道微生物群落结构和丰度变化[31]。重金属胁迫下,碳水化合物和无机离子的转运代谢、次生代谢产物的生物合成、转运和分解代谢以及氨基酸转运代谢的相关基因表达丰度均发生显著变化,说明重金属胁迫能够诱导肠道微生物群落结构及丰度变化而引发疾病。环境污染物诱导肠道微生物群落结构和功能的改变,从而使代谢产物改变,代谢产物的改变又反过来影响肠道微生物和宿主健康。除了肠道微生物代谢分析外,转录组也是表征污染物对肠道微生物影响的重要手段,是研究污染物、肠道微生物及其代谢产物共同作用于肠道细胞的重要表征手段。
1.2 持久性有机污染物对肠道微生物的影响
持久性有机污染物(persistent organic pollutants, POPs)已经成为全球性的问题,引起了各国政府的高度重视,主要包括有机氯农药、多氯联苯、多溴联苯醚和多环芳香烃等。食物和水的摄入被认为是POPs主要的暴露途径,长期饮食中接触POPs也可能导致肥胖和2型糖尿病[42]。POPs的化学性质与重金属截然不同,这就导致其对肠道微生物及宿主健康的作用机制也不同。
1.2.1 多环芳烃(PAHs)对肠道微生物的影响
PAHs具有较大的致癌作用。肝中的酶可将PAHs转化为水溶性共轭代谢物,这些代谢物有时比其相应的母体化合物的毒性更大[43]。人体摄入的PAHs进入肠细胞和肝细胞可作为多环芳烃受体(AhR)配体,肠道微生物可以催化PAHs转化为环境激素。这种生物激素可能是PAHs毒性的潜在机制[44]。肝脏代谢物通过胆汁排泄到肠道,其代谢产物在肠道中的归趋及其对肠道微生物的影响尚不清楚。大西洋鳕鱼(Gadusmorhua)暴露于0.0~0.1 mg·L-1原油污染物28 d后,在其胆汁中检测到了PAHs的代谢产物,较高浓度的原油暴露导致大西洋鳕鱼肠道微生物整体多样性丧失,菌群结构发生改变,其中,紫单胞菌科(Porphyromonadaceae)、理研菌属(Rikenella)、瘤胃菌科(Ruminococcaceae)、另枝菌属(Alistipes)和梭菌目(Clostridiales)等不同菌的相对丰度降低,脱硫杆菌目(Deferribacterales)相对丰度在增加,脱铁杆菌目(Deferribacterales)可能作为大西洋鳕鱼受原油污染后健康状况的微生物标记[45]。喂食小鼠剂量为50 mg·kg-1的苯并芘(B[a]P),小鼠回肠黏膜和结肠黏膜均表现出炎症反应,在其粪便中拟杆菌科(Bacteroidaceae)拟杆菌属(Bacteroides)、帕拉普氏菌科(Paraprevotellaceae)帕拉普氏菌属(Paraprevotella)和产碱杆菌科(Alcaligenaceae)等菌的比例在增加,乳酸细菌科(Lactobacillaceae)罗伊氏乳杆菌(Lactobacillus)和瘤胃菌科(Ruminococcaceae)颤螺菌属(Oscillospira)的比例减少[46]。Defois等[47]运用体外培养方法进一步的分析了B[a]P对人粪便肠道微生物转录组和代谢组的影响,B[a]P暴露未引起粪便中微生物结构的显著变化,但表征微生物生物活性的挥发性有机物(VOCs)发生了改变,与维生素和辅助因子代谢、细胞壁复合代谢、DNA修复和复制系统、芳香族化合物代谢等多种代谢途径相关的转录本水平上调,而与糖酵解-糖异生途径和细菌趋化作用有关的转录本水平下调,再次证实了B[a]P会改变人体肠道微生物群的活动[47]。
1.2.2 多氯联苯(PCBs)对肠道微生物的影响
Zhang等[48]研究发现,2,3,7,8-四氯二苯并呋喃(TCDF)改变了小鼠肠道菌群中与胆汁酸代谢有关的厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)的比例,同时发现丁酸弧菌(Butyrivibriospp.)的丰度增加,示波杆菌(Oscillobacterspp.)丰度降低,并且TCDF还能够抑制法尼醇X受体信号通路,导致炎症反应和宿主代谢紊乱,并以AhR依赖的方式改变肝脂肪生成、糖异生和糖原分解。PCBs和高脂饮食互作可以显著改变细菌厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)的比例和丰度。暴露于PCBs导致了更高的体脂百分比,腹部皮下脂肪细胞更大,促炎细胞因子包括TNF-α、iNOS和IL-6的表达增加[49]。环境污染物对肠道微生物毒性的常见机制和指示性细菌,通常是通过雌激素受体(ER)和AhR介导的信号传导[50]。斑马鱼对阿特拉津和PCBs具有化合物依赖和性别依赖的特点,但主成分分析结果显示,ER和AhR在参与肠道微生物失调方面起的作用较小。通过对肠道活力、上皮渗透性、炎症和氧化应激的评估可知,其对肠道和肝脏生理功能有不同程度的损害[50]。
1.2.3 多溴联苯醚(PBDEs)对肠道微生物的影响
PBDEs具有较低的溴代同源物,会破坏甲状腺系统的功能并损害中枢神经系统的发育,其对肠道微生物的影响目前研究的还非常少。将成年斑马鱼持续暴露于5.0 ng·L-1的五溴代混合物(DE-71),斑马鱼肠道微生物的改变具有性别依赖特点,支原体(Mycoplasma)、瘤胃梭菌属(Ruminiclostridium)、厚壁菌属(Firmicutessensustricto)和梭杆菌属(Fusobacterium)等微生物种群从肠道菌群中消失。同时,肠道细菌代谢功能也受DE-71的影响,包括能量代谢、毒力、呼吸、细胞分裂、细胞信号和应激反应等。肠道微生物通过促进有利菌属的繁殖,减少不利菌属的生存,在DE-71胁迫下,菌群相互作用,建立适者生存群落。同时发现斑马鱼肠道微生物与生理活动(如氧化应激、解毒、神经传递和上皮细胞完整性)的显著相关性[11]。
1.3 农药对肠道微生物的影响
农药可以通过食物链传递给人和动物,由于一些农药具有强效的抗菌活性,因此会对肠道微生物产生不利影响。农药对肠道微生物的组成和代谢有较大影响。研究表明,杀虫剂二嗪农对小鼠肠道微生物群落结构的影响具有性别特异性,如毛螺菌科(Lachnospiraceae)的微生物在雄性和雌性小鼠肠道中显著降低,而潜在流行性致病菌如伯克氏菌目(Burkholderiales)只在雄性小鼠中观察到,毛螺菌科(Lachnospiraceae)、瘤胃菌科(Ruminococcaceae)、梭菌科(Clostridiaceae)和丹毒丝菌科(Erysipelotrichaceae)科的细菌则在对于雌性小鼠肠道菌群中减少;一些参与神经递质及相关代谢物合成的关键基因表达受到干扰,尤其是雄性动物,如色氨酸合成酶β链显著降低,而雌性小鼠中没有明显变化;同时还发现,由肠道中厌氧菌属(Bacteroides)、梭菌属(Clostridium)、真杆菌属(Eubacterium)、乳杆菌(Lactobacillus)和埃希氏菌属(Escherichia)及好氧菌放线菌门(Actinobacteria)和变形菌门(Proteobacteria)共同调控的胆汁酸丰度也明显改变[51-52]。Lozano等[53]研究发现,草甘膦对于肠道微生物的影响具有一定的性别依赖特征[53]。这种性别依赖反应可能显示出一种内分泌-肠道微生物群关系[54]。二嗪农是具有内分泌干扰作用的化合物,雌性激素诱导肿瘤发病率的增加可能与肠道微生物性别依赖有关[55-56],这一机制目前还不清楚。
草甘膦能够影响昆虫如蜜蜂的行为和繁殖能力。草甘膦能影响蜜蜂肠道微生物组成,一些蜜蜂肠道微生物和菌株对草甘膦的敏感性不同,与它们是否具有5-烯醇式丙酮酰莽草酸-3-磷酸合成酶(EPSPS)基本一致:Ⅰ类(对草甘膦敏感)或Ⅱ类(对草甘膦不敏感);肠道菌群的失调会增加致病菌粘质沙雷菌(Serratiamarcescens)入侵几率,最终影响蜜蜂的发育、营养和抵御天敌的能力,这些肠道微生物的干扰可能会使蜜蜂更容易受到环境压力的影响,包括营养不良和病原体入侵[57]。
一些农药不仅干扰肠道微生物,而且会破坏机体肠道屏障,导致炎症反应和胃肠道疾病的发生。毒死蜱(CPF)也是一种有机磷杀虫剂。Condette等[58]的研究表明,慢性CPF暴露对上皮屏障有很强的影响,尤其是消化系统还不成熟时。在部分肠段,ZO-1和claudin 4的细胞定位发生改变。最后观察到脾脏的细菌移位[58]。因此,CPF诱导下,TJ蛋白表达和定位的改变可能与该模型中的肠屏障功能障碍有关。大分子和肠道病原菌不受控制地通过肠道上皮可能是消化道炎症疾病的危险因素。
有机氯农药p,p’-滴滴伊(p,p’-DDE)和β-六六六(β-HCH)对小鼠肠道微生物和胆汁酸代谢的影响显示,p,p’-DDE和β-HCH能够增加厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)的丰度,而降低拟杆菌门(Bacteroidetes)、疣微菌门(Verrucomicrobia)、放线菌门(Actinobacteria)和糖化细菌门(Candidatus Saccharibacteria)的丰度。p,p’-DDE和β-HCH改变肠道微生物结构的同时,减少了回肠胆汁酸的再吸收,增强肝胆汁酸的合成。因此,p,p’-DDE和β-HCH暴露可能引起胆汁酸代谢紊乱,可能引起人类相关疾病[59]。对暴露于啶酰菌胺、克菌丹、毒死蜱、噻吩酸酯、噻虫啉和福美锌混合物中的小鼠进行研究发现,这些污染物对小鼠肠道微生物的扰动非常大,该研究发现即使在日耐受摄入量许可的范围内,混合农药仍然会导致小鼠肠道微生物紊乱,从而导致肥胖症或糖尿病[60]。
1.4 抗生素对肠道微生物的影响
抗生素是指一类用于杀死或抑制存在于人类和动物宿主内细菌的天然、半合成或合成的化合物[61],主要包括有β-内酰胺类、氨基糖苷类、大环内酯类、四环素类、喹诺酮类和磺胺类等。抗生素的广泛使用导致耐药菌株以及各种胃肠道、过敏和药物特异性反应的出现,5%~35%的治疗人群出现抗生素相关性腹泻[62]。抗生素可以直接作用在肠道微生物,即使某些抗生素浓度很低,也会导致肠道微生物群落结构发生变化。长期暴露于抗生素,肠道就成为培养耐药菌株的温床。除了关注药物剂量的抗生素诱导的肠道微生物失调与人类健康关系外,也应该关注环境剂量抗生素诱导肠道微生物产生抗性的机制。
在微量浓度的情况下,食品中的抗生素也会干扰小鼠肠道菌群稳态,如氨苄青霉素显著增加变形菌门(Proteobacteria)的丰度,磺胺嘧啶降低双歧杆菌属(Bifidobacterium)和乳杆菌(Lactobacillus)的丰度[63]。四环素暴露2周后,小鼠肠道菌群从194个属降低到89个属,而厚壁菌门(Firmicutes)丰度从24.9%增加到39.8%,拟杆菌门(Bacteroidetes)丰度从69.8%降低到51.2%[64]。人在短期服用喹诺酮类和β-内酰胺类抗生素后,肠道微生物多样性降低了25%,这些抗生素增加了拟杆菌门/厚壁菌门(Bacteroidetes/Firmicutes)比例(p=0.0007,FDR=0.002),这2种抗生素增加了拟杆菌门比例(p=0.0003,FDR=0.016)[65]。早期接受抗生素治疗会对猪肠道系统有持续性影响,主要包括基因表达和微生物组成2个方面[66]。
大鼠喂食林可霉素(300 mg·kg-1)和克林霉素(200 mg·kg-1)28 d后,其肠道微生物多样性急剧降低,拟杆菌门(Bacteroidetes)和疣微菌门(Verrucomicrobia)的丰度急剧下降,厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)的丰度显著增加,软壁菌门(Tenericutes)和脱铁杆菌门(Deferribacteres)完全消失;血浆和粪便中的代谢产物如复杂脂类、脂肪酸及相关代谢物、氨基酸及相关化合物的代谢物发生了变化,胆汁酸的代谢受到明显的影响,表现为一种指示微生物群落破坏的特定代谢模式[67]。万古霉素和环丙沙星暴露下,雌性小鼠尿液和粪便的代谢特征都受到了显著的影响,引起了胆碱代谢、宿主-微生物共代谢物、短链脂肪酸的产生和蛋白质/嘌呤降解的变化。大鼠口服3种不同的抗生素(万古霉素、链霉素和罗红霉素),代谢产物对肠道微生物有复合特异性作用。
早期大环内酯类抗生素治疗加速了小鼠1型糖尿病(T1D)的发展,随着抗生素使用疗程的增加,其肠道菌群的多样性显著下降,同时发现盲肠、肝和血清代谢产物发生改变,对回肠和肝脏的染色质状态产生性别特异性影响,并扰乱回肠基因的表达,从而改变正常的成熟模式。在抗生素与儿童超重/肥胖的关联性研究中发现,抗生素暴露与儿童超重/肥胖紧密相关,可能与拟杆菌门/厚壁菌门(Bacteroidetes/Firmicutes)的比例有密切关系[68]。抗生素扰动共生菌群,可增哮喘的风险[69]。1996—2012年,加拿大213 661对母婴调查研究发现,36.8%儿童有产前抗生素暴露,10.1%儿童罹患哮喘,母亲产前使用抗生素与儿童哮喘风险上升相关,呈剂量效应关系。妊娠各期、孕前9个月和产后9个月母亲使用抗生素,与儿童哮喘的关联性相似,此关联为非直接因果关系或非妊娠特异性[69]。动物实验也证明,大部分抗生素对过敏性疾病有不良影响,特定细菌可加剧或缓解过敏和哮喘。分别用氨苄青霉素(150 mg·kg-1·d-1)、庆大霉素(4 mg·kg-1·d-1)和甲硝唑(30 mg·kg-1·d-1)的混合抗生素对猪进行回肠灌注,灌注抗生素未影响近端回肠菌群组成,但明显改变了粪便菌群的组成,降低其多样性和丰富度,粪便、血液和下丘脑中的芳香族氨基酸显著减少,伴随下丘脑中芳香族氨基酸(AAA)衍生物5-羟色胺和多巴胺浓度下降,神经递质转运蛋白和合成酶表达上升。抗生素作用于大肠菌群,可能影响AAA代谢,进而改变下丘脑神经递质表达[70]。不同类型和剂量的抗生素对共生菌群的共有影响包括降低菌群多样性、增加变形菌门丰度、增加厚壁菌门/拟杆菌门比例。生命早期的抗生素暴露以及相应的菌群变化与宿主代谢、免疫缺陷相关,会提高肥胖、过敏和炎症性肠炎等病症的发病风险[71]。Mitre等[72]通过对792 130名儿童中出生6个月内使用组胺-2受体拮抗剂(H2RA)、质子泵抑制剂(PPI)或抗生素的婴儿进行4.6年的跟踪研究,出生6月内使用可改变菌群的抑酸药物和抗生素可能促发过敏性疾病,并建议在有明确临床需要时才在婴儿期使用。
宿主肠道是一个大型的耐药基因库,有研究鉴定了1 093个耐药基因,发现中国人的耐药基因数量最多,其次是丹麦人和西班牙人[73]。同时,基于宏基因组法和网络分析方法建立了完整的抗生素耐药基因目录,11个不同国家180名健康人的粪便样本中共检测到20个抗性基因(ARGs)类型的507个ARG亚型,丰度范围从7.12×10-7到2.72×10-1个ARG/16S-rRNA基因拷贝。四环素、大环内酯-链球菌素、杆菌肽、万古霉素、β-内酰胺、氨基糖苷和多药耐药基因是最丰富的7种ARGs类型。180个个体共享ABC转运体、aadE、bacA、acrB、tetM、tetW、vanR和vanS,它们在人类肠道中很常见。与其他10个国家的人口相比,中国人口的ARGs数量最多[74]。环境中的抗生素不仅影响宿主肠道微生物,也增加了肠道中的抗性基因的发生率。将棉铃虫连续2周暴露于诺氟沙星和土霉素下,明显改变了其肠道微生物的组成和结构,降低了肠道细菌的多样性,显著增加了木棉虫中ARGs的多样性和丰度。Mantel检验和Procrustes分析均显示ARGs与肠道微生物存在显著相关(p<0.05)[75],四环素的处理剂量导致变形菌的减少,主要是由于埃希氏菌/志贺氏菌的减少(从72%降至58%),四环素对大肠杆菌的抑制是处理组中多种药物耐药的基因减少的主要原因,四环素处理下由双歧杆菌含有tetW而成为携带AGR的肠道微生物。肠埃希氏菌一直是多药耐药基因的主要宿主,而四环素处理导致氨基糖苷类耐药基因从大肠杆菌转移到克雷伯氏菌中[76]。在Jakobsson等[77]的研究中,患者接受含克拉霉素的联合抗生素治疗幽门螺杆菌相关的消化性溃疡时,其ermB抗性基因增加1 000倍,该基因在其治疗过程后立即编码大环内酯靶标修饰RNA甲基化酶,虽然受试者在整个研究过程中没有接受额外的抗生素,但他们的肠道微生物群在4年后仍然具有相当水平的抗性基因。
1.5 微塑料对肠道微生物的影响
环境微塑料是一种新兴污染物,指的是直径<5 mm的塑料颗粒[78],最早被发现是在海洋生态系统中。近年来陆地生态系统、河流和湖泊生态系统中也陆续被报道。微塑料粒径小、数量多且分布广,容易被生物所吞食而在食物链中累积[78-79]。微塑料对生物的潜在危害不容忽视。目前,关于微塑料对生物肠道微生物的影响研究还处于起步阶段。暴露在1 000 μg·L-1的微塑料中,斑马鱼肠道菌群中拟杆菌门(Bacteroidetes)和变形菌门(Proteobacteria)的丰度显著降低,而厚壁菌门(Firmicutes)的丰度显著增加,与免疫相关的基因IL1α、IL1β、Ifn和IL8的表达明显改变,且IL1α、IL1β和Ifn的含量也明显改变[39]。Pedã等[80]研究发现,微塑料是欧洲鲈鱼肠结构和功能恶化的原因之一,在90 d的暴露中,其后肠病理改变从中度到重度逐渐发展。Cao等[81]研究不同浓度的微塑料(PS,58 μm)对赤子爱胜蚓(E.foetida)的影响发现,低浓度微塑料对赤子爱胜蚓(E.foetida)丰度的影响很小,而高浓度(1%或2%)显著抑制其生长并增加其死亡率。事实证明,大量的微塑料存在于土壤环境系统中[82],那么微塑料对土壤生态系统肠道微生物的影响如何?对寡毛纲动物线蚯蚓(Enchytraeuscrypticus)喂食其体重的0、0.025%、0.5%和10%的微塑料颗粒(0.05~0.1 μm),评估微塑料对寡毛纲动物生长和肠道微生物的影响。结果表明,喂食寡毛纲动物线蚯蚓(Enchytraeuscrypticus)微塑料(10%)显著降低了其肠道内对氮循环和有机物分解起关键作用的肠道微生物根瘤菌科(Rhizobiaceae)、黄色杆菌科(Xanthobacteraceae)和球藻科(Isosphaeraceae)的相对丰度[83]。微塑料影响生物生长的机制主要包括降低动物食欲、营养不良、消化道磨损或者阻塞及引起一定的炎症等[83]。以上的实验证实了微塑料能够通过改变肠道微生物,而使土壤动物的体重降低。值得一提的是,在分析微塑料对土壤动物肠道微生物的影响时,除了单独喂食微塑料,也可将微塑料与土壤按照一定比例混匀,来模拟真实的土壤微塑料污染环境。同时分析是否微塑料能够影响土壤微生物群落结构和丰度,而间接地影响到土壤动物的肠道微生物的结构和丰度。这将为揭示微塑料在土壤中的毒性机制提供了强有力的证据。另外,大量的塑料碎片中检测到了PCBs、PAHs、PBDEs、卤化阻燃剂、农药、壬基酚和重金属等[84-85],微塑料耦合环境化合物对肠道微生物的影响又是如何?也是值得关注的问题。
微塑料对哺乳动物肠道微生物和健康的影响是一个热点研究方向,目前,主要通过小鼠暴露实验评估微塑料对人体的危害程度。Lu等[86]研究发现,通过5周灌胃小鼠不同粒径和不同浓度的微塑料,灌胃1 000 μg·L-1的小鼠肠道黏膜厚度减小,粪便中的厚壁菌门(Firmicutes)和α-变形菌门(α-Proteobacteria)的丰度在减少;肝甘油三酯(TG)和总胆固醇(TCH)水平也在下降[86]。Jin等[87]也发现,聚苯乙烯球微塑料可以减少小鼠肠道粘液的分泌,破坏肠道屏障功能,微塑料处理组放线菌含量明显下降,共15种细菌在接触微塑料后发生显著变化,微生物群落中功能基因的主要代谢通路受到微塑料显著影响,血清中氨基酸代谢和胆汁酸代谢的指标测定结果表明,微塑料引起代谢紊乱[87]。目前,关于微塑料对陆地哺乳动物毒性的评估仍然非常有限,未来还需要更多的研究来评估其对人类健康的影响。
2 污染物对宿主健康的影响及评价模型(Effects of pollutants on hosts’ health and evaluation models)
2.1 环境污染物对健康的影响
除了关注环境污染物与肠道微生物的互作或对肠道微生物的影响外,更应该关注环境污染物对肠道微生物短期或长期毒性效应和毒性机制,从而建立一种环境污染物对肠道微生物毒性评价方法。肠道微生物相关的环境毒理学研究尚处于起步阶段[88],而已有的研究表明,剂量-反应关系仍然是评价污染物对肠道微生物风险的重要步骤,需综合考虑药物对宿主和肠道细菌的毒理[89]。污染物对肠道微生物的剂量-反应关系理论上应该存在,污染物在短时间内对肠道微生物丰富度和多样性不足以产生剂量-效应反应,这成为评价的难点。根据生态稳定性理论[90]和毒理学原理[91],我们提出了以肠道微生物为靶器官评价污染物致病的关键步骤和重要模型,环境污染物作用对象——肠道微生物是否产生中毒症状根据污染物的暴露剂量、作用模式和疾病形成这3个部分而定。
健康人的肠道系统能够保持和恢复自身结构与功能的相对稳定[92]。不同毒性强度的环境污染物均会引起多种肠道微生物丰富度降低(图1(a)),而这种变化具有很大的个体差异性,如何对肠道生态系统的稳定性进行评估和研究?其背后的生态学原理是否与自然生态系统的生态学稳定性原理相似?一个生态系统的稳定性表现在抵抗力稳定性和恢复力稳定性2个方面;抵抗力稳定性与恢复力稳定性存在相反关系。肠道生态系统由于营养级单一,因此抵抗力稳定性较弱,但是肠道中的微生物繁殖迅速、变异能力强、生态系统结构简单,故恢复力稳定性较强,这是符合生态学稳定性原理的。
假设低毒性污染物胁迫下的肠道微生物在一段时间内能够迅速恢复到初始状态,而中毒性或高毒性的污染物胁迫下肠道微生物恢复到初始状态需要更长的时间,若毒性过大可能会对肠道微生物和个体带来摧毁性的打击(图1(b))。MacPherson等[93]将70名健康志愿者分为2组,一组补充益生菌(鼠李糖乳杆菌R0011+瑞士乳杆菌R0052),另一组补充安慰剂,2组均同时使用抗生素(阿莫西林-克拉维酸),干预1周。使用抗生素后,2组的肠道微生物在科水平上的组成均发生显著变化,毛螺菌科和红蝽菌科比例下降,肠杆菌科、拟杆菌科和紫单胞菌科比例上升,但是在停止使用抗生素后,2组的菌群组成及耐药菌组成均快速恢复至基线水平[93]。类似地,Xiong等[76]分别用低剂量和治疗剂量的四环素连续7 d喂食鸡,分别在第0天、第5天、第10天和第20天取样,通过对第10天和第20天鸡粪便微生物的研究发现,低剂量组中优势的变形菌门(Proteobacteria)和厚壁菌门(Firmicutes)的组成变化与对照组相比没有显著差异;然而,四环素导致了分类门组成的显著变化,其中,变形菌门(Proteobacteria)的相对丰度从第0天的83%降低到第5天的75%。而作为变形菌门(Proteobacteria)的主要属,埃希氏杆菌属/志贺氏杆菌属(Escherichia/Shigella)在处理组中从第0天的70%显著降低至第20天的58%,相反,对照组中却没有明显变化[76]。因此,在评价肠道微生物稳定性时,不仅要从丰富性和多样性入手,同时应该评价受到污染物冲击后肠道微生物的恢复时间,以此断定不同个体肠道微生物抗干扰能力。
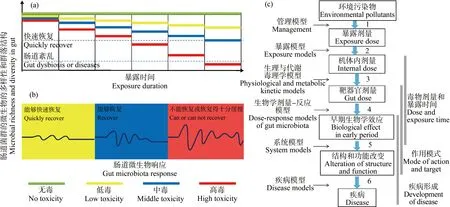
图1 污染物对肠道微生物的影响评价注:黄色表示低毒性污染物,蓝色表示中毒性污染物,红色表示高毒性污染物,毒性可根据实验大/小鼠的半数致死剂量(LD50)区分;(a)在不同毒性的污染物中连续暴露后,肠道微生物丰富度和多样性降低,低毒污染物在停止暴露后,可以快速地恢复到初始水平;中毒性污染物暴露后,可能可以快速恢复到初始水平;高毒性污染物停止暴露后,较难恢复到初始水平或导致肠道紊乱和疾病的发生;(b)肠道微生物受到污染物影响后的波动,黄色表示波动能够快速恢复,蓝色表示波动可以恢复,红色表示波动不能恢复或恢复得很慢;(c)污染物对宿主健康影响的决定性步骤和重要事件。Fig. 1 Evaluation of the influence of contaminants on intestinal microorganismsNote: Yellow indicates the low toxic pollutants; blue indicates the middle toxic pollutants; red indicates the high toxic pollutants; toxicity can be distinguished according to the half lethal dose (LD50) of experimental rats/mice; (a) the richness and diversity of gut microbes could be reduced during the exposure in different toxic pollutants, and the richness and diversity of gut microbes can quickly recover to the initial level after stopping the low toxic pollutant exposure; the richness and diversity of gut microbes may quickly recover to their initial levels after stopping the middle toxic pollutant exposure; however, the richness and diversity of gut microbes is very difficult to recover to initial levels or cause intestinal disorders and disease after cessation of exposure to highly toxic pollutants; (b) fluctuations of intestinal microorganisms affected by pollutants: yellow indicates that fluctuations can recover quickly, blue indicates that fluctuations can recover quickly, and red indicates that fluctuations cannot recover or recover slowly; (c) decisive steps and important events in the impact of pollutants on host health.
2.2 评价模型
以肠道微生物为靶器官建立了的环境污染物致病的关键步骤和模型[91]。污染物致病发生必须经过6个关键步骤和5个重要模型,构成暴露剂量、作用模式和疾病形成的三部分内容(图1(c))。6个决定性步骤包括污染物、外暴露剂量、机体内暴露剂量、靶器官剂量、早期生物学效应、结构功能改变和疾病发展过程,5个关键模型包括暴露模型、基于生理学代谢动力学模型、基于生物学剂量-反应模型、系统模型和疾病模型。
在污染物致病发生过程中,第1步决定性的步骤所涉及的关键模型应该属于管理模型,可能涉及环境管理、食品监管、政策执行和经济实力等方面,可以说管理模型与其他社会科学有紧密的关系,但管理模型不属于暴露剂量、作用模式和疾病形成的内容;从污染物暴露剂量到机体内剂量是污染物发病过程的第2步决定性步骤,需要采用暴露模型,该模型涉及污染物进入肠道的方式(主要是食物摄入);机体内暴露剂量转化为以肠道微生物为靶标的剂量是污染物致病发生的第3步决定性步骤,其为基于生理学代谢动力学模型;靶器官转化为早期生物学效应是污染物剂量转变为毒性表现的决定步骤,用基于靶器官剂量-反应模型来说明这一污染物致病发生过程,这是第4步决定性步骤所涉及的关键模型;如果让污染物继续作用,使靶器官中污染物浓度较高,将导致不可逆的毒性反应,污染物致病发生过程第5步就进入到机体结构-功能改变的决定步骤,这时即便清除污染物,也不可能恢复到健康水平。污染物发生过程的第5步决定性步骤将遇到生物系统模型,生物系统模型就是阐明生物体各系统受到污染物作用后的表现和相互联系;最后一步决定性步骤为结构-功能的改变致疾病过程,相对应的疾病模型事件也就是出现临床症状的内容。
肠道微生物较其他靶器官更为敏感,是能够反映污染物毒性的生物标记物。Kim等[94]将蚯蚓肠道微生物作为指示重金属毒性的生物标记物,发现肠道微生物群落活性检测在位点特异性毒性检测中具有很强的应用潜力,因为该检测仅需要从污染土壤中获得的蚯蚓新鲜肠道样本。不仅蚯蚓肠道微生物可以指示污染物,任何生物的肠道微生物都有希望成为污染物指示指标,但是需要建立模式生物肠道微生物和模式污染物之间的剂量-反应关系。肠道微生物剂量-反应关系是连接口服污染物剂量和疾病形成的关键纽带,但是如何像测量物体质量那样精确测量污染物的毒性,至今还是一个非常大的挑战。因此,本文提出了在不出现早期生物学效应的前提下,基于肠道微生物恢复到基线的时间/暴露测试时间来表征污染物对肠道微生物的毒性。这其中有很多工作需要做,包括:如何确定肠道微生物的急性、亚急性、亚慢性和慢性毒性的暴露时间,肠道微生物丰富性和多样性的变化是否具有浓度依赖的特性,如何用这种依赖特性转化为评价的数学模型等。可以通过模式生物的肠道微生物群落结构来判断该地区的特征污染物及污染程度。肠道微生物具有很强的恢复能力,如何利用肠道微生物修复体内微量的污染物,或者怎样在受到污染物胁迫后,重新塑造肠道微生物同样是一个全新的研究方向。
本文综述了重金属、POPs、农药、抗生素和微塑料等环境污染物与肠道微生物双向交互作用的各种机制,也总结了环境污染物对肠道和肠道微生物影响的普遍机制。很多污染物是通过与肠道微生物相互作用而导致机体出现代谢异常、免疫系统功能紊乱、营养吸收障碍或产生其他毒性症状。根据生态稳定性理论和毒理学原理,本文提出了评价污染物对肠道微生物稳定性的决定性步骤和重要事件,并提出了计算污染物肠道毒性的方法——以肠道微生物恢复到基线的时间/暴露测试时间来表征污染物对肠道微生物的毒性。肠道微生物丰富性和多样性的变化是否具有浓度依赖的特性?如何将这种依赖特性转化为评价的数学模型?是否可以通过模式生物的肠道微生物群落结构来判断该地区的特征污染物及污染程度?同时,肠道微生物具有很强的恢复能力,如何利用肠道微生物修复体内微量的污染物?或者怎样在受到污染物胁迫后,重新塑造肠道微生物?这些都是日后仍须深入研究和亟待解决的问题。
◆
